我國藥品批發企業監督檢查判定標準探索*
秦 媛,廖 均,宋 蕊
(四川省藥品技術檢查中心,四川 成都 610000)
《藥品經營質量管理規范》(GSP)是國家對藥品經營企業質量工作的規范性要求。實施GSP 對于提高藥品經營企業質量管理水平,規范企業藥品經營行為,保證藥品質量極其重要[1]。但很多藥品批發企業存在“重認證,輕管理”的心態,在GSP 認證檢查上精心準備,耗費大量的人力、物力、財力,故在認證檢查中很難發現企業存在的重大質量風險隱患,而企業一旦通過檢查獲得了“藥品經營許可證”,在日后的經營過程中往往會放松GSP的要求[2-3]。監督檢查可防止企業在換證后的5年時間里放松管理,監督企業規范化經營,落實主體責任,故監督檢查必不可少。為進一步規范藥品檢查行為,推動藥品監管工作盡快適應新形勢,國家藥品監督管理局(簡稱國家藥監局)于2021年5月頒布了《藥品檢查管理辦法(試行)》,各省級藥監局也結合各地實際情況制訂實施細則。在此,以《藥品檢查管理辦法(試行)》中的常規檢查(即監督檢查)為研究主體,以現行藥品批發企業監督檢查為樣本,通過制度研究、文獻調研等,結合自身檢查工作經驗,探索新形勢下的監督檢查判定標準。
1 現行監督檢查標準
1.1 相關文件
現行監督檢查為質量管理規范符合性檢查。按《中華人民共和國藥品管理法》(以下簡稱《藥品管理法》)、《中華人民共和國疫苗管理法》《中華人民共和國藥品管理法實施條例》《藥品經營質量管理規范》(總局令第28 號)、《總局關于與〈藥品經營質量管理規范〉相關的冷藏、冷凍藥品的儲存與運輸管理等修改5個附錄文件的公告》(2016年第197號)、《藥品經營質量管理規范現場檢查指導原則(修訂稿)》(食藥監藥化監〔2016〕160 號)(簡稱《指導原則》)、《藥品檢查管理辦法(試行)》的規定對企業開展監督檢查。
1.2 存在問題
《指導原則》監督檢查結果判定標準已不適用:為貫徹實施《藥品管理法》,國家藥監局于2019年配套發布《國家藥監局關于貫徹實施〈中華人民共和國藥品管理法〉有關事項的公告》(以下簡稱《公告》)。《公告》規定,自2019年12月1 日起,取消藥品的《藥品生產質量管理規范》(GMP)和GSP 認證,不再受理GMP 和GSP 認證申請,不再發放藥品GMP和GSP證書[4]。而《指導原則》為2016年發布,其監督檢查結果判定標準包括,符合藥品經營質量管理規范;違反藥品經營質量管理規范限期整改;嚴重違反藥品經營質量管理規范,撤銷藥品GSP 證書。這表明,《指導原則》的監督檢查結果判定出現了明顯滯后,已不適用于新法規下的監督檢查判定。
參照《指導原則》認證檢查結果判定標準不適用:《指導原則》中認證檢查結果包括通過檢查;限期整改后復核檢查;不通過檢查。但監督檢查是由監管部門主動發起的一類檢查,目的是幫助企業高質量發展,而認證檢查是依企業申請而發起的一類檢查,目的是發放(更換)證書。兩類檢查的目的屬性不一致,也導致了認證檢查結果判定標準不適用于監督檢查。
現行《藥品檢查管理辦法(試行)》判定標準缺乏指引:《藥品檢查管理辦法(試行)》第二十八條規定了藥品經營企業現場檢查結論和綜合評定結論的評定標準,其中未發現缺陷或缺陷質量安全風險輕微、質量管理體系較健全,檢查結論為符合要求;發現一般缺陷、主要缺陷且有一定質量安全風險,但質量管理體系基本健全,檢查結論為待整改后評定;發現嚴重缺陷,或發現的主要缺陷和一般缺陷涉及企業質量管理體系運行,可能引發較嚴重的質量安全風險,檢查結論為不符合要求[5]。在以往的藥品流通監督檢查中,依靠嚴重缺陷或主要缺陷和一般缺陷的缺陷數量對檢查結果進行判定,《藥品檢查管理辦法(試行)》發布后,引入了風險判斷的思維,除發現嚴重缺陷可直接判定檢查結論為不符合要求外,對于某些主要缺陷和一般缺陷,檢查組可根據風險識別劃分風險等級,也可判定其為不符合要求。但檢查組目前很難實現單一使用《藥品檢查管理辦法(試行)》進行準確判定,究其原因,一是檢查組在進行監督檢查時無法像認證檢查一般獲取企業提供的申報資料,從而無法充分了解企業狀況;二是尚未出臺相應的指導性文件,對于可判定為不符合要求的情形,仍未確定統一的判定標準和判定尺度。
2 檢查結論為不符合要求的情形
2.1 《指導原則》中的嚴重缺陷項目
《指導原則》中共涉及10條嚴重缺陷項目(見表1)。藥品批發企業做到合法、誠信經營,質量管理制度的建立,計算機系統的應用,藥品采購來源合法,票、賬、貨、款一致是保證企業經營藥品質量的前提和基礎,涉及此類缺陷往往表明企業存在重大質量風險,因此,一旦發現此類缺陷,即可判定企業不符合要求。
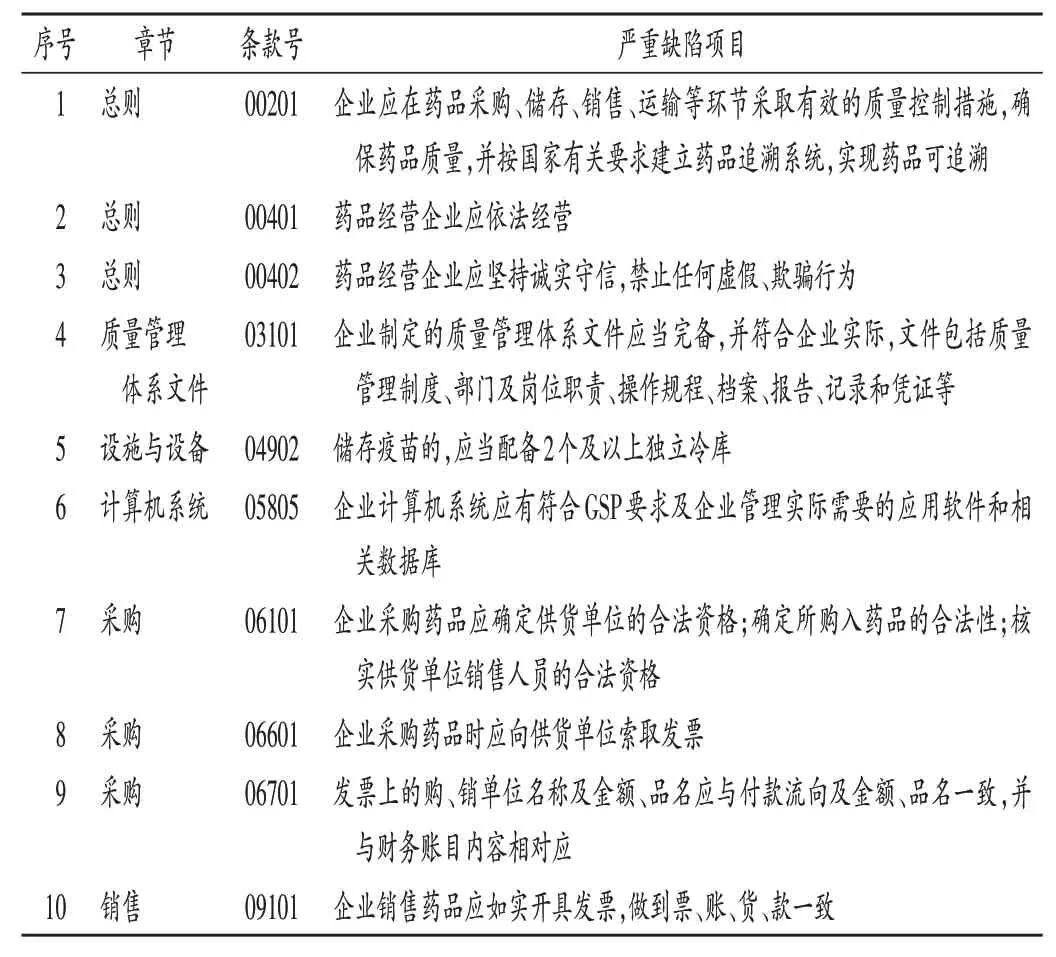
表1 嚴重缺陷項目表Tab.1 List of serious defective items
2.2 其他可能判定為不符合要求的情形
查閱省級GSP 認證檢查或監督檢查中的缺陷項目可發現,人員與培訓、儲存與養護方面出現的缺陷項均較頻發[6-10];計算機系統作為批發企業保障經營信息準確和管理高效的基礎,關系到企業GSP 的實施效果,對計算機系統進行監督檢查,應當是目前藥品監管部門進行檢查的重點[11];冷鏈藥品的運輸和配送與其質量密切相關。故結合自己在檢查過程中的經驗從以上4 個方面分析,闡述不涉及嚴重缺陷項目但存在較高風險(即可判定為不符合要求)的情形(見表2)。

表2 可能判定為不符合要求的情形Tab.2 Cases that may not meet the requirements
此12條情形可能引發較嚴重的質量風險,符合《藥品檢查管理辦法(試行)》中檢查結論為不符合要求的條件。但若檢查中發現上述12條情形,檢查組仍需根據現場情況視情節輕重及產生的實際影響進行綜合判定,不可一概而論地判定為不符合要求。
3 建議
3.1 與執法部門共同議定監督檢查結果判定標準
查詢全國31個省級行政區(除香港、澳門、臺灣外)藥監局官網可知,目前僅3 個省份出臺了《藥品檢查管理辦法(試行)》實施細則,分別為《河南省藥品檢查管理辦法實施細則(試行)》《山西省藥品檢查管理實施細則(試行)》《貴州省藥品檢查管理辦法實施細則(試行)》,以上實施細則中規定檢查結論和綜合評定結論均包括符合要求、基本符合要求、不符合要求。建議開展監督檢查時,依據國家藥監局和其他各省藥監局辦法的規定,給出結論。
在監督檢查結果判定標準缺少具體細則指引時,建議根據《藥品檢查管理辦法(試行)》要求,擬訂具有一定操作性的結果判定指引。建議將《總局關于整治藥品流通領域違法經營行為的公告》(2016年第94 號)[12]中列舉的10 種藥品流通領域違法經營行為、《指導原則》和企業典型違規行為結合起來,出臺科學有效的判定標準細則,統一檢查員結果判定的標準和尺度,更好地指導監督檢查的開展。
3.2 與執法人員共同開展檢查
按《藥品檢查管理辦法(試行)》規定,檢查組應由2 名執法人員和2 名檢查人員構成。建議吸納執法人員成為檢查員,用檢查員的思維開展符合性檢查,參與各轄區的監督檢查。當現場檢查中發現違法違規行為,執法人員第一時間轉換身份,合法取證,其余檢查員做好技術支撐,并在現場檢查報告中給出處置建議。從而促進檢查更符合法規要求及稽查檢查更好融合,使檢查結果能更好地轉化成稽查的利器,讓監管落地,引導企業完善質量體系,促進企業高質量發展。
3.3 構建監督檢查質量管理體系
建議構建統一的監督檢查質量管理體系。按ISO9001∶2008 質量管理體系要求,涵蓋現場檢查前準備工作,現場檢查工作的開展,檢查報告審核與處置,檢查現場突發情況的處置,檢查計劃、檢查方案的制定、變更,檢查報告的撰寫,檢查結果的移交;檢查員的準入、培訓、考核,檢查員的層級認定,現場檢查組的抽調、廉政教育及各類模板記錄的制定等內容。由一個機構發起質量管理體系認證,各監管部門參照執行,保證監督檢查工作有序開展。
4 結語
檢查機構要緊密關注藥品流通行業法律法規的出臺情況,企業實際情況,以及監管機構的監管需求,爭取在現行法規下和監管部門的支持下,制定一個既貼合監管需求,又符合企業實際狀況的結果判定指引標準,從而實現為監管部門做好技術支撐,為企業做好服務,助力醫藥企業高質量發展的愿景。

