基于網絡藥理學研究甘草瀉心湯治療復發性口腔潰瘍的作用機制
袁園,秦雷明,慶慧,崔偉鋒*
復發性口腔潰瘍(recurrent oral ulcer,ROU)是發病率很高的一種口腔黏膜類疾病,其發病率接近20%[1],具有周期性、復發性以及自限性等特點。ROU 發病人群的年齡一般在10~30 歲之間,且患病的女性較多。ROU 的發病機制目前尚不清楚,其發生可能與遺傳、免疫、飲食、微生物、微量元素缺乏、維生素缺乏、精神心理等多種因素有關[2],目前尚無特效治療方法[3]。現階段,西醫的治療以補充維生素、服用抗菌藥物等手段為主,但是長期服用易損傷肝腎功能并產生耐藥性,而且容易復發,部分患者的治療效果不理想[4-5]。中醫學將ROU歸為“口瘡”“口瘍”“口糜”等范疇,《金匱要略》[6]稱之為“狐惑病”,記載為“狐惑之為病,狀如傷寒,默默欲眠,目不得閉,臥起不安,蝕于喉為惑,蝕于陰為狐,不欲飲食,惡聞食臭,其面目乍赤、乍黑、乍白。蝕于上部則聲喝,甘草瀉心湯主之”。中醫學認為該癥多因胃熱脾寒引發口瘡,且外有熱象內有虛寒,為寒熱錯雜之證[7]。臨床上應用甘草瀉心湯治療ROU 已積累了豐富的臨床經驗且療效良好,但其作用機制尚不明確。基于網絡藥理學的方法可構建“疾病-藥物-成分-靶點”網絡,并從整體觀察及分析中藥組方對疾病的影響。中醫在臨證組方配伍時遵循方證一體觀,突出方劑的整體性能,網絡藥理學的研究方法與中醫的整體觀相符。本研究將運用網絡藥理學的研究方法和分子對接技術對甘草瀉心湯治療ROU 的作用機制進行探究,為臨床和進一步研究提供科學依據。
1 材料與方法
1.1 甘草瀉心湯的主要成分及靶點的獲取
在中藥系統藥理學數據庫與分析平臺(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)數據庫[8]中,將關鍵詞設置為“Herb name”并檢索 7 味中藥(半夏、黃連、黃芩、干姜、甘草、人參、大棗)的化學成分,根據口服利用度(oral bioavailability,OB)≥30% 以及藥物相似度(drug-likeness,DL)≥0.18 對成分進行篩選,以獲得有效活性成分及其作用的蛋白質靶點。
1.2 靶點名稱的標準化處理
在Uniprot 蛋白質數據庫[9]中輸入搜索到的蛋白質靶點,將Status 設為“Reviewed”,Popular organisms 設為“Human”,把檢索到的靶點名稱轉化為Official Gene Symbol,以便后續的數據分析。
1.3 “中藥-活性成分-相關靶點”網絡構建
將檢索出的藥物成分和蛋白質靶點合并整理后,導入Cytoscape 3.8.0 軟件繪制“中藥-活性成分-相關靶點”網絡圖。將度值(degree)從大到小排列,排名前4 位的有效活性成分作為關鍵活性成分。
1.4 蛋白質-蛋白質相互作用(protein-protein interaction,PPI)網絡構建
在GeneCards 數據庫[10]中以“recurrent oral ulcer”為關鍵詞進行檢索,得到疾病靶點485 個,與藥物成分靶點合并后去掉重復靶點,得到交集靶點43 個。利用STRING 數據庫[11]對交集靶點進行分析(將研究物種設定為“Homo sapiens”),得到蛋白質相互作用關系,然后將數據導入Cytoscape 3.7.1 軟件繪制PPI 網絡。利用Cytoscape 中的插件Network Analyzer 對所得到的網絡進行拓撲學分析,根據所得數據中的度值、緊密中心性、介數中心性3 個參數篩選出核心靶點。
1.5 基因本體論(gene ontology,GO)和京都基因和基因組數據庫(Kyoto encyclopedia of genes and genomes,KEGG)富集分析
將交集靶點導入微生信平臺(http://www.bioinformatics.com.cn/)進行KEGG 通路富集分析及GO 注釋,得到富集結果、GO 功能氣泡圖、KEGG 通路氣泡圖以及相關信號通路圖。
1.6 分子對接
選定的關鍵活性成分和核心靶點的分子對接模擬計算通過Autodock 1.5.6 軟件來完成。從PDB(Protein Data Bank)數據庫(https://www.rcsb.org/)中下載文件格式為PDB 的核心靶點結構文件,再從TCMSP 數據庫中下載文件格式為MOL2 的關鍵活性成分結構文件。在AutoDock 1.5.6 軟件中將蛋白質靶點的PDB 文件去水加氫設為受體,將活性成分的MOL2 文件加全氫后設置為配體;設置對接Box 后運行Autogrid4、設置對接參數及運算方法后運行Autodock4,得到分子對接結果。
2 結果
2.1 甘草瀉心湯活性成分和靶點篩選
利用TCMSP 數據庫對中藥成分進行初步篩選后,可分別得到甘草瀉心湯中7 味中藥的有效活性成分(半夏13 種、黃連14 種、黃芩36 種、干姜5種、甘草92 種、人參22 種、大棗29 種),以及有效活性成分對應的相關靶點(半夏93 個、黃連176 個、黃芩113 個、干姜41 個、甘草215 個、人參107 個、大棗194 個)。將7 味中藥中無對應蛋白質靶點的有效活性成分剔除后合并,再刪除重復成分后得到甘草瀉心湯的有效活性成分共164 種,涉及268 個有效成分靶點。篩選出度值排名前20 位的成分見表1。
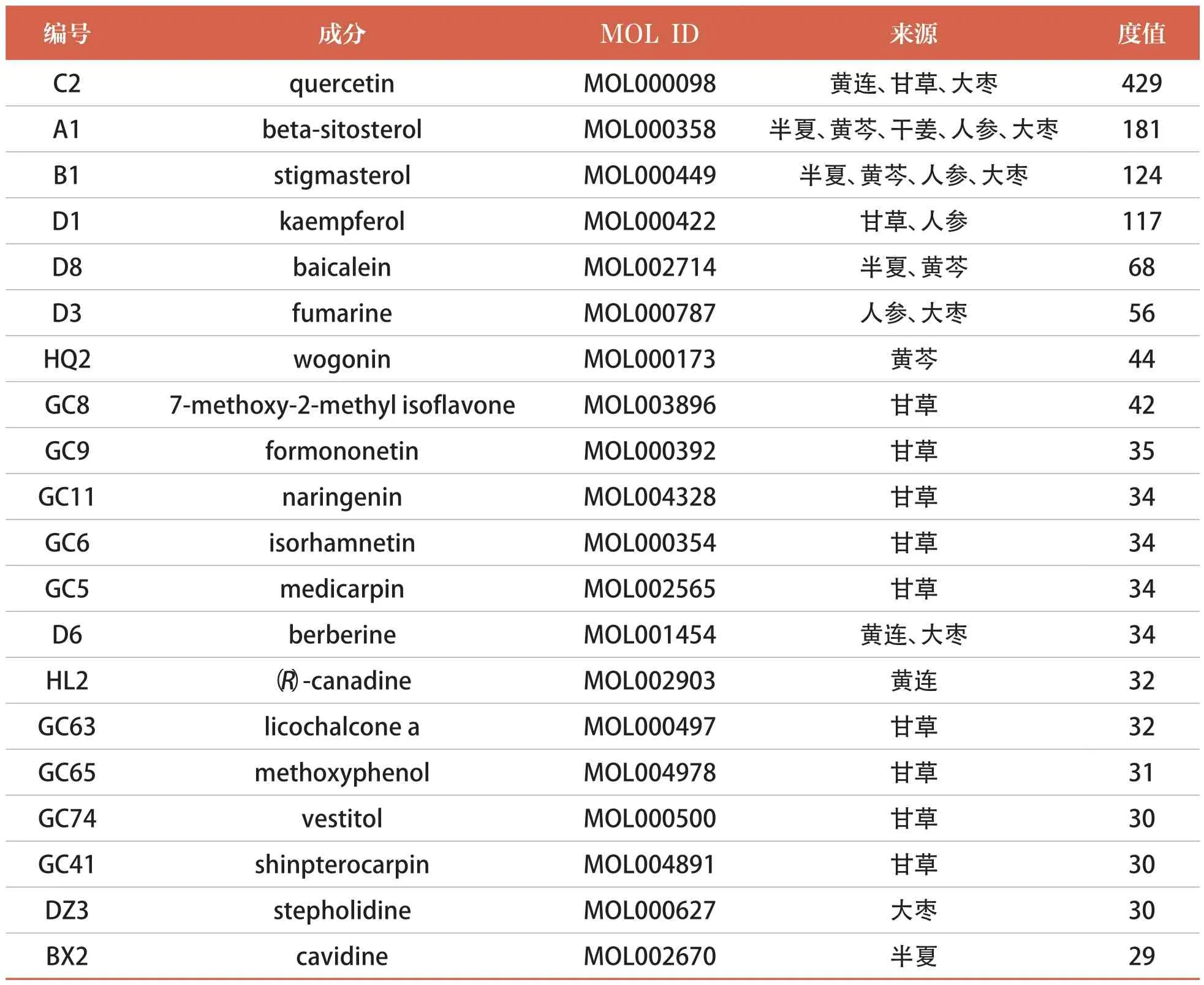
表1 甘草瀉心湯的部分有效活性成分(度值排名前20 位)
2.2 “中藥-活性成分-相關靶點”網絡構建
利用 Cytoscape 3.8.0 軟件繪制“中藥-活性成分-相關靶點”網絡圖(圖1),網絡由439 個節點構成,包括3450 條邊。經Analyze Network 分析,甘草的度值最高,為88;度值排名前4 位的關鍵活性成分為C2(槲皮素)、A1(β-谷甾醇)、B1(豆甾醇)、D1(山柰酚),其度值依次為429、181、124、117。

GC:甘草;HQ:黃芩;DZ:大棗;RS:人參;BX:半夏;HL:黃連;GJ:干姜。紫色:中藥;黃色:活性成分;粉色:關鍵活性成分;藍色:相關靶點;圖形大小與度值相關,度值越大,圖形越大圖1 甘草瀉心湯治療ROU 的“中藥-活性成分-相關靶點”網絡圖
2.3 PPI 網絡構建
將有效活性成分相關靶點和疾病相關靶點合并去重后共得到43 個交集靶點,導入STRING 數據庫中,進行蛋白質相互作用分析,通過Cytoscape3.7.1 軟件對結果進行可視化,構建PPI 網絡(圖2),該網絡圖包括43 個節點,606 條邊。根據拓撲學分析得到的參數進行篩選,共得到10 個核心靶點,分 別 為IL-6、TNF、IL-1β、ALB、CCL2、IL-10、VEGFA、MMP9、VCAM1、ICAM1。 核 心靶點的拓撲學參數見表2。

圖2 甘草瀉心湯治療ROU 的PPI 網絡圖

表2 甘草瀉心湯治療ROU 的核心靶點的拓撲學參數
2.4 GO 功能和KEGG 通路富集分析
將有效活性成分和疾病相關靶點取交集后得到的43 個交集靶點,導入微生信平臺進行GO 功能和KEGG 通路富集分析。共得到3078 個GO 富集條目,其中包括生物過程(biological process,BP)2740 個,主要涉及對脂多糖的反應(response to lipopolysaccharide)、對細菌來源分子的反應(response to molecule of bacterial origin) 等;細胞組成(cellular component,CC)124 個,涉及膜筏(membrane raft)、膜微區(membrane microdomain)、膜區(membrane region)等;分子功能(molecular function,MF) 214 個,涉及細胞因子受體結合(cytokine receptor binding)、細胞因子活性(cytokine activity)、受體配體活性(receptor ligand activity) 等。 以P≤0.01 為條件進行篩選并按照P值由小到大進行排列,選取排名前10 的條目進行可視化處理(圖3~5)。KEGG信號通路富集共獲得174 條通路,以P≤0.01 為條件進行篩選并按照P值由小到大進行排列,選取排名前10 的條目進行可視化處理(圖6)。通路主要涉及糖尿病并發癥中的AGE-RAGE 信號通路(AGE-RAGE signaling pathway in diabetic complications)、細胞流體剪切應力與動脈粥樣硬化(fluid shear stress and atherosclerosis)、TNF信號通路(TNF signaling pathway)、IL-17 信號通路(IL-17 signaling pathway)等信號通路。
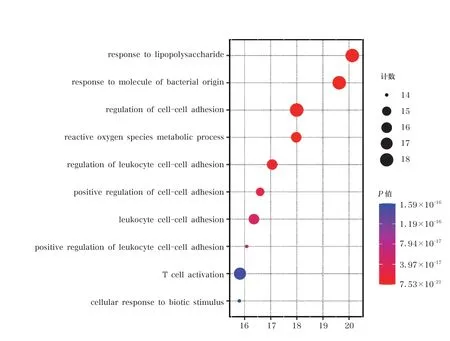
圖3 甘草瀉心湯治療ROU 的GO 富集分析結果(生物過程)
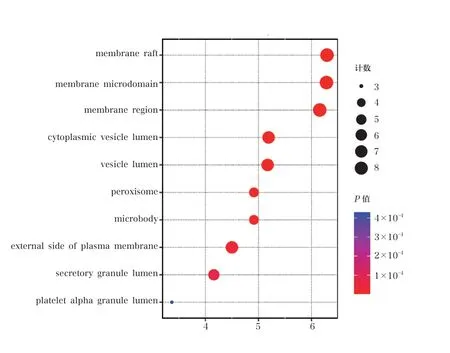
圖4 甘草瀉心湯治療ROU 的GO 富集分析結果(細胞成分)

圖5 甘草瀉心湯治療ROU 的GO 富集分析結果(分子功能)
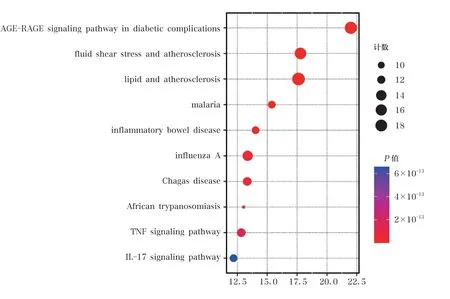
圖6 甘草瀉心湯治療ROU 的KEGG 富集分析結果
2.5 分子對接
篩選得到的關鍵活性成分為槲皮素、β-谷甾醇、山柰酚、豆甾醇;PPI 網絡度值前4 的核心靶點是IL-6、TNF、IL-1β、ALB。 利用AutoDock 1.5.6 軟件對篩選出的關鍵活性成分和核心靶點進行分子對接模擬計算,關鍵活性成分與核心靶點對接結果見表3。該結果表明,甘草瀉心湯中關鍵活性成分與核心靶點的結合能均≤-5.0kJ/mol,提示關鍵活性成分與核心靶點均具有良好的結合活性。采用PyMol 軟件對分子對接結果進行可視化,部分關鍵活性成分與核心靶點的分子對接結果見圖7。

表3 關鍵活性成分與核心靶點對接結果 kJ/mol
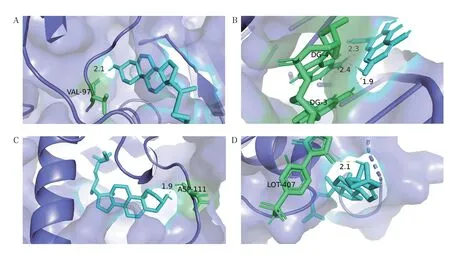
A:IL-6 與山柰酚;B:ALB 與豆甾醇;C:IL-1β與豆甾醇;D:TNF 與β-谷甾醇圖7 部分關鍵活性成分與核心靶點的分子對接示意圖
3 討論
ROU 發病的原因很復雜[2,12]。口腔黏膜因各種原因受到損傷后,由細胞免疫介導的免疫細胞和細胞因子級聯反應可進一步導致損傷部位的黏膜損傷、炎癥細胞的聚集、壞死組織的吞噬以及受損黏膜中不同大小潰瘍的形成。患者發病時常伴有腫瘤壞死因子(tumor necrosis factor,TNF) 、白介素-6(interleukin-6,IL-6)、IL-8、IL-10 等 炎 癥 因子的異常表達,產生的炎癥反應貫穿ROU 整個病理生理進程[13],并進一步加重黏膜損傷,影響潰瘍病灶愈合,使病情惡化。ROU 的發病率較高,在免疫功能紊亂的人群中,其發病率會進一步升高。
中醫學對ROU 的病因認識較為清楚,臨床以寒熱錯雜型的病癥最為多見,這也是該病反復發作的原因之一[14]。甘草瀉心湯由7 味中藥組成,方中黃芩、黃連苦降以除熱;干姜、半夏辛溫開結以散寒;人參、甘草、大棗益氣補虛兼生津液,防苦寒傷陽,又防辛熱傷陰。諸藥合用,則辛開苦降,寒熱平調,標本兼治[15]。臨床研究發現,ROU 患者潰瘍發作期CD3+T 淋巴細胞和 CD4+T 淋巴細胞明顯減少,患者細胞免疫水平明顯低于正常范圍[16];而經甘草瀉心湯治療后的患者,CD3+、CD4+、CD4+/ CD8+升高,CD8+顯著降低,提示甘草瀉心湯可以有效提高ROU 患者免疫功能[17-18]。
本研究借助網絡藥理學的研究方法,對甘草瀉心湯治療ROU 的潛在作用機制進行深入分析。根據“中藥-活性成分-相關靶點”網絡分析得到了4 個關鍵活性成分,分別是β-谷甾醇、豆甾醇、槲皮素、山柰酚。其中,槲皮素能夠極顯著地抑制脂多糖(lipopolysaccharide,LPS)誘導RAW264.7 細胞分泌炎癥介質NO 以及促炎性細胞因子TNF-α、IL-1β、IL-6,提示槲皮素有理想的體外抗炎效果[19];山柰酚能夠顯著抑制LPS 誘導的人單核細胞THP-1 中巨噬細胞產生的趨化因子(macrophage-derived chemokine, MDC),干擾素γ誘導蛋白10(interferonγinducible protein-10,IP-10)以及IL-8 等炎癥因子的產生,從而有效抑制炎癥進展[20];Pandith 等[21]研究發現,飛機草(Chromolaena odorata)提取物中的豆甾醇能明顯減少由脂多糖LPS 誘導增多的致炎因子環氧合酶-2(cyclooxygenase 2,COX-2)和誘生型一氧化氮合酶(inducible nitric oxide synthase,iNOS) 的表達,同時抑制前列腺素E2(prostaglandin E2,PGE2)和NO 的釋放,從而發揮其抗炎作用。在ROU 的發生過程中,T 細胞介導的細胞因子水平有所變化,如IL-1、IL-2、IL-6 等促炎因子分泌會增加,而抗炎因子IL-10 分泌會減少。應用β-谷甾醇治療時,大多數促炎細胞因子和單核細胞趨化蛋 白-1(monocyte chemoattractant protein-1,MCP-1)的表達水平都有所下降,而抗炎因子IL-10 的表達上調[22]。
對PPI 網絡圖進行分析,IL-6、IL-1β、ALB、TNF、CCL2、VEGFA、NOS3 等為核心靶點。其中,IL-1β為致炎因子之一,能刺激IL-2、IL-6、IL-8 等其他細胞因子的產生并相互影響。IL-6 是促進B 淋巴細胞、T 淋巴細胞活化,參與免疫應答以及炎癥反應的關鍵成分[23]。ROU 患者TNF-α水平升高可刺激IL-2、IL-6 等細胞因子功能及數量的改變,從而破壞細胞因子網絡平衡,并引起IL-2、IL-6 等促炎因子的釋放及抑制IL-10 釋放,從而加重炎癥反應,使潰瘍加重[24]。CCL2 能夠誘導小膠質細胞產生TNF-α,進而促進T 淋巴細胞產生炎癥因子,促進炎癥進程[25]。
對甘草瀉心湯治療ROU 的關鍵靶點進行GO功能分析,包括BP、MF 和CC[26]。甘草瀉心湯治療ROU 涉及BP 主要為對LPS 的反應、對細菌來源分子的反應、細胞間黏附的調節、活性氧代謝過程、白細胞黏附的調節、細胞間黏附的正向調節、白細胞-細胞黏附、白細胞-細胞黏附的正向調節、T 細胞活化、細胞對生物刺激的反應等,其中富集最多的是對LPS 的反應。就MF 而言,主要涉及細胞因子受體結合、細胞因子活性、受體配體活性、信號受體激活劑活性、生長因子受體結合、腫瘤壞死因子受體結合、腫瘤壞死因子超家族受體結合、趨化因子受體結合、生長因子結合、NADP 結合等過程。在CC 方面,目標主要富集在膜筏、膜微區、膜區、細胞質泡腔、囊泡腔、過氧化物酶體、微體、質膜外側、分泌顆粒腔、血小板α 顆粒腔等。這些結果表明甘草瀉心湯可通過調節多種復雜的生物過程來治療ROU。
KEGG 通路分析結果表明,甘草瀉心湯可能通過調控糖尿病并發癥中的AGE-RAGE 信號通路、流體剪切應力與動脈粥樣硬化、脂質與動脈粥樣硬化、瘧疾、炎癥性腸病、甲型流感、美洲錐蟲病、非洲錐蟲病、TNF 信號通路、IL-17 信號通路等信號通路,從而治療ROU。研究表明,當機體處于炎癥、創傷、糖尿病等狀態時,晚期糖基化終產物(advanced glycation endproducts,AGEs)升高,上調晚期糖基化終產物受體(receptor of advanced glycation endproducts,RAGE)的表達[27]。AGEs/RAGE/NF-κB 信號通路被激活,NF-κB 活化并核移,導致血清IL-1β、TNF-α等炎癥介質水平升高,引起組織損傷[28]。基質金屬蛋白酶9(matrix metalloproteinase-9,MMP9)等基因在振蕩剪切應力下表達明顯升高,表現為促進抗As基因、抗凝血基因的活化,從而發揮抗炎、抗氧化、抗凋亡、抗凝效應[29]。IL-17 與炎癥的發生和發展有密切的關系,其通過刺激靶細胞釋放前炎癥細胞因子以及動員中性粒細胞的細胞因子來發揮作用,在誘導IL-6、NO、PGE2 產生的同時上調IL-1β、TNF-α等炎癥因子水平,使局部炎癥擴大[30]。
此外,分子對接結果顯示,關鍵活性成分和核心靶點對接的結合能均低于-5.0kJ/mol,表明核心靶點與甘草瀉心湯關鍵活性成分之間具有很強的結合能力。
綜上所述,甘草瀉心湯中的多種活性成分可協同發揮抗炎作用,減少由LPS 誘導增多的炎性因子和趨化因子的產生,并通過作用于TNF、IL-1β、IL-6、CCL2、NOS3 等關鍵靶點以及參與AGERAGE、NF-κB、IL-17 等信號通路發揮抗炎作用、改善免疫功能。本研究采用網絡藥理學和分子對接方法,對甘草瀉心湯治療ROU 的成分和靶點進行了分析,闡述了其主要的生物過程和信號通路,為臨床和進一步研究甘草瀉心湯通過多成分、多靶點、多途徑治療ROU 提供了科學依據。

