基于16S rRNA測序分析高低飼料轉化率豬糞便微生物的組成差異
張 帥,陳奎蓉,許 迪,江 山,王夢影,張 坤,徐玉培,雷國鳳,張志程,郭 猛,趙云翔,*,蘭干球*,梁 晶*
(1.廣西大學動物科學技術學院 廣西畜禽繁育與疾病防控重點實驗室,南寧 530004;2.廣西揚翔股份有限公司,貴港 537100)
畜牧業是國家發展的重要基石,在西方發達國家農業經濟中,畜牧業發展占總體70%左右。豬是人類最早馴化的家養動物,同時也是肉類產品的主要來源[1]。截止到2019年,全球豬肉消費量達到新高,占總肉類消費的33%,據推測,到2060年,全球人口將急劇增長,這也意味著人類對豬肉需求量會更高。如何快速提高豬肉生產,滿足人類需求已經成為全世界亟待解決的問題[2]。
在整個養豬過程當中,飼料成本約占養豬成本的60%,豬的飼料利用效率在很大程度上影響著養殖生產和總體經濟效益[3],因此提高飼料轉化率是目前豬育種工作的一項重要任務。目前,衡量飼料利用效率的指標有兩個:剩余采食量(residual feedintake,RFI)和飼料轉化率(feed conversion rate,FCR)[4],RFI是實際采食量與預期采食量之間的差值[5];FCR在豬飼養中統稱為“料肉比”,即平均日采食量與平均日增重的比值(ADFI/ADG)[6]。隨著自動喂料系統的發展,豬飼料轉化率記錄更加準確,使得豬育種工作更加方便快捷[7]。
飼料轉化率受多個因素影響。研究表明,豬飼料轉化率受到腸道微生物活性和組成的影響[8],特別是腸道微生物能夠利用宿主不能消化的碳水化合物。例如纖維素和抗性多糖,其先被微生物降解為單糖或二聚糖,再經過發酵形成短鏈脂肪酸(SCFAs)[9],這些代謝產物能被宿主吸收,并提供能量[10]。基于16S rRNA發現梭狀桿菌(Cloacibacillus)、幽門螺桿菌(Helicobacter)和振蕩桿菌(Oscillibacter)在低FCR的雞中更為豐富[11],Tan等[12]研究發現,高FCR豬的普雷沃氏菌CAG:604在盲腸顯著富集;McCormack等[13]研究發現,低RFI豬腸道微生物某些特定菌增加與健康和飼料效率有關。尋找到更多的與FCR相關的腸道微生物有助于揭示微生物功能與宿主的生理和代謝之間的關系,使得FCR表征更加全面。
目前仍然不清楚,腸道微生物如何影響豬飼料轉化率。本研究通過微生物16S rRNA基因測序技術,對高、低飼料轉化率豬糞便微生物的組成結構差異進行對比分析,旨在探究豬糞便中的微生物與豬飼料轉化率之間可能存在的關聯。這些微生物可能作為一種生物標記物,為在育種中應用微生物標記提高豬飼料轉化率的實踐提供一定的理論基礎。
1 材料與方法
1.1 動物和試驗設計
本研究中使用的豬均來自廣西揚翔股份有限公司。選擇健康狀況良好、斷奶批次相同、體重接近(23~27 kg)的三元雜交母豬384頭,于斷奶后轉至同一棟大型豬舍中飼養,每欄飼養12~15頭,飼喂不含抗生素或藥物的標準玉米-豆粕型飼料,自由采食和飲水。利用自動喂料系統(HAMOER Technology Co.;Ltd., Tianjin)在豬進食時識別其電子耳標并測定豬的采食量和體重,計算90~165日齡期間的FCR值。將試驗豬的FCR值從高到低進行排序,選擇FCR極端高、低個體各10頭,分別定義為HFCR組和LFCR組。為減少環境因素對腸道微生物測序結果的影響,試驗豬達到170日齡時在測定欄位采集糞便,時間限定在上午8:00—10:30之間。為防止采樣時豬產生應激情況,使用一次性PE手套接取肛門內的糞便樣品,清理表面后置于凍存管內并放入液氮中保存,后轉入實驗室-80 ℃冰箱長期保存用于后續分析。
1.2 糞便微生物分析
1.2.1 微生物總DNA提取和PCR反應 使用QIAamp Fast DNA糞便提取試劑盒(51604;Qiagen,德國)從每頭豬糞便樣本中分離并收集總細菌DNA。提取完成后,用Qubit檢測DNA濃度,用1%瓊脂糖凝膠電泳檢測抽提DNA的完整度。利用帶有barcode的特異引物341F(5′-CCTACGGG-NGGCWGCAG-3′)和806R(5′-GGACTACHVGG-GTWTCTAAT-3′)進行PCR擴增得到16S V3-V4擴增子區域。PCR條件為:95 ℃預變性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 15 s,從第二步開始25個循環;72 ℃延伸5 min,4 ℃保存。PCR擴增完成后,用磁珠對產物進行純化,用Qubit檢測產物濃度, 并用1.5%瓊脂糖凝膠電泳檢測PCR產物大小是否與預期相符,PCR產物目的條帶大小正確,濃度≥2 ng·μL-1,可進行后續試驗。
1.2.2 文庫構建和數據預處理 對上述PCR產物進行混樣建庫,加上測序接頭,進行PCR擴增后用磁珠分選去掉引物二聚體等小片段,并記錄文庫index信息。反應條件:98 ℃預變性45 s;98 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,8個循環;72 ℃延伸10 min,4 ℃保存。使用Qubit對文庫濃度進行定量并計算濃度,文庫濃度≥4 nmol·L-1,可正常上機。文庫檢測合格后,按照有效濃度要求將不同文庫 pooling后上機測序,擴增子測序平臺為Illumina Miseq(MiSeq;Illumina Inc.,美國),測序策略為PE250。測序數據Q30(%)>85%滿足下機要求,下機數據根據雙端barcode拆分數據,并切除barcode信息,切除雙端引物后的測序序列進行擴增子流程分析。
1.2.3 擴增子流程分析 擴增子生物信息學采用EasyAmplicon v 1.0進行分析[14]。原始的Illumina fastq文件經過質控(錯誤率小于1%)后,使用VSEARCH去冗余設置參數為min_unique_size 為59,采用Usearch對AVSs進行100%相似度比較,然后去掉其中的質體和非細菌,設置參數為:sintax_cutoff 0.1。用Vegan包過濾低豐度ASVs后將所有樣本以最小序列條數抽平獲得ASVs豐度表。根據SILVA數據庫(https://www.arb-silva.de/)進行物種注釋,物種注釋結果用于擴增子分析[15]。
α多樣性指數計算采用Vegan包,使用抽平后的數據得出Richness、Chao1、ACE、Shannon、Simpson和Invsimpson指數。基于bray_curtis距離繪制主坐標分析(PCoA)圖。用柱狀圖展示top 5門水平高豐度菌、top 11科水平高豐度菌。使用LEfSe(Linear discriminant analysis Effect Size,線性判別分析)分析篩選LDA>3的屬作為兩組差異菌屬進行討論。使用PICRUSt對兩組糞便微生物菌群功能進行預測[16],STAMP軟件展示兩組微生物功能有何差異。
1.3 統計分析
采用SPSS(version 26.0; SPSS Inc., USA)分析20頭豬表型差異,結果均用“平均數±標準差(mean±SD)”方式表示。采用T-test檢驗計算P值,P<0.05表示差異顯著,P<0.01表示差異極顯著。使用SPSS軟件中的Spearman相關檢驗計算表型與差異菌群之間相關性。
2 結 果
2.1 高、低飼料轉化率豬表型差異
高、低飼料轉化率豬生長性狀見表1。與HFCR組相比,LFCR組的ADG顯著提高(P<0.01),而ADFI和FCR都顯著低于HFCR組(P<0.01)。

表1 高、低飼料轉化率豬的生長性能Table 1 Growth performance of pigs with high and low feed conversion rates
2.2 高、低飼料轉化率豬糞便微生物α多樣性分析
α多樣性主要用于表示物種豐富度和均勻度的指標,結果表明(表2),LFCR組的Richness、Chao1和ACE指數都顯著高于HFCR組(P<0.01)。而LFCR組的Shannon指數高于HFCR組,但沒有達到顯著性差異。

表2 高、低飼料轉化率豬的糞便微生物α多樣性指數Table 2 Feces microbial α-diversity index of pig with high and low feed conversion rates
2.3 高、低飼料轉化率豬糞便微生物β多樣性分析
基于Bray_Curtis距離計算出高低飼料轉化率豬糞便微生物的結構相似性情況。PCo1的解釋率為28.48%,PCo2的解釋率為18.38%,高、低飼料轉化率豬糞便微生物分布呈現左右分離狀態,且解釋率之和大于40%,表明高低飼料轉化率分組間糞便微生物的整體組成結構差異較大(圖1)。
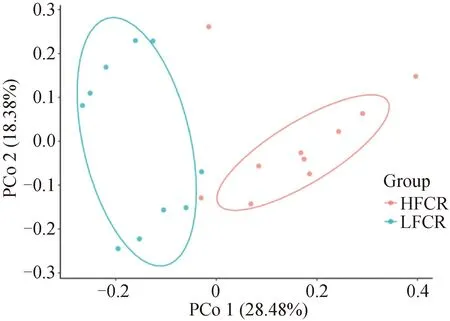
圖1 高、低飼料轉化率豬的糞便微生物β多樣性分析Fig.1 Feces microbial β diversity analysis of pig with high and low feed conversion rates
2.4 高、低飼料轉化率豬糞便微生物物種組成分析
物種堆疊圖主要用于展示不同組之間物種組成的差異。在門水平上(圖2)平均相對豐度排名前5的分別是:厚壁菌門(Firmicutes),各組相對豐度為:LFCR=45.36%,HFCR=60.65%;擬桿菌門(Bacteroideta),各組相對豐度為:LFCR=30.09%,HFCR=20.34%;廣古菌門(Euryarchaeota),各組相對豐度:LFCR=10.55%,HFCR=9.31%;螺旋體菌門(Spirochaetae),各組相對豐度為:LFCR=5.38%,HFCR=2.80%;放線菌門(Actinobacteria),各組相對豐度為:LFCR=1.86%,HFCR=2.49%。
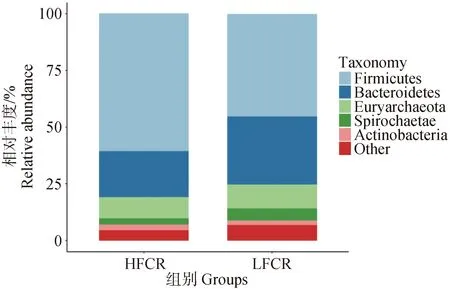
圖2 高、低飼料轉化率豬糞便微生物的門水平物種組成Fig.2 Phylum level species composition of microorganisms in feces of pigs with high and low feed conversion rates
在科水平上(圖3),平均相對豐度前11的菌群主要為以下幾種,瘤胃球菌科(Ruminococcaceae),各組相對豐度為:LFCR=14.96%,HFCR=12.67%。擬桿菌_S24-7(Bacteroidales_S24-7),各組相對豐度為:LFCR=11.91%,HFCR=12.64%。鏈球菌科(Streptococcaceae),各組相對豐度:LFCR=7.32%,HFCR=13.21%。甲烷桿菌科(Methanobacteriaceae),各組相對豐度:LFCR=10.54%,HFCR=9.31%。毛螺菌科(Lachnospiraceae),各組相對豐度:LFCR=7.74%,HFCR=11.38%。普氏菌科(Prevotellaceae),各組相對豐度:LFCR=13.88%,HFCR=4.22%。乳酸桿菌科(Lactobacillaceae),各組相對豐度:LFCR=5.16%,HFCR=8.12%。螺旋體科(Spirochaetaceae),各組相對豐度:LFCR=5.38%,HFCR=2.80%。丹毒絲菌科(Erysipelotrichaceae),各組相對豐度:LFCR=1.86%,HFCR=5.26%。氨基酸球菌科(Acidaminococcaceae),各組相對豐度:LFCR=2.82%,HFCR=3.33%。理研菌科(Rikenellaceae),各組相對豐度:LFCR=2.40%,HFCR=2.28%。
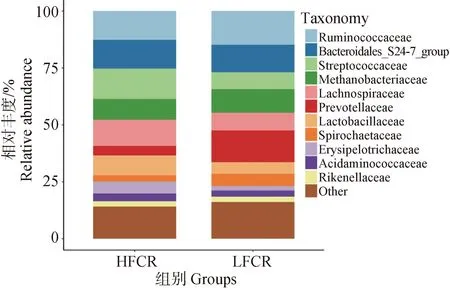
圖3 高、低飼料轉化率豬糞便微生物的科水平物種組成Fig.3 Family level species composition of microorganisms in feces of pigs with high and low feed conversion rates
2.5 LEfSe分析篩選高、低飼料轉化率豬糞便微生物屬水平差異
LEfSe分析主要可以對兩組或多組進行比較,從而找出組間在豐度上具有顯著差異的物種。在屬水平上,篩選平均相對豐度大于0.5%的屬進行LEfSe分析,結果如圖所示(圖4)。在LFCR組LDA值大于3的屬有:Prevotella_1、Treponema_2、Prevotellaceae_NK3B31_group、Eubacterium_coprostanoligenes_group、p-1088-a5_gut_group、Prevotella_9、阿克曼菌屬、Prevotellaceae_UCG_003、Ruminococcaceae_UCG-014、Ruminococcaceae_NK4A214_group。在HFCR組LDA值大于3的屬有:巨球藻屬、小類桿菌屬、鏈型桿菌屬、假丁酸弧菌屬、柯林斯氏菌、Solobacterium、罕見小球菌屬、鏈球菌屬。
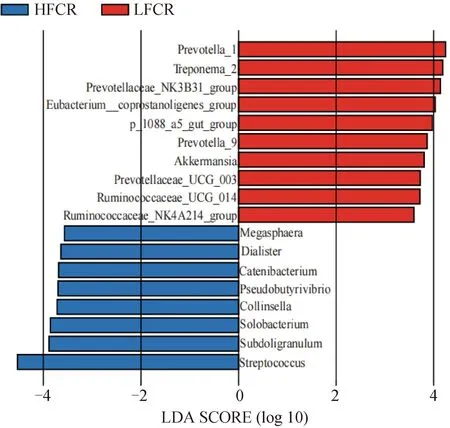
圖4 利用LEfSe分析篩選高、低飼料轉化率豬糞便中的差異微生物屬Fig.4 Using LEfSe analysis to screen differential microbial genera in feces of pigs with high and low feed conversion rates
2.6 PICRUSt預測高、低飼料轉化率豬糞便微生物功能差異
PICRUSt可以用于細菌功能預測。在LFCR組的鐵載體組非核糖體肽的生物合成、氮素代謝、脂質生物合成蛋白、轉錄機制、PPAR信號通路、蛋白質消化吸收、鞭毛組裝、細菌運動蛋白、乙苯基降解、苯丙氨酸代謝、萜、哌啶和吡啶生物堿的生物合成、葉酸合成、霍亂弧菌致病周期、維生素B6代謝、谷氨酸能突觸、脂多糖生物合成蛋白、脂多糖生物合成和葉綠醇降解17個功能較強。而HFCR組的硫胺素代謝、磷酸轉移酶系統、糖酵解/異生、原發性免疫缺陷4個功能較強(圖5)。
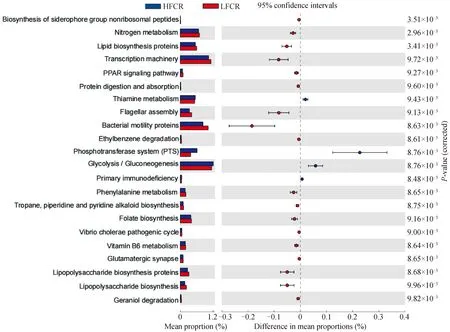
圖5 利用PICRUSt預測高、低飼料轉化率豬糞便微生物的功能差異Fig.5 Using PICRUSt to predict microbial functional differences in feces of pigs with high and low feed conversion rates
2.7 高、低飼料轉化率豬糞便微生物差異菌屬與生長性狀關聯分析
將兩組豬生長性狀和差異微生物進行Spearman相關性分析用于尋找影響飼料轉化率的微生物(圖6)。與FCR值呈顯著負相關的微生物有:Prevotella_1(r=-0.789,P<0.001)、Treponema_2(r=-0.548,P=0.012)、Prevotellaceae_NK3B31_group(r=-0.681,P<0.001)、Eubacterium_coprostanoligenes_group(r=-0.848,P<0.001)、p-1088-a5_gut_group(r=-0.54,P=0.014)、Prevotella_9(r=-0.503,P=0.024)、阿克曼菌屬(r=-0.561,P=0.015)、Prevotellaceae_UCG_003(r=0.685,P<0.001)、Ruminococcaceae_UCG-014(r=-0.55,P=0.012)、Ruminococcaceae_NK4A214_group(r=-0.59,P<0.01)。與FCR值呈顯著正相關的微生物有:巨球藻屬(r=0.52,P=0.019)、柯林斯氏菌(r=0.74,P<0.001)、Solobacterium(r=0.728,P<0.001)、罕見小球菌屬(r=0.5,P=0.025)、鏈球菌屬(r=0.628,P<0.01)。
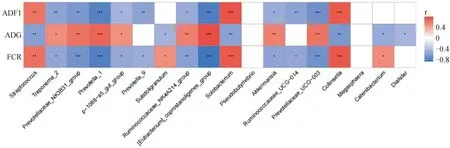
紅色代表正相關,藍色代表負相關。*代表P<0.05,**代表P<0.01,***代表P<0.001Red represents positive correlation,while blue represents negative correlation。* Represents P<0.05,** represents P<0.01, and*** represents P<0.001圖6 糞便微生物與生長表型的相關性分析Fig.6 Correlation analysis between fecal microorganisms and growth phenotype
3 討 論
LFCR組豬的日采食量較低而日增重較高,通俗講為“吃的少,長得快”的豬。這類豬不僅對飼料的需求少同時生長速率較快。因為這類豬有利于降低企業生產成本增加效率,故常在豬育種中被留種。探究影響豬飼料轉化率的潛在因素,是目前豬育種工作關注的重心。
3.1 糞便微生物多樣性與豬飼料轉化率的關系
微生物α多樣性指數用于反映微生物群落的豐富度和均勻性。有研究表明,微生物多樣性與豬生長性能存在聯系[17]。Tan等[18]研究表明,LFCR豬的腸道微生物α多樣性比HFCR豬更為豐富,這與本研究一致。Metzler-Zebeli等[19]發現,低RFI豬的盲腸微生物多樣性也高于高RFI豬。本研究中,LFCR組的Richness、Chao1和ACE指數顯著高于HFCR組。這表明LFCR組的糞便中存在更為多樣化的微生物群落和有益菌,可能促進了豬的健康狀態或提高了代謝水平,從而有助于提高飼料轉化率。
3.2 LEfSe分析揭示高、低飼料轉化率豬糞便微生物的組成及潛在功能差異
本研究通過LEfSe分析了高、低飼料轉化率豬糞便微生物組成差異。Eubacterium_coprostanogenes_group屬于真菌屬,有研究表明,其可以產生短鏈脂肪酸作為腸上皮中的特殊營養物質和能量成分,保護腸黏膜屏障,降低人體炎癥水平,增強胃腸動力[20]。Prevotella_1、Prevotella_9、Prevotelaceae_NK3B31_group和Prevotellaceae_UCG-003屬于普雷沃氏菌科,是豬腸中纖維降解菌的主要類型之一,參與果膠和蛋白質的代謝[21]。Prevotella_1可以降解半纖維素或木聚糖,為身體提供能量[22]。Prevotellaceae_UCG-003具有調節腸道功能的潛力,可降解纖維多糖產生短鏈脂肪酸[21]。然而,Xue等[23]發現,高RFI組綿羊瘤胃中Prevotella_1和Prevotellacea-UCG-003的相對豐度較高,這與本試驗結果相反。可能的原因是Prevotell_1在反芻動物和單胃動物中發揮作用不同所導致。Jiang等[24]發現Prevotelaceae_NK3B31_group在斷奶仔豬糞便中的豐度較高,并且與乙酸、丙酸和總SCFAs的濃度呈正相關,表明Prevotelaceae_NK3B31_group可以產生SCFAs。
Ruminococcaceae_UCG-014和Ruminococcaceae_NK4A214屬于瘤胃球菌科。瘤胃球菌科成員具有纖維素降解和半纖維素降解活性,可產生乙酸鹽、丁酸鹽、甲酸鹽和氫氣。在一項研究中發現,Ruminococcaceae_UCG-014在低RFI牛瘤胃中豐度較高,這與本研究結果相似[21]。有研究證實,Ruminococcaceae_UCG-014可以產生丁酸[25]。阿克曼菌屬已被確定為與體重增加相關的重要糞便生物標志物[26]。在絕經后婦女中,阿克曼菌屬與胰島素抵抗和血脂異常呈負相關[27]。肥胖個體的糞便中阿克曼菌屬顯著減少[28]。也有研究表明,阿克曼菌屬可以降解黏蛋白,也是短鏈脂肪酸的生產者[29]。這些真菌屬、普雷沃氏菌和瘤胃球菌在LFCR組糞便中大量存在,可能是它們可以產生大量短鏈脂肪酸為機體供給能量所以提高了豬的飼料轉化率。
在人類研究中發現,柯林斯氏菌與肥胖和動脈粥樣硬化有關[30]。同樣,在高膽固醇血癥患者的糞便中也發現了較多的柯林斯氏菌[31]。Lahti等[32]研究表明柯林斯氏菌和甘油三酯之間存在顯著的正相關性。Solobacterium屬于丹毒絲菌科,研究表明丹毒科在肥胖患者和炎癥性腸病患者中發揮著重要作用[33];另外一項研究揭示,Solobacterium是結直腸癌癌癥的標志性微生物群,在結直腸癌癌癥患者的糞便中具有更高的豐度。鏈球菌是豬的常見病原體,不僅被認為是人類的人畜共患病原體,也是抗生素耐藥性的主要宿主,可以將耐藥性基因傳遞給其他致病性鏈球菌物種[34]。研究指出,罕見小球菌屬與抑郁癥患病概率之間存在顯著的正相關[35]。這些菌在HFCR組顯著富集,提示HFCR組可能存在大量致病菌,這些致病菌破壞了機體健康所以造成了飼料轉化率低。假丁酸弧菌屬在大腸后部顯著富集,并與短鏈脂肪酸含量呈正相關[36]。在一項研究中,發現HFCR長白豬盲腸中的假丁酸弧菌屬和巨球藻屬顯著富集,因為它們可以代謝乳酸產生游離脂肪酸[37],令人感興趣的是,為什么這些產短鏈脂肪酸的細菌會在HFCR組顯著富集。
3.3 與豬飼料轉化率相關的糞便微生物及其在育種中的應用前景
Eubacterium_coprostanogenes_group、Prevotella_1、Prevotella_9、Prevotelaceae_NK3B31_group、普Prevotellaceae_UCG-003、Ruminococcaceae-UCG-014、Ruminococcaceae_NK4A214和阿克曼菌屬,這些菌都具有產短鏈脂肪酸的能力與FCR值呈顯著負相關,可能產生的短鏈脂肪酸供給機體所以LFCR飼料轉化率高。而柯林斯氏菌、Solobacterium、罕見小球菌屬和鏈球菌都與疾病發生有關且與FCR值呈顯著正相關,可能是因為這些致病菌在腸道大量存在,破壞了腸道內環境,損壞機體健康因此降低了飼料轉化率。有研究表明,腸道微生物和糞便微生物具有顯著差異[38],腸道菌群更能反映宿主的系統發生關系,而糞便微生物只能反映宿主的飲食代謝情況。腸道菌群能夠影響的不僅有營養物的消化吸收,還會影響大腦活動。腸道菌群失衡會破壞人體的諸多系統,還會導致肥胖、營養不良甚至癌癥[39]。因此,用糞便微生物與生長表型進行相關性分析,也只能說明兩者之間存在顯著相關性,不能直接說明其存在因果關系。本研究篩選到的糞便微生物如何調控飼料轉化率,仍需要進一步的試驗探究。而糞便微生物有望作為一種易于檢測的分子標志物,為動物育種時輔助篩選優良性狀個體提供一定參考。
4 結 論
本研究通過采集20頭高、低飼料轉化率的三元雜交母豬的糞便樣品,利用16S rRNA測序技術分析兩組間糞便微生物的組成與結構差異。結果顯示,低飼料轉化率組的糞便微生物α多樣性顯著高于高飼料轉化率組。進一步分析發現,低飼料轉化率組富集了大量產生短鏈脂肪酸的微生物,而這些微生物與飼料轉化率值呈顯著負相關。相反,高飼料轉化率組的糞便中富集了大量的致病菌,這些菌與飼料轉化率值呈顯著正相關。最終,本研究鑒定了一些與飼料轉化率相關的糞便微生物,這些微生物有望成為分子標記物,為促進豬育種進展、改善豬飼料轉化率提供一定的理論基礎。

