元江鯉3個連續選育世代的遺傳多樣性與遺傳結構變化
劉 娟,袁林聰,楊劍虹,孔令富,李偉斌,白壽有,李進榮,劉林江,尹馨玉,高 旭,王 婷,武祥偉
(1.云南農業大學動物科學技術學院,昆明 361021;2.玉溪市元江縣魚種技術推廣站,云南元江 653300;3.昆明水產科學研究所,昆明 650021)
鯉是鯉形目(Cypriniformes)鯉亞科(Cyprinidae)鯉屬(Cyprinus)魚類的總稱,具有環境適應性強、食性雜、生長快、肉質鮮美等優點,是亞洲、歐洲的重要淡水養殖品種,其養殖年產量曾占全球淡水養殖產量的14%[1]。我國不僅養殖鯉的歷史超過2 000年,而且我國鯉種質資源遠較其他國家豐富,地方種多達23種,且云南分布的鯉屬魚類多達12種,是寶貴的鯉種質資源基因庫[2-4]。元江鯉(Cyprinuscarpioyuankiang)主要分布于云南境內的紅河水系,其生長快、產量高、營養價值高,是云南鯉主養品種之一,已在云南多個地州進行池塘與稻田養殖。元江鯉與荷包紅鯉(C.carpiovar.wuyuanensis)雜交育成建鯉(C.carpiovar.jian)[5],成為全國養殖品種,為我國鯉養殖業的發展做出了重要貢獻。
鯉云南地方種生境范圍狹窄,對原生境依賴性高;而本世紀以來云南引種、外來養殖品種逃逸等使得外來種在云南自然水體中肆意繁殖,不僅擠占了地方種的生境,還與地方種雜交導致基因漸滲與基因污染。上世紀80~90年代,多個云南基層漁業推廣與科研單位對云南特色土著魚類進行了原種收集、人工繁殖、推廣養殖等,元江鯉即是其中一種[6]。但長期的人工保種,容易引起近親繁殖與種質退化等問題[7,8]。本實驗組前期以元江鯉保種群體為基礎群體,以體重為主要選育目標,同時兼顧體型,連續進行了3代群體選育,選育群體在生長速度、成活率等方面提升幅度達20%以上。為掌握元江鯉選育群體的遺傳結構變化趨勢,使后續育種策略制定和新品種的培育有科學依據,本研究首先使用元江鯉基因組重測序數據開發了15個多態性高的微衛星分子標記(SSR),以此為手段分析了元江鯉3個連續選育世代的遺傳多樣性水平與遺傳結構。
1 材料與方法
1.1 材料選擇與基因組DNA抽提
2018年從元江鯉保種群體中挑選體型標準、健康、體質量大于2 kg的個體約500尾建立選育基礎群體,從中再選擇生長快、體型標準的個體100尾繁育F1代。采用群體選擇法,以生長為主要選育指標兼顧體型,每一世代在5~6月齡與12~14月齡進行兩次分選,選擇生長快、體型好、健壯無病的個體作為后備親本加以強化培育,并人工繁育下一代。每世代總選擇率為10%,至2022年獲得了3個連續世代群體(F1、F2、F3)。每個群體在性成熟后隨機選取30尾個體,剪取鰭條保存于95%乙醇中,采用傳統的酚-氯仿-異戊醇法抽提基因組DNA[9],經核酸自動分析儀檢測后稀釋至50 ng/μL,4 ℃保存備用。
1.2 微衛星分子標記的開發
使用GMATA 2.0程序[10]從元江鯉基因組重測序數據中查找SSR位點并設計PCR引物。根據多態性與擴增效率隨機選取15個SSR位點用于基因型分析(表1)。
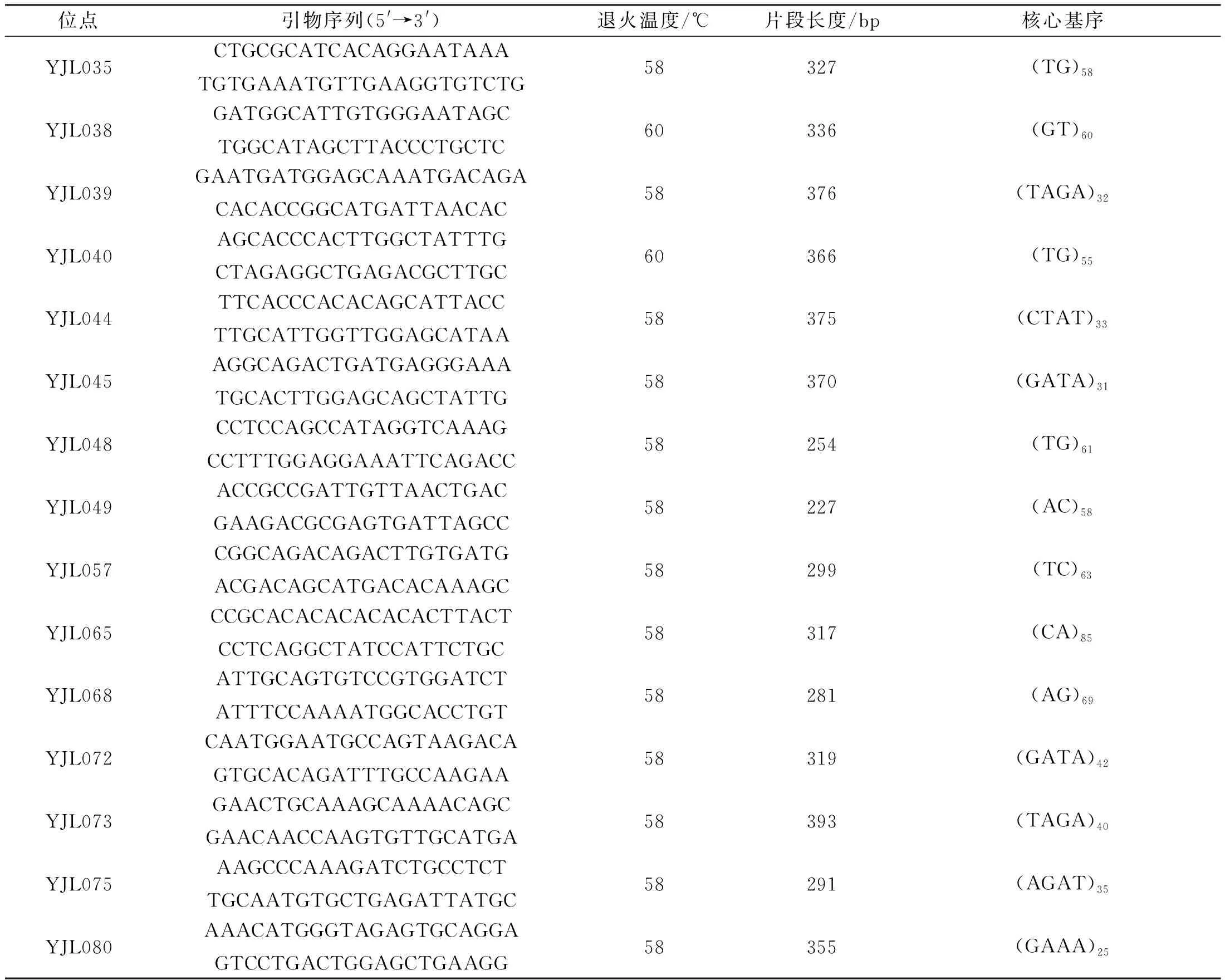
表1 元江鯉15個微衛星位點信息Tab.1 Information of 15 microsatellite loci of C.carpio yuankiang
1.3 PCR擴增與電泳
PCR反應體系為10 μL,其中PCR mix(Takara,大連寶生物工程有限公司)7.7 μL,上、下游引物各0.4 μL,模板DNA 1.5 μL。PCR反應程序為95 ℃預變性5 min,95 ℃變性30 s,58 ℃或60 ℃退火30 s,72 ℃延伸30 s,25個循環;最后72 ℃延伸10 min,4 ℃保存。
PCR產物采用6%非變性聚丙烯酰胺凝膠方法電泳,電泳膠板經固定、銀染、顯色[11],統計SSR等位基因條帶數。
1.4 數據分析
使用popgene32 v1.32軟件[12]分析3個群體的平均觀測等位基因數(Number of allele,Na)、平均有效等位基因數(Effective number of allele,Ne)、觀測雜合度(Observed heterozygosity,Ho)、期望雜合度(Expected heterozygosity,He)、多態信息含量(Polymorphism information content,PIC)。使用FSTAT v2.9軟件[13]計算Nei′s遺傳距離(D)、近交系數(Fis)、群體間的遺傳分化指數(Fst)和哈代溫伯格平衡(HardyWeinberg equilibrium,HWE)的χ2檢驗。根據Nei′s遺傳距離使用MEGA 10.1軟件包[14]構建3個世代的UPGMA聚類樹。使用SPSS18.0軟件進行生長數據分析,采用獨立樣本的t檢驗檢測選育群體與未選育群體間的生長差異;顯著水平均為P<0.05。
2 結果與分析
2.1 選育世代生長性狀及群體遺傳多樣性
采用群體選育和選擇強度1.734進行元江鯉選育,F1、F2與F3選育世代1齡個體平均體質量分別為(1 749.85±191.57)、(1 953.54±179.72)、(2 264.75±164.83) g,顯著高于未選育群體平均體質量(1 098.70±371.64) g,生長性狀的選育效果顯著。
15個SSR位點在3個連續選育世代群體共獲得116個等位基因,平均等位基因數為7.73個/位點。隨著選育世代的增加,群體的遺傳多樣性逐漸降低。F1、F2、F3群體的平均多態信息含量分別為0.763 4、0.756 8、0.745 1,觀測雜合度分別為0.768 0、0.822 1、0.758 5,期望雜合度分別為0.804 3、0.800 2、0.728 3(表2)。Hardy-Weinberg平衡的χ2檢驗顯示隨著選育世代的增加,偏離平衡的SSR位點數增多,F1、F2、F3群體極顯著偏離Hardy-Weinberg平衡的位點數分別為4、7、8個(表2)。
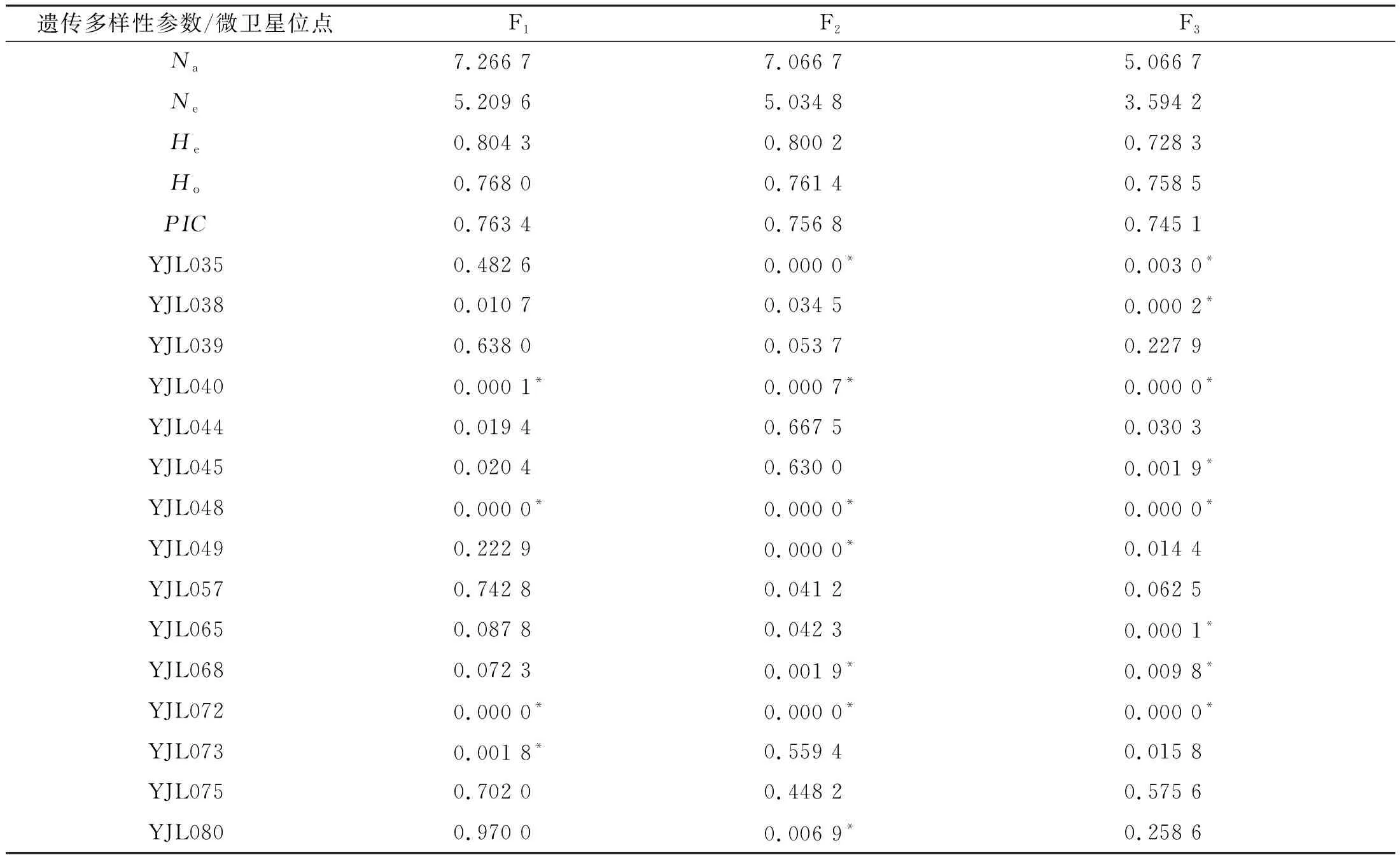
表2 元江鯉3個選育世代的遺傳多樣性及15個微衛星位點的Hardy-Weinberg平衡檢驗Tab.2 Genetic diversity and Hardy-Weinberg equilibrium test of fifteen microsatellite loci in three successive breeding generations of C.carpio yuankiang
2.2 SSR等位基因頻率變化
15個SSR位點在3個F1、F2、F3世代群體中檢測的等位基因頻率在0.0~0.7范圍內;相比于F1與F2代,F3代中、高頻率(0.4~0.7)等位基因的比例增加(圖1),包括YJL035、YJL040、YJL044、YJL045、YJL048、YJL065、YJL068、YJL072、YJL073、YJL075,表明人為選擇對群體產生了顯著影響。
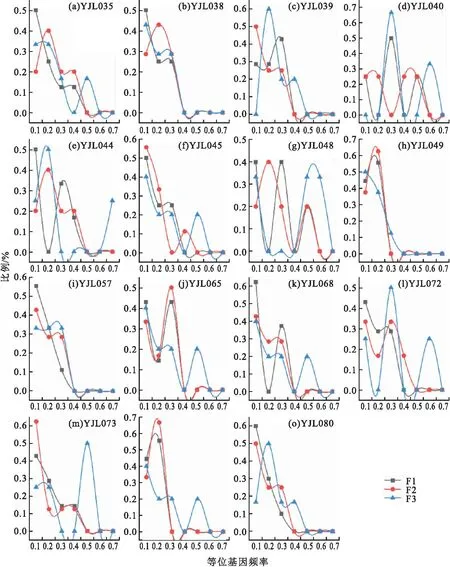
圖1 元江鯉3個連續選育世代的15個SSR位點等位基因頻率分布圖Fig.1 Distribution of allele frequency of 15 SSR loci in three successive breeding generations of C.carpio yuankiang
2.3 遺傳結構變化
F1與F2世代間Fst值為0.068 1,為中等分化(Fst<0.15),而F2與F3世代間Fst值為0.023 0,為弱分化水平(Fst<0.05),世代間遺傳分化逐代減小。3個群體的Fst均值為0.044 8(表3),群體間的平均遺傳分化較小,大部分遺傳變異來自群體內。3個群體的近交系數Fis平均值為-0.045 7,世代間雜合度小于個體間雜合度,遺傳變異程度減小。3個群體分別有6、10、9個SSR位點Fis值為負數(表4),群體在這些位點上雜合度過剩,說明上述位點受到了選擇壓力,等位基因喪失速度加快。
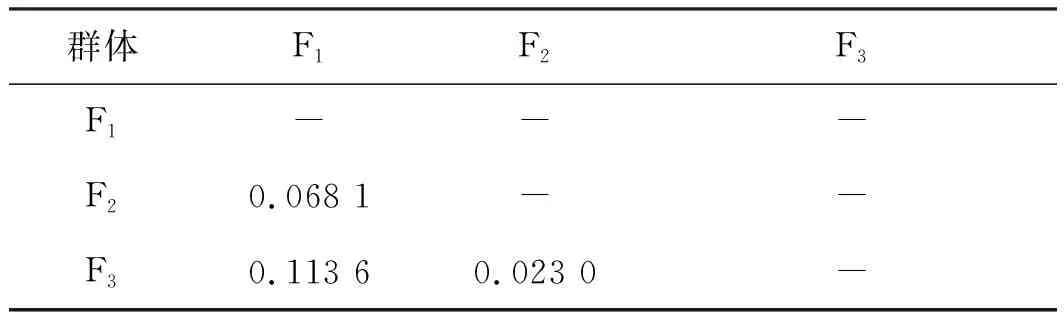
表3 元江鯉3個連續選育世代間分化系數FstTab.3 Differentiation coefficient Fst of three successive breeding generations of C.carpio yuankiang
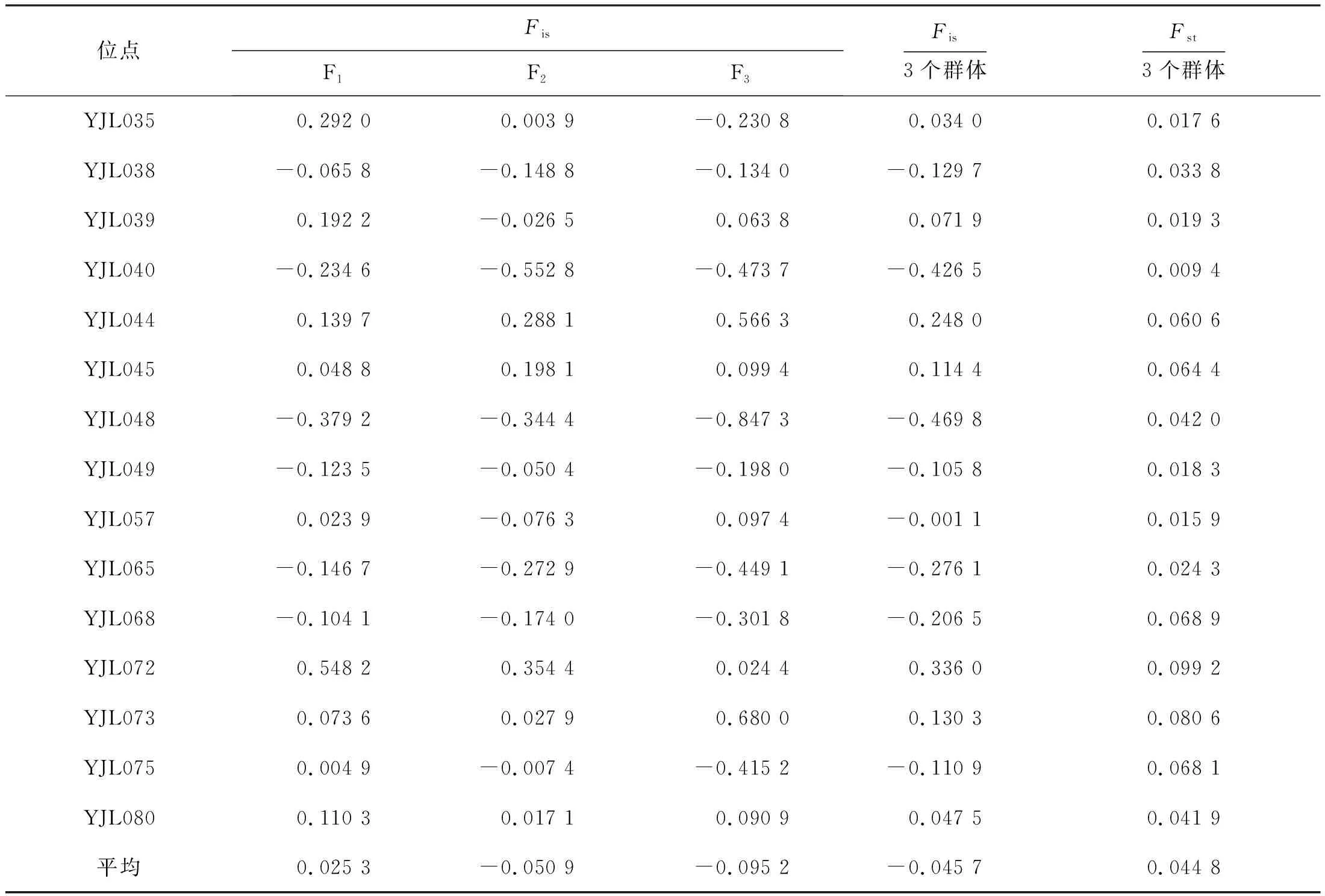
表4 元江鯉3個連續選育世代15個微衛星位點的F-分析Tab.4 F-statistics at 15 microsatellites for three successive breeding generations of C.carpio yuankiang
2.4 世代間的遺傳相似性
元江鯉3個選育世代間的遺傳距離為0.080 6~0.169 1,世代間的遺傳距離減小,相似性增加,其中F2與F3世代間的遺傳距離最小為0.044 9,相似性最大為0.874 7(表5)。3個群體的UPGMA聚類樹顯示,F2與F3群體先聚為一支,最后與F1群體聚一支(圖2),也表明世代間的遺傳相似性逐漸增加。
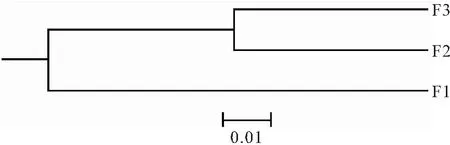
圖2 元江鯉3個連續選育世代基于Nei′s無偏遺傳距離的UPGMA聚類樹Fig.2 UPGMA dendrogram for three successive breeding generations of C.carpio yuankiang
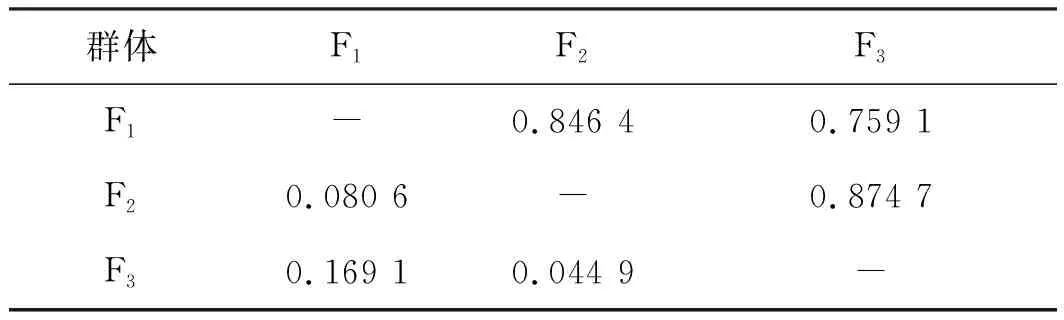
表5 元江鯉3個連續選育世代間的遺傳距離(對角線下方)和遺傳相似性Tab.5 Genetic distance(below diagonal) and genetic identity in three successive breeding generations of C.carpio yuankiang
3 討論
3.1 遺傳多樣性
生物的遺傳多樣性水平不僅決定環境適應性,還決定群體的選育潛力[15,16]。長期多代選擇后群體常面臨稀有等位基因丟失、有害等位基因表達、經濟性狀衰退等弊端,主要原因是群體遺傳多樣性降低。元江鯉連續三代選育后群體多態信息含量仍大于0.5,表明其仍具有較高水平的遺傳多樣性,該種情況與建鯉(C.carpiovar.jian)[17]、黃河鯉(C.carpiohaematopterus)[18]、黑龍江鯉(C.carpiohaematopterus)[19]、易捕鯉(C.carpiovar.yi)[20]、甌江彩鯉(C.carpiovar.color)[21]、華南鯉(C.carpiorubrofuscus)[22]等多個鯉魚選育群體的遺傳多樣性變化相似,元江鯉選育群體仍具有選育潛力。
觀測等位基因數和有效等位基因數反映群體遺傳變異的大小,兩者數值越接近表明群體中等位基因分布越均勻[23,24]。元江鯉連續3個選育世代的觀測等位基因數均大于有效等位基因數,表明等位基因分布不均,這是元江鯉經歷多代定向選擇造成的。等位基因分布變化的程度可用觀測雜合度衡量,反映群體遺傳一致性的高低[25]。元江鯉3個連續選育世代的觀測雜合度低于元江鯉野生群體的觀測雜合度(0.776 5~0.803 7)[26],與建鯉多個選育家系的觀測雜合度(0.725~0.883)[27]、華南鯉不同選育世代的觀測雜合度(0.713 5~0.794 3)相似[22],大于黃河鯉選育群體的觀測雜合度(0.665)[28]。另一方面,與F1代相比F3代觀測雜合度僅減少了1.25%,顯著低于華南鯉與易捕鯉經4代選育后觀測雜合度下降程度(11.23%與6.9%)[20,22],并且元江鯉選育群體的多態信息含量也僅微弱減小,均表明元江鯉選育群體選育潛力較大。
3.2 遺傳結構與遺傳相似度
元江鯉F1~F3世代中極顯著偏離Hardy-Weinberg平衡(P<0.01)的SSR位點數逐代增加,選育群體的基因頻率發生了顯著改變,低頻(0.0~0.1)等位基因比例減少,中、高頻(0.1~0.7)等位基因比例增加,預示元江鯉選育群體的遺傳結構發生了改變。此外,元江鯉兩兩世代間的遺傳分化系數Fst值逐漸減小,Fst平均值以及F2與F3代間的Fst值均小于0.05,并且小于華南鯉連續4代選育群體間的Fst值(0.081~0.051),表明元江鯉選育世代間的遺傳分化水平逐代降低,定向選擇顯著提高了群體的遺傳相似度[29]。
魚類育種目標之一是形成遺傳結構穩定的群體,如“吉富”品系尼羅羅非魚(Oreochromisniloticus)經9代選育后群體遺傳距離和遺傳相似性指數分別為0.058 1~0.077 5和0.925 4~0.943 5[30],華南鯉連續4代選育后群體遺傳距離為0.218 1~0.148 6,遺傳相似性為0.804 1~0.881 9[22],元江鯉也具有相似的選育結果,經過連續3代選育后群體遺傳距離逐漸減小、遺傳相似性逐漸增大,表明經過3代選育后元江鯉群體遺傳結構趨于穩定,選擇效果顯著。

