α-倒捻子素通過NF-κB途徑抑制LPS/ATP誘導的小膠質細胞中NLRP3炎癥小體的激活
陳 敏,陶 靜,朱慧艷
脊髓損傷是一種可致殘疾的嚴重外傷。研究表明在脊髓損傷發生后,損傷灶中的小膠質細胞被迅速激活,誘導炎癥的發生,并加劇神經功能障礙和損傷[1-3],而通過抑制小膠質細胞介導的神經炎癥的治療策略則有助于脊髓損傷的恢復。由NOD樣受體蛋白3(NOD-like receptor pyrin domain containing 3,NLRP3)介導的經典炎癥小體途徑可通過激活下游信號通路轉導,引起炎癥介質的表達和釋放,從而引起嚴重的炎癥反應[4-6]。有研究[5]報道,在脊髓損傷組織,NLRP3炎性小體的活化水平和其誘導的炎癥因子表達均異常升高。這提示NLRP3炎性小體可能參與脊髓損傷中小膠質細胞介導的炎癥反應[5]。α-倒捻子素(α-mangostin)是從山竹果皮和樹皮中提取的多酚類酮,研究顯示,α-mangostin可通過抑制NLRP3炎性小體的活化來治療多種炎癥性疾病[7-9]。然而,在脊髓損傷中,α-mangostin是否同樣能夠下調NLRP3炎性小體來介導小膠質細胞的炎癥反應尚不清楚。因此,該研究通過建立小膠質細胞體外炎癥模型來探討α-mangostin作用及相關機制。
1 材料與方法
1.1 細胞系和主要試劑小鼠小膠質細胞系BV-2購自武漢普諾賽生命科技有限公司。DMEM培養基、胎牛血清和青霉素鏈霉素混合液(美國Hyclone公司);α-mangostin(浙江博邁科生物醫藥研發有限公司);脂多糖(lipopolysaccharide, LPS)和三磷酸腺苷(adenosine triphosphate, ATP)(美國Sigma公司);檢測腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-1β(interleukin-1β,IL-1β)和IL-6和IL-18的ELISA試劑盒(杭州聯科生物技術股份有限公司);CCK-8細胞增殖實驗檢測試劑盒(北京索萊寶科技有限公司);兔抗NLRP3、凋亡相關斑點樣蛋白(apoptosis-associated speck-like protein, ASC)、抗裂解型caspase-1(cleaved caspase-3)、抗p65、抗磷酸化p65(phosphorylated p65, p-p65)、抗核p65(nuclear p65)、抗LaminB抗體(美國CST公司);兔抗GAPDH抗體、辣根過氧化物酶偶聯的山羊抗兔二抗(美國Abcam公司)。ECL試劑、NE-PERTM細胞核蛋白提取試劑盒(美國Thermo公司)。
1.2 細胞培養和處理采用含10%胎牛血清和1%青鏈霉素的DMEM培養基在37 ℃、5%CO2的培養箱中培養BV-2細胞。按處理方式的不同將BV-2細胞分為6組:正常培養的Ctrl組、LPS與ATP處理的LPS/ATP組、單獨40 μmol/L α-mangostin處理組(40 μmol/L α-mangostin組)和不同濃度(10、20、40 μmol/L)的α-mangostin干預組,分別記為LPS/ATP+10 μmol/L α-mangostin、LPS/ATP+20 μmol/L α-mangostin與LPS/ATP+40 μmol/L α-mangostin。BV-2細胞分組處理前,按5×104個/孔接種至96孔板中,37 ℃、5%CO2的培養箱中培養過夜后,加入不同濃度α-mangostin(10、20、40 μmol/L)處理4 h后,再參考文獻[10]方法依次采用1 μg/ml的LPS處理5.5 h和5 mmol/L的ATP處理0.5 h以建立BV-2細胞炎癥模型。
1.3 CCK-8法檢測細胞增殖活力取生長狀態良好的BV-2細胞,5×104個/孔接種至96孔板中,首先單獨采用不同濃度α-mangostin(10、20、40、80 μmol/L)處理細胞4 h后,每孔加入10 μl的CCK-8試劑繼續在細胞培養箱中孵育2 h,然后根據試劑盒說明書方法在微板測量儀上測量每孔在450 nm處的吸光度值。然后再根據1.2項中的方法對BV-2細胞進行分組處理后,按前述方法測量每組細胞在450 nm處的吸光度值。每組細胞的吸光度值為細胞的增殖活力。
1.4 ELISA實驗取各組BV-2細胞的培養上清液,4 ℃下2 240 r/min離心10 min后,去除底層沉淀,采用ELISA試劑盒并參考說明書方法測量上清液中的IL-6、IL-1β、IL-18和TNF-α含量。
1.5 Western blot實驗分別采用含有蛋白酶抑制劑混合物的RIPA裂解緩和NE-PERTM試劑盒提取各組BV-2細胞胞質和胞核中的蛋白質。BCA法測定蛋白濃度,取30 μg等量的蛋白樣品通過10%SDS-PAGE凝膠進行分離,濕轉法轉移至聚偏二氟乙烯膜上后,5%的脫脂奶粉進行封閉。加入稀釋后的一抗置于4 ℃下孵育過夜,一抗分別為:NLRP3(1 ∶500)、ASC(1 ∶1 000)、IL-1β(1 ∶500)、cleaved caspase-1(1 ∶800)、p65(1 ∶1 000)、p-p65(1 ∶1 000)、LaminB(1 ∶2 000)和GAPDH(1 ∶2 000)。次日加入辣根過氧化物酶偶聯的山羊抗兔二抗(1 ∶5 000),并在室溫下孵育1 h。最后加入ECL試劑在凝膠成像系統中對膜進行可視化,并分別以GAPDH和LaminB作為胞質和胞核蛋白的內參,利用ImageJ軟件分析蛋白條帶灰度值。
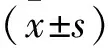
2 結果
2.1 α-mangostin保護LPS/ATP誘導的小膠質細胞損傷CCK-8法檢測結果表明各組間的細胞增殖活力差異均有統計學意義(F=112.615、327.196,P<0.05)。與Ctrl組相比,低濃度(10、20、40 μmol/L)的α-mangostin對小膠質細胞增殖活力無明顯影響(P>0.05),而高濃度(80 μmol/L)的α-mangostin可顯著降低細胞的增殖活力(P<0.05);與Ctrl組相比,LPS/ATP組細胞增殖活力明顯降低(P<0.05),但低濃度(10、20、40 μmol/L)的α-mangostin可顯著改善LPS/ATP對小膠質細胞增殖活力的抑制作用(P<0.05),高濃度(80 μmol/L)α-mangostin可促進LPS/ATP對小膠質細胞的損傷(P<0.05)。見圖1。基于此,40 μmol/L的α-mangostin對細胞無毒性,但對LPS/ATP誘導的損傷的保護作用最強,因此單獨α-mangostin處理組中使用40 μmol/L。

圖1 CCK-8檢測各組小膠質細胞的增殖活力
2.2 各組小膠質細胞中炎癥因子的表達ELISA檢測結果顯示,各組間IL-6、IL-1β、IL-18和TNF-α的含量差異均有統計學意義(F=426.184、268.545、414.872、321.368,P<0.05)。與Ctrl組相比,40 μmol/L α-mangostin組小膠質細胞上清液中炎癥因子IL-6、IL-1β、IL-18和TNF-α含量均無明顯改變(P>0.05),而LPS/ATP組的上清液中均顯著增加(P<0.05);與LPS/ATP組相比,不同濃度α-mangostin干預組上清液中炎癥因子IL-6、IL-1β、IL-18和TNF-α含量隨α-mangostin濃度的增加而依次降低,其中以LPS/ATP+40 μmol/L α-mangostin組降低程度最為明顯(P<0.01)。見表1。

表1 各組小膠質細胞中炎癥因子IL-6、IL-1β、IL-18和TNF-α含量的比較
2.3 各組小膠質細胞中NLRP3炎癥小體的表達Western blot檢測結果顯示,各組間NLRP3、ASC、cleaved caspase-1和IL-1β的表達水平差異均有統計學意義(F=594.310、392.621、511.531、416.508,P<0.05)。與Ctrl組相比,40 μmol/L α-mangostin組小膠質細胞中NLRP3炎癥小體相關蛋白NLRP3、ASC、cleaved caspase-1和IL-1β表達均無明顯差異(P>0.05),LPS/ATP組小膠質細胞中NLRP3、ASC、cleaved caspase-1和IL-1β的蛋白表達均顯著升高(P<0.01);與LPS/ATP組相比,不同濃度α-mangostin干預組中NLRP3、ASC、cleaved caspase-1和IL-1β的蛋白表達呈α-mangostin濃度依賴性而顯著降低(P<0.05),并以LPS/ATP+40 μmol/L α-mangostin組的降低最為明顯(P<0.01),見圖2。

圖2 各組小膠質細胞中NLRP3小體相關蛋白NLRP3、ASC、cleaved caspase-1和IL-1β的表達
2.4 各組小膠質細胞中NF-κB途徑的表達Western blot檢測結果顯示,各組間p-p65/p65比值以及細胞核中p65的表達水平差異均有統計學意義(F=501.839、514.842,P<0.05)。與Ctrl組相比,40 μmol/L α-mangostin組小膠質細胞中p-p65/p65比值無明顯變化(P>0.05),LPS/ATP組小膠質細胞中p-p65/p65比值顯著升高(P<0.05);與LPS/ATP組相比,不同濃度α-mangostin干預組中p-p65/p65比值隨α-mangostin濃度升高而顯著降低(P<0.05),其中以LPS/ATP+40 μmol/L α-mangostin組的降低趨勢最為明顯(P<0.01),見圖3A、3B。隨后,再次應用Western blot檢測小膠質細胞核中p65改變,結果顯示,與Ctrl組相比,40 μmol/L α-mangostin組小膠質細胞核中p65無明顯改變(P>0.05),LPS/ATP組小膠質細胞核中p65表達顯著升高(P<0.01);與LPS/ATP組相比,不同濃度α-mangostin組中p65均顯著降低(P<0.05),其中以LPS/ATP+40 μmol/L α-mangostin組的降低最為明顯(P<0.01),見圖4A、4B。

圖3 各組小膠質細胞中p-p65/p65比值變化

圖4 各組小膠質細胞核中p65表達
3 討論
α-mangostin具有多種生物活性和藥理作用,包括可以調節NLRP3炎癥小體的活性[5-6,11-12]。本研究顯示,α-mangostin可通過下調小膠質細胞中NF-κB信號通路來降低NLRP3炎癥小體的激活水平,從而改善LPS/ATP誘導小膠質細胞炎癥反應。這表明α-mangostin可能具有改善神經炎癥損傷的效果。
NLRP3炎癥小體在多種炎癥性疾病中起關鍵作用,包括神經病變和其他神經系統相關疾病。神經炎癥損傷導致NLRP3的異常激活,可能與過度積聚的炎性細胞因子刺激小膠質細胞活化與增殖有關[5,13-14],然后通過引起膠質屏障形成和膠質瘢痕轉化,導致神經元結構與功能的不可逆損傷[13]。本研究結果顯示,通過降低NLRP3、ASC和cleaved caspase-1的表達水平,并抑制促炎細胞因子的產生,α-mangostin抑制了LPS和ATP聯合誘導小膠質細胞中NLRP3炎癥小體的激活。之前的研究也支持了α-mangostin調節小膠質細胞和NLRP3炎癥小體的活性和功能[9,15]。因此,本研究證明了α-mangostin通過抑制小膠質細胞中的NLRP3炎癥小體的激活,改善了神經炎癥損傷的作用。這使得α-mangostin成為潛在的治療神經炎癥性疾病的藥物選擇。
NF-κB的活化是NLRP3炎癥小體激活的關鍵[16],同時,NF-κB在小膠質細胞介導的神經炎癥中也發揮著重要作用[17-19]。本研究顯示α-mangostin可以顯著抑制LPS/ATP作用下小膠質細胞中NF-κB信號通路的激活,并且這種抑制作用與α-mangostin的濃度相關,隨著濃度的增加,對NF-κB的抑制效果越明顯。這與以前關于α-mangostin抗炎作用的研究一致。例如,Guan et al[20]報道α-mangostin通過抑制LPS誘導的Toll樣受體4的表達和NF-κB的激活來減輕小膠質細胞介導的神經炎癥。Zuo et al[21]在佐劑關節炎大鼠模型中發現,α-mangostin可以顯著降低NF-κB通路中關鍵蛋白的表達和磷酸化,抑制p65的核易位,從而發揮抗炎功能,改善關節病變[21]。以上研究均表明,α-mangostin可以顯著抑制NF-κB的激活,從而抑制小膠質細胞中NLRP3炎癥小體的活化。
綜上所述,α-mangostin通過抑制NF-κB的激活抑制了小膠質細胞中NLRP3炎癥小體的活化。因此,α-mangostin可改善神經炎癥和小膠質細胞的炎癥性損傷。α-mangostin有可能成為防治繼發性脊髓損傷過程中的潛在臨床藥物。

