奶酪中氨基甲酸乙酯含量GC-MS/MS檢測預處理條件優化
梁建英,唐 爍*,劉麗君,謝瑞龍,高玉杰,胡 雪,李翠枝,呂志勇
(1.內蒙古伊利實業集團股份有限公司,內蒙古 呼和浩特 010110;2.國家市場監管重點實驗室(乳及乳制品檢測與監控技術),上海 200127)
氨基甲酸乙酯(ehthy carbamate,EC)屬于食品發酵產生的副產物[1-2],來源于食品的發酵過程,發酵食品中基本含有氰化物和氨基甲酰化合物,即尿素、氨基甲酰磷酸鹽、瓜氨酸和氰化氫[3]。這些主要前體化合物在食品加工和儲存過程中在一定條件下與發酵產生的乙醇發生醇解反應可導致氨基甲酸乙酯的形成[4-6]。動物研究表明,EC會導致包括肺、肝和血管在內的多個組織部位的腫瘤發病率增加。因此,2007年EC已被列入可能的致癌物質(2A組)[7-9]。
眾所周知,在乳品企業中奶酪制品是企業的重要品類之一,近年來已成為乳品企業效益增長的主力軍,奶酪行業目前正處于高速擴張時期,未來仍然會持續較高的景氣度[10-11],國內乳品企業都很重視奶酪市場。奶酪又名干酪,是一種發酵的牛奶制品,因此奶酪中氨基甲酸乙酯的風險防控對于乳品企業意義重大。
目前奶酪中氨基甲酸乙酯含量的檢測尚未有國家標準,但已有一些文章對發酵乳中氨基甲酸乙酯的檢測進行了報道[12-14],如趙艷菊等[15]對發酵乳制品中氨基甲酸乙酯檢測進行了研究,其采用的是氣相色譜-質譜聯用(gas chromatography-mass spectrometry,GC-MS)儀內標法,前處理用有機溶劑二氯甲烷直接提取后上機檢測。袁小美等[16]對發酵乳中氨基甲酸乙酯檢測進行了研究,采用氣相色譜-質譜聯用儀內標法,但其前處理為鹽酸溶液沉淀去除蛋白,然后離心得到提取液,經固相萃取小柱凈化后檢測。可見,針對發酵乳品,多數檢測方法采用的是氣相色譜-質譜聯用內標法[17-19],但在驗證中發現,對于稍微復雜的基質,因氨基甲酸乙酯分子質量小,該方法存在著基質干擾大[20-22],無法定性的問題[23-24]。目前,針對奶酪基質中氨基甲酸乙酯檢測報道甚少,鑒于此,本研究選取兒童奶酪棒為代表性基質,參考已有氨基甲酸乙酯含量檢測的標準及文獻方法,按照六西格瑪的定義-測量-分析-改善-控制(Define-Measure-Analyze-Improve-Control,DMAIC)項目改善路線進行檢測過程影響因子的分析,實驗數據采用Mintab軟件(16.1.0版)進行統計學分析,并對該檢測方法進行方法學考察。采用氣相色譜-三重四級桿串聯質譜(gas chromatographytriple quadrupole tandem mass spectrometry,GC-MS/MS)[25-26]、外標定量法建立了奶酪中氨基甲酸乙酯含量的測定方法,為企業奶酪高質量安全發展保駕護航。
1 材料與方法
1.1 材料與試劑
奶酪樣品:內蒙古伊利實業集團股份有限公司。
乙腈(色譜純)、正己烷(分析純)、氨基甲酸乙酯標準品(純度99.8%):上海安譜實驗科技股份有限公司;二氯甲烷(分析純):成都諾爾施科技有限責任公司;無水硫酸鈉、甲醇(均為分析純):天津市光復科技發展有限公司;超純去離子水:實驗室自制。
1.2 儀器與設備
TQS9000氣相色譜-三重四級桿串聯質譜儀、Biofuge Stratos低溫高速離心機:美國賽默飛世爾科技有限公司;ME204分析天平(感量為0.0001 g):瑞士梅特勒托利多公司;TurboVapLV全自動氮吹儀:瑞典Biotage公司;KS501渦旋振蕩器:德國IKA公司;堿性硅藻土固相萃取柱(2 g/10 mL):上海安譜實驗科技股份有限公司;TG-WAXMS聚乙二醇毛細管色譜柱(30 m×0.25 mm×0.25 μm):美國賽默飛世爾科技有限公司;弗羅里硅土固相萃取柱(0.5 g/3 mL):天津博納艾杰爾科技有限公司。
1.3 方法
1.3.1 樣品提取
準確稱取1.0 g奶酪代表性試樣,置于15 mL的塑料離心管中,然后加入2 mL純水,1 mL乙腈,將其渦旋混勻。混合5 min后,于0 ℃、轉速6 000 r/min條件下離心8 min,收集提取液,殘渣再加入1 mL乙腈重復提取一次,合并兩次提取液,待凈化。
1.3.2 樣品凈化
將樣品提取液全部加入堿性硅藻土固相萃取柱上,當樣品溶液完全滲入柱中后,將其靜置保持10 min。凈化時,首先量取10 mL正己烷,用其淋洗上樣后的固相萃取柱,量取20 mL二氯甲烷,用其洗脫萃取柱,將洗脫液全部收集,置于裝有2 g無水硫酸鈉的氮吹管中,洗脫液經脫水后,于30 ℃緩緩氮吹,直至管中液體約0.5 mL,然后加入甲醇至1 mL,混勻后上機測定。
1.3.3 標準工作溶液配制
加入特定體積的氨基甲酸乙酯標準中間液(500ng/mL),然后用甲醇稀釋到1 mL,配制得到質量濃度分別為5 ng/mL、10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL的氨基甲酸乙酯標準工作溶液,供氣相色譜-串聯三重四級桿質譜儀測定。
1.3.4 氣相色譜-三重四級桿串聯質譜檢測條件
氣相色譜條件:TG-WAXMS聚乙二醇毛細管色譜柱(30 m×0.25 mm×0.25 μm)。升溫程序:50 ℃下保持1 min;以8 ℃/min的速率升溫至180 ℃;以10 ℃/min的速率升溫至240 ℃,然后保持5 min。載氣為高純氦氣(He),流速為1.0 mL/min,進樣量為1 μL。進樣方式為不分流進樣。
2.2.2 混合對照品溶液 分別精密量取“2.2.1”項下單一對照品貯備液各適量,置于同一10 mL量瓶中,加甲醇定容,搖勻,得含淫羊藿屬苷A、朝藿定A1、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、鼠李糖基淫羊藿次苷Ⅱ、寶藿苷Ⅰ質量濃度分別為 19.50、28.20、50.50、66.90、89.60、160.00、26.80、27.24 μg/mL的混合對照品溶液。
質譜條件:電子電離(electronic ionization,EI)源;電子能量70 eV;傳輸線溫度250 ℃;離子源溫度280 ℃。
采用選擇反應監測(selective reaction monitoring,SRM)模式;氨基甲酸乙酯的碰撞電壓、定性離子對、定量離子對和保留時間參見表1。

表1 氨基甲酸乙酯的保留時間及質譜參數Table 1 Retention time and mass spectral parameters of ethyl carbamate
氨基甲酸乙酯含量的計算公式如下:
式中:X為氨基甲酸乙酯含量,mg/kg;C為依據標準曲線測得的目標物質量濃度,ng/mL;V為樣品溶液的定容體積,mL;m為試樣質量,g;1 000為換算系數。
2 結果與分析
2.1 樣品預處理條件的優化
2.1.1 不同提取溶劑的選擇
基于氨基甲酸乙酯化合物極性較強,奶酪基質蛋白含量高的特點,本試驗選用二氯甲烷[15]、乙腈、乙腈水溶液(乙腈與水體積比1∶2)[24]及乙酸鉛溶液(質量濃度5 g/100 mL)[27]4種不同試劑進行提取效率對比實驗。分別按照樣品的提取及凈化方法,添加氨基甲酸乙酯標準溶液(質量濃度為0.01 mg/kg),檢測奶酪樣品中氨基甲酸乙酯的回收率,每個條件進行6次平行實驗,收集樣品回收率數據,采用Mintab軟件進行單因子方差分析,結果見圖1。由圖1可知,在95%的置信度下,4種不同提取試劑條件下氨基甲酸乙酯的回收率之間有顯著差異(P<0.05)。二氯甲烷提取條件下,氨基甲酸乙酯平均回收率為37.46%,標準差2.47%;乙腈提取條件下,氨基甲酸乙酯平均回收率為76.46%,標準差12.46%;乙腈水溶液提取條件下,氨基甲酸乙酯平均回收率為78.22%,標準差5.58%;乙酸鉛提取條件下,氨基甲酸乙酯平均回收率為68.73%,標準差17.01%。可見,乙腈水溶液的回收率平均值最高且變異波動較小。因此,本研究中優選乙腈水溶液(乙腈與水體積比1∶2)作為提取溶劑。
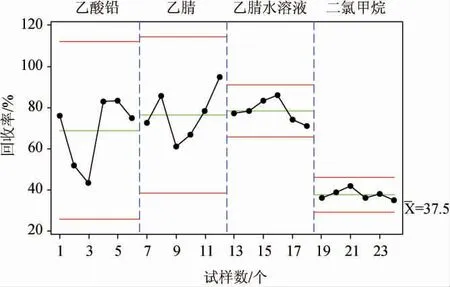
圖1 不同提取試劑條件下氨基甲酸乙酯回收率比較Fig. 1 Comparison of ethyl carbamate recovery rates with different extraction reagents
2.1.2 提取溶劑中乙腈水比例選擇
通過上述不同提取試劑的優化對比得出乙腈水溶液為最佳的前處理提取試劑,其中乙腈可以沉淀蛋白,水溶液可以有效溶解奶酪中的氨基甲酸乙酯。為了得到最佳的乙腈和水的比例,借助Mintab軟件進行正交試驗設計,對試驗測定的回收率數據進行分析。首先對提取試劑中乙腈用量和去離子水用量進行2因子2水平加中心點的正交試驗驗,即低水平(乙腈1.0 mL+去離子水2.0 mL)、中心點(乙腈1.5 mL+去離子水3.5 mL)、高水平(乙腈2.0 mL+去離子水5.0 mL),對正交試驗結果通過Mintab軟件進行方差分析,結果顯示P<0.05,說明中心點顯著,需要增加軸點進行響應曲面設計。在上述的2因子2水平加中心點試驗的基礎上增加了軸點(乙腈1.0 mL+去離子水3.5 mL、乙腈2.0 mL+去離子水3.5 mL、乙腈1.5 mL+去離子水2.0 mL、乙腈1.5 mL+去離子水5.0 mL)實施響應曲面試驗,對試驗結果通過Mintab軟件進行響應優化器分析,分析結果表明:回收率最大時提取溶劑比例為乙腈1 mL、去離子水2 mL。因此,提取試劑乙腈水比例的最優條件為乙腈1.0 mL+去離子水2.0 mL。
2.1.3 固相萃取柱的選擇
奶酪試樣提取后,提取液需經固相萃取柱凈化,從而將樣品中的雜質干擾成分與目標物分離,選擇弗羅里硅土固相萃取柱和堿性硅藻土固相萃取柱進行對比。分別按照樣品的提取及凈化方法,添加質量濃度為0.01 mg/kg的氨基甲酸乙酯標準溶液,測定化合物回收率,每個條件進行至少6次平行實驗,數據通過Mintab軟件進行回歸分析,結果見圖2。由圖2可知,兩種固相萃取柱條件下,回收率均在60%~120%,但是弗羅里硅土柱條件下回收率變異系數為32.1%,不滿足GB/T 27404—2008《實驗室質量控制規范食品理化檢測》中變異系數≤15%的要求,而堿性硅藻土柱條件下變異系數為10.4%,滿足要求。同時,經查閱文獻,發現針對氨基甲酸乙酯,堿性硅藻土固相萃取柱具有吸附性強、高保留、易洗脫的特性[28],與實驗結論相符。因此,優選堿性硅藻土柱凈化。
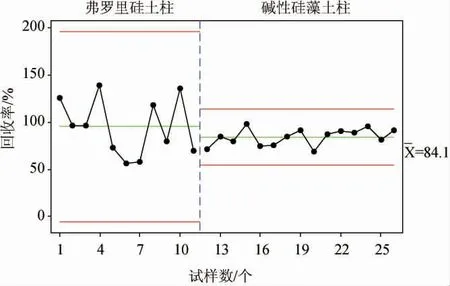
圖2 兩種固相萃取柱條件下氨基甲酸乙酯回收率比較Fig. 2 Comparison of ethyl carbamate recovery rates with two solid phase extraction columns
2.1.4 洗脫劑二氯甲烷用量的選擇
奶酪試樣提取后,提取液經堿性硅藻土固相萃取柱凈化過程中,首先樣品中的氨基甲酸乙酯被固相萃取小柱吸附;然后使用弱極性的正己烷溶劑淋洗小柱,可以很好的除去樣品中含有的雜質,而目標物氨基甲酸乙酯保留在堿性硅藻土固相萃取小柱上;之后需用洗脫試劑二氯甲烷將目標物從固相萃取小柱解吸附,收集洗脫液,濃縮后上機測試。實驗中對二氯甲烷的不同用量10 mL、15 mL、20 mL進行對比,按照相同的實驗操作,添加質量濃度為0.01 mg/kg的氨基甲酸乙酯標準溶液,測定目標化合物回收率,每個條件進行6次平行實驗,數據通過Mintab軟件進行回歸分析,結果見圖3。由圖3可知,洗脫劑二氯甲烷用量與目標化合物回收率呈現線性關系,隨著洗脫試劑用量的增加,目標物回收率增大。結合實驗成本、環境污染、綠色化學等因素,本研究優選洗脫劑二氯甲烷用量為20 mL。
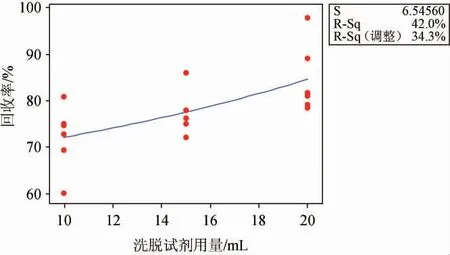
圖3 洗脫劑二氯甲烷用量對氨基甲酸乙酯回收率的影響Fig. 3 Effect of eluent dichloromethane addition on the recovery rates of ethyl carbamate
2.2 標準曲線回歸方程、線性范圍、相關系數、檢出限和定量限
本實驗是外標方法定量,以氨基甲酸乙酯標準溶液的定量離子對峰面積(Y)為縱坐標,標準溶液質量濃度(X)為橫坐標,繪制標準曲線。實驗結果表明:奶酪基質中氨基甲酸乙酯含量在5~200 ng/mL質量濃度范圍內,標準曲線回歸方程Y=2 012X-3 306、相關系數R2=0.998 9,>0.99,線性相關滿足檢測要求。本研究奶酪基質中氨基甲酸乙酯含量的定量限是0.01 mg/kg,信噪比(signal to noise ratio,S/N)滿足不小于10的要求,檢出限是0.005 mg/kg,信噪比(S/N)滿足不小于3的要求,方法靈敏度高。
2.3 方法回收率和精密度試驗
本實驗中選用空白兒童奶酪棒樣品進行低水平(0.01 mg/kg)、中水平(0.02 mg/kg)、高水平(0.10 mg/kg)3個添加水平的加標回收率測定試驗,每個添加水平進行6平行試驗。回收率和精密度的測定結果見表2。由表2可知,加標回收率范圍為69.1%~91.2%,精密度試驗結果相對標準偏差(relative standard deviation,RSD)為4.2%~11.1%,結果滿足GB/T 27404—2008《實驗室質量控制規范食品理化檢測》中方法回收率和精密度檢測要求,適用于奶酪中氨基甲酸乙酯含量的測定。
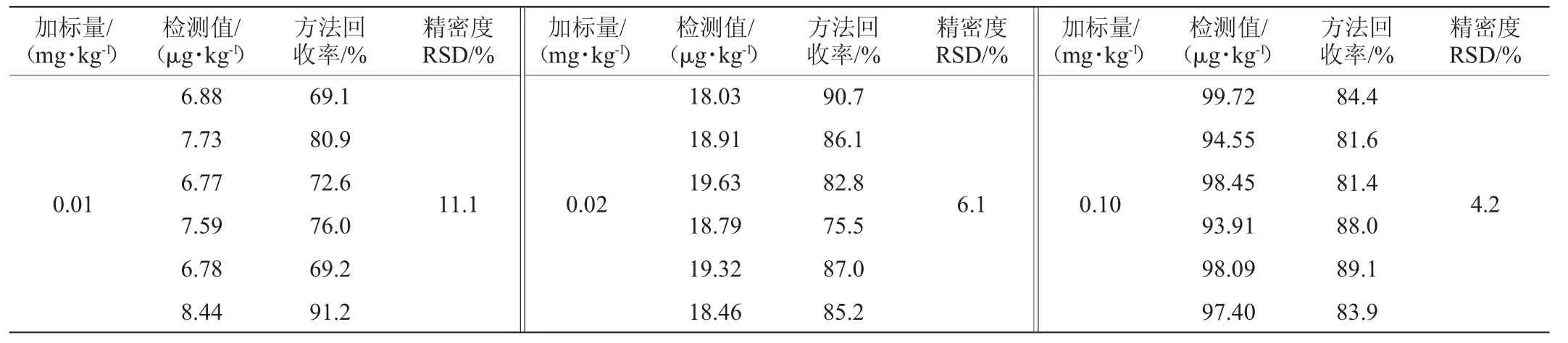
表2 加標回收率和精密度試驗結果(n=6)Table 2 Results of standard recovery rates and precision tests (n=6)
2.4 實際樣品檢測
隨機的抽取5種奶酪產品進行檢測,分別為雙層奶酪棒(混合水果味)、可以吸的奶酪(草莓味)、芝士片(經典原味)、馬蘇里拉芝士碎、馬蘇里拉奶酪,按照方法操作步驟對上述產品進行氨基甲酸乙酯含量測試,檢測結果顯示未檢出。
3 結論
參考現有食品安全國家標準中氨基甲酸乙酯含量的檢測方法,本研究按照精益六西格瑪DMAIC項目改善思路,挖掘出針對奶酪基質,影響其氨基甲酸乙酯含量檢測結果準確性前處理過程提取試劑、固相萃取小柱、洗脫試劑用量等,并對這些因子進行了重點優化試驗設計,試驗數據采用Mintab軟件進行統計學分析,最終建立了一種奶酪中氨基甲酸乙酯含量的氣相色譜-三重四級桿串聯質譜測定方法。該方法在5~200 ng/mL質量濃度范圍內標準曲線線性相關,且相關系數>0.99。方法定量限為0.01 mg/kg,檢出限為0.005 mg/kg,在0.01~0.10 mg/kg含量范圍的加標回收率試驗中,樣品回收率為69.1%~90.7%,精密度試驗結果RSD為4.2%~11.1%。該方法操作簡便,結果準確,可以為奶酪食品的質量安全提供保障。

