MMR蛋白、HER2、Ki-67在結直腸癌中的表達及意義*
楊 飛,張亞銘,周潮平,汪大田,高 斌,馬 軍,湯代彬,袁建偉,王宇翔
(安慶市立醫院普外科,安徽安慶 246000)
結直腸癌的發生、發展是一個復雜的過程,染色體不穩定(chromosomal instability,CIN)和微衛星不穩定(microsatellite instability,MSI)是結直腸癌發生、發展的主要分子通路[1-2]。CIN是散發性結直腸癌的主要原因,而MSI被認為是Lynch綜合征的遺傳誘因,同時其也參與了散發性結直腸癌的發生、發展,具有MSI的結直腸癌約占所有結直腸癌的15%[3]。MSI是錯配修復(mismatch repair,MMR)蛋白功能缺陷導致的結果,可以通過PCR檢測微衛星位點或免疫組織化學染色檢測MMR蛋白(MLH1、PMS2、MSH2和MSH6)的表達來判斷,二者檢測結果的一致性可以達到95%以上,而免疫組織化學臨床簡便易行,檢測成本低,較為容易開展[4-5]。檢測結直腸癌的MMR蛋白的狀態對于Lynch綜合征的診斷及結直腸癌的治療有重要作用。人表皮生長因子受體(human epidermal growth factor receptor,HER)2屬于ErbB/HER酪氨酸激酶家族,是多種癌癥的癌基因和預測生物標志物,也是結直腸癌的潛在治療靶點[6]。Ki-67是反映細胞增殖狀態的特異性指標,與腫瘤細胞增殖活性及腫瘤的發生、發展和轉移有關,在各種研究中,Ki-67的表達與結直腸癌患者的相關性目前尚無定論[7-8]。
目前,國內大部分醫院對結直腸癌常規行免疫組織化學來了解MMR蛋白表達情況,但大樣本量報道較少,且尚無同時檢測MMR蛋白、HER2和Ki-67的研究報道。本研究旨在探討MMR蛋白、HER2和Ki-67在可切除結直腸癌中的表達并揭示其與臨床病理特征的關系,為結直腸癌的臨床診療提供一定的參考依據,現報道如下。
1 資料與方法
1.1 一般資料
回顧性分析2017年10月至2022年5月于本院普外科行手術治療的559例結直腸患者臨床資料。納入標準:(1)術后均經病理證實為結直腸腺癌;(2)臨床及病理資料完整;(3)有足夠的原發腫瘤組織進行免疫組織化學檢測;(4)檢測結果包括MMR蛋白、HER2和Ki-67表達情況。排除標準:(1)術前接受新輔助化療、放療、免疫治療或分子靶向治療等抗腫瘤治療;(2)診斷時合并其他原發惡性腫瘤;(3)診斷為結直腸癌原位癌、鱗狀細胞癌或腺鱗癌。559例患者中男324例,女235例,年齡26~89歲,平均(68.01±10.41)歲,其中直腸癌患者248例,左半結腸癌患者142例,右半結腸癌患者169例。
1.2 方法
1.2.1資料收集
收集患者的臨床及病理資料,包括性別、年齡、腫瘤位置、腫瘤大小、腫瘤大體類型、組織學分型(腺癌、黏液腺癌或印戒細胞癌)、組織學分級、浸潤深度、淋巴結轉移、遠處轉移、TNM分期及MMR蛋白、HER2、Ki-67的表達情況,TNM分期依據美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)/國際抗癌聯盟(Union for International Cancer Control,UICC)第8版TNM分期系統。
1.2.2結果判斷
(1)MMR蛋白表達判讀標準:MLH1、MSH2、PMS2、MSH6表達均定位于細胞核,細胞核不著色即為表達缺失,細胞核呈現棕黃色或黃色顆粒則判斷為陽性表達。其中MLH1、MSH2、PMS2、MSH6任意蛋白表達缺失判定為表達缺陷(deficient mismatch repair,dMMR),4個蛋白均陽性表達判定為表達完整(proficient mismatch repair,pMMR)。(2)HER2表達判讀標準:HER2表達定位于腫瘤細胞膜,根據染色結果評分為0、+、++、+++,其中0為腫瘤細胞無膜染色或<10%腫瘤細胞著色,+為≥10%腫瘤細胞團微弱或隱約可見膜染色,++為≥10%腫瘤細胞團有弱至中等強度的基底側膜、側膜染色,+++為≥10%腫瘤細胞基底側膜、側膜強染色[9]。因本院病理科前期未開展FISH檢測,故本研究收集的病例中HER2++未行FISH檢測。(3)Ki-67表達判讀標準:Ki-67表達定位于細胞核,呈棕黃色顆粒視為陽性,根據染色結果評分為0、+、++、+++,其中0為陽性細胞數<10%;+為弱陽,即陽性細胞數10%~<25%;++為中等陽性,即陽性細胞數25%~≤75%;+++為強陽性,即陽性細胞數>75%。所有免疫組織化學結果均經兩名高年資病理醫師共同判讀確認。
1.3 統計學處理
采用SPSS26.0軟件進行數據分析,計數資料以例數或百分比表示,比較采用χ2檢驗;采用Spearman等級相關分析相關性,以P<0.05為差異有統計學意義。
2 結 果
2.1 結直腸癌患者MMR蛋白表達情況
559例結直腸癌患者中43例(7.7%)為dMMR,見表1。

表1 結直腸癌患者MMR蛋白表達情況
2.2 不同臨床病理特征結直腸癌患者的MMR蛋白、HER2和Ki-67表達情況比較
559例結直腸癌患者中HER2 +++為8例(1.4%),Ki-67 +++為251例(44.9%)。不同年齡、腫瘤位置、腫瘤最大徑、腫瘤大體類型、組織學分級、淋巴結轉移、TNM分期的結直腸癌患者dMMR表達率比較,差異有統計學意義(P<0.05)。不同腫瘤大體類型的結直腸癌患者HER2 ++/+++表達率比較,差異有統計學意義(P<0.05)。不同組織學分型、組織學分級、淋巴結轉移、遠處轉移、TNM分期的結直腸癌患者Ki-67 +++表達率比較,差異有統計學意義(P<0.05),見表2。
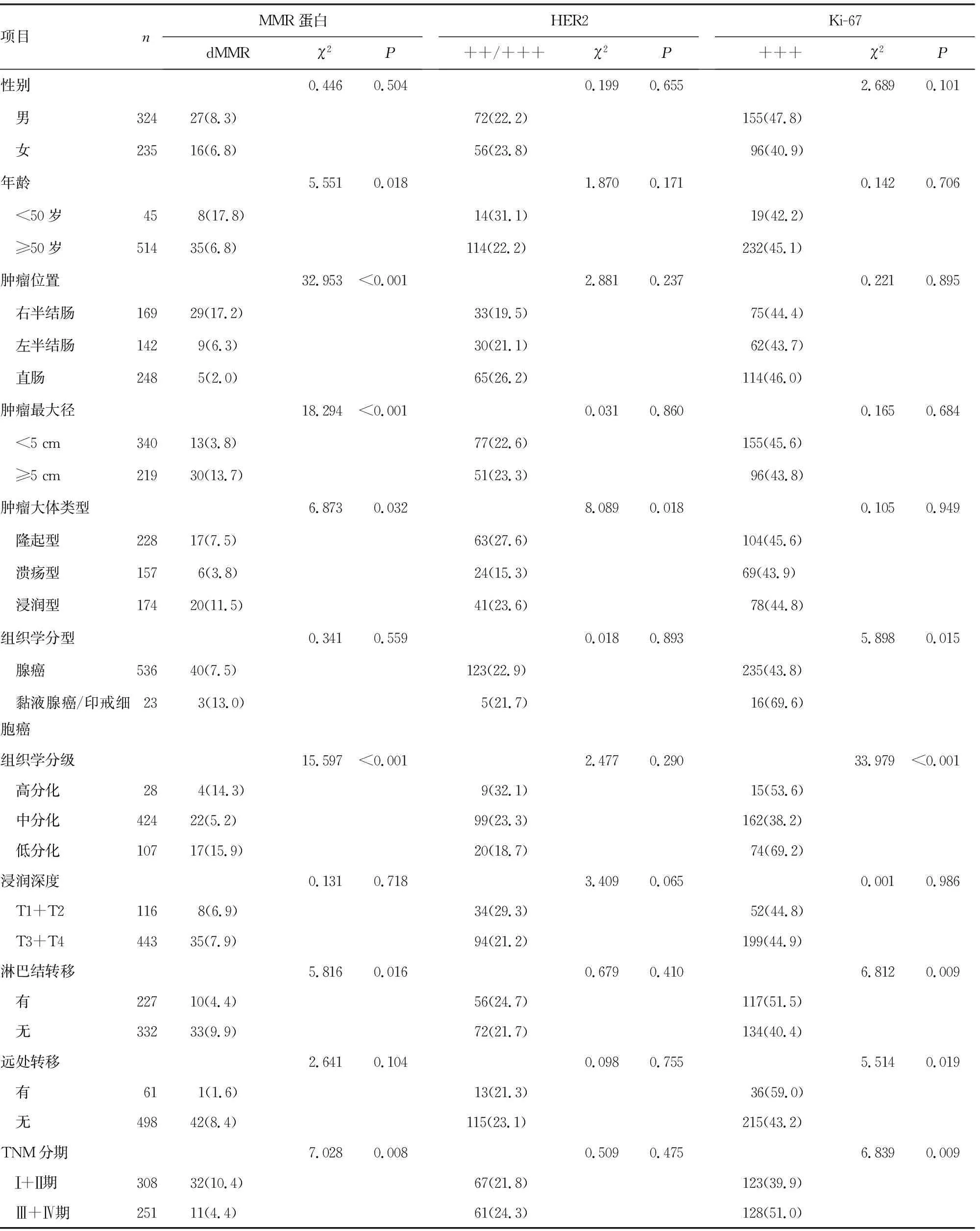
表2 不同臨床病理特征結直腸癌患者的MMR蛋白、HER2和Ki-67表達情況比較
2.3 MMR蛋白與HER2和Ki-67表達的相關性分析
相關性分析結果顯示,MMR蛋白與HER2、Ki-67表達均無相關性(P>0.05),見表3。
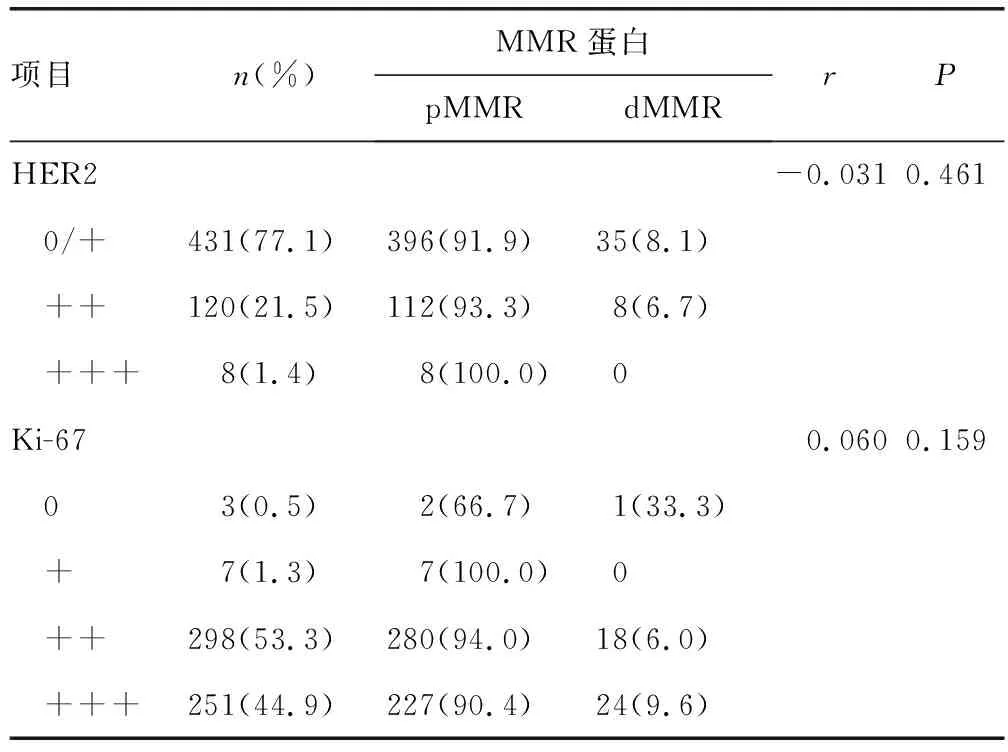
表3 MMR蛋白與HER2和Ki-67表達的相關性分析[n(%)]
3 討 論
結直腸癌是最常見的消化道惡性腫瘤之一,基于國家癌癥中心最新數據,2016年中國的結直腸癌的發病率位居第2,死亡率位居第4,較前有上升趨勢[10]。結直腸癌對人類健康構成了巨大威脅,了解其臨床病理特點,可為臨床診斷和治療提供指導。
MMR基因啟動子的高甲基化導致散發性結直腸癌,而MMR或EpCAM基因的胚系突變與Lynch綜合征相關,通過PCR檢測MSI或免疫組織化學檢測MMR蛋白表達既可以篩查Lynch綜合征,又可以指導結直腸癌患者的藥物使用,如5-氟尿嘧啶和程序性死亡受體-1(programmed cell death protein-1,PD-1)抑制劑[11]。若沒有分子實驗室,診斷結直腸癌合并MSI通常依賴于MMR蛋白的免疫組織化學染色。本研究使用免疫組織化學檢測559例結直腸癌MMR蛋白表達,發現dMMR占比為7.7%,與國內幾項大樣本量研究[4,12]結果相一致,但低于歐洲[13],說明不同地域、種族MMR蛋白表達水平存在差異。本研究顯示,不同年齡、腫瘤位置、腫瘤最大徑、腫瘤大體類型、組織學分級、淋巴結轉移、TNM分期的結直腸癌患者dMMR表達率比較,差異有統計學意義(P<0.05),與文獻[3,13]報道基本一致,具有典型的微衛星高度不穩定(microsatellite instability-high,MSI-H)的臨床和病理特征。目前,關于MMR狀態的性別分布存在爭議,LIANG等[14]研究表明dMMR在女性中更常見,而ARORA 等[15]研究則發現男女之間無差異,這與本研究結果一致。
在本研究dMMR患者中,以MLH1、PMS2聯合表達缺失(48.8%)最為常見,其次為MSH2、MSH6聯合表達缺失(18.6%)和PMS2單獨表達缺失(14.0%),這與XU等[3]研究結果一致。在結直腸癌中MLH1缺失是最常見的,多見于散發性病例,而由于PMS2與MLH1形成異源二聚體,因此MLH1的缺失也會導致PMS2的丟失。MLH1和PMS2同時缺失是dMMR結直腸癌最常見的類型,多由鋸齒狀病變通過鋸齒狀途徑進展為結直腸癌,與MLH1啟動子甲基化和BRAF突變相關[16]。MLH1啟動子甲基化或胚系突變還可以導致PMS2的單獨突變,可以解釋本研究中的PMS2的高比例單獨表達缺失[17]。約70%的Lynch綜合征患者中發現MLH1和MSH2突變,由于MSH2與MSH6形成異源二聚體,因此MSH2的缺失也會導致MSH6的丟失,MSH2和MSH6的同時缺失在Lynch綜合征中很常見[18]。對本研究dMMR病例進一步進行胚系突變檢測或MLH1啟動子甲基化、BRAF突變檢測,能識別散發性結直腸癌和Lynch綜合征,應特別鼓勵這部分患者進行Lynch綜合征的遺傳咨詢和檢測。
HER2在乳腺癌和胃癌中都得到了很好的研究和臨床應用,但對于HER2表達能否指導結直腸癌治療及評價預后尚未達成共識,HER2在結直腸癌中的診斷價值也尚未完全標準化。國外大樣本量研究發現,HER2參與了結腸癌的發生、發展,但HER2的過表達與患者總生存率和無病生存率無關,HER2的預后價值仍存在爭議[19]。而本研究發現,不同腫瘤大體類型的結直腸癌患者HER2 ++/+++表達率比較,差異有統計學意義(P<0.05)。有研究發現,HER2在結直腸癌中的陽性表達率和臨床意義存在較大分歧,其報道的HER2陽性表達率為1%~50%,這與樣本量大小、標本質量和HER2陽性判斷標準有關[20]。雖然本研究免疫組織化學法檢測HER2表達嚴格按照指南界定[9],有8例(1.4%)為+++,但又由于有120例(21.5%)患者為++,對于這部分患者未行FISH檢測,勢必影響研究結論。對于HER2與結腸直腸癌的生物學特征仍需進一步研究,目前本課題組正在開展結直腸癌患者術前腸鏡小標本及手術術后病理標本HER2表達水平的前瞻性研究,以期闡釋這一類問題。
本研究結果顯示,不同組織學分型、組織學分級、淋巴結轉移、遠處轉移、TNM分期的結直腸癌患者Ki-67 +++表達率比較,差異有統計學意義(P<0.05),與其他研究[21-22]結果一致。有meta分析發現,Ki-67的高表達與結直腸癌患者的不良預后明顯相關,其納入34項研究共6 180例結直腸癌患者,總生存率和無病生存率的合并風險比分別為1.54(P=0.005)、1.43(P=0.008),Ki-67的高表達預示著結直腸患者較差的總生存率和無病生存率[23]。
目前在結直腸癌領域缺乏對于MMR蛋白與HER2、Ki-67的聯合表達研究,本研究提示MMR蛋白的表達與HER2、Ki-67的表達在免疫組織化學蛋白表達水平上無相關性,這一結果說明三者在結直腸癌的發病機制中作用機制可能不同,需進一步深入研究。對于晚期結直腸癌,同時檢測MMR蛋白和HER2,對于選用免疫治療或抗HER2靶向治療有指導意義。QIU等[24]采用二代測序檢測HER2基因突變或MSI-H的結直腸癌患者,發現攜帶HER2突變的MSI-H患者使用PD-1抑制劑的無進展生存期明顯短于無HER2突變的患者。最近的一項Ⅱ期臨床研究發現,對于HER2陽性的難治性轉移性結直腸癌,德曲妥珠單抗(DS-8201研究)顯示出強大和持久的抗腫瘤活性,其中包括接受過伊立替康和抗HER2靶向治療等兩種或兩種以上方法的患者[25]。在本研究中,dMMR患者未發現HER2 +++,因HER2 ++未行FISH檢測,對于MMR蛋白和HER2在結直腸中的表達及意義尚需進一步研究。
綜上所述,本研究報道了行手術治療的結直腸癌患者的dMMR檢出率及HER2、Ki-67表達陽性率,比較了三者與結直腸癌臨床病理特征的關系,為進一步的臨床治療及研究提供了基礎。但本研究也存在局限性:(1)未進行MMR基因分析,故遺傳性和散發性病例的確切比例尚不清楚;(2)未對HER2 ++患者行FISH檢測,僅從蛋白表達水平上探討二者相關性,存在一定的局限性;(3)本研究病例是近年來收集的,一些患者的隨訪時間不夠長,無法進行生存分析,需進一步的隨訪研究。

