晚期肺癌抗腫瘤治療患者并發肌少癥風險的臨床研究
羅小珍,謝靈靈,雷曉珍,楊黎黎,楊 欣,廖 燕△
(1.成都上錦南府醫院/四川大學華西醫院上錦醫院腫瘤一科,成都 611730;2.四川大學華西醫院老年醫學中心/四川大學華西護理學院,成都 610041)
肺癌是我國患病率和病死率最高的惡性腫瘤,嚴重威脅國人健康[1]。據統計,2025年我國肺癌年死亡人數預計可達100萬。70%~75%的新發肺癌患者確診時已處于晚期[2],70%~80%的晚期肺癌患者需要接受抗腫瘤治療[3]。
肌少癥是指因持續骨骼肌量流失,肌肉強度和功能下降而引起的綜合征。患有肌少癥的老年人站立困難、步履緩慢、容易跌倒骨折,還會影響器官功能,可能還會引發心臟和肺部衰竭,甚至死亡。骨骼肌量的測定可通過CT、MRI或生物電阻抗分析(BIA)。前期研究提示晚期肺癌患者合并肌少癥比率約為55.8%,合并肌少癥可對患者預后造成不利影響[4]。目前,對于晚期肺癌抗腫瘤治療患者并發肌少癥的相關危險因素研究尚不足,本次研究試圖做出初步探索。
1 資料與方法
1.1 一般資料
本研究為回顧性隊列研究,篩選2021年1-12月于成都市某三甲醫院腫瘤科抗腫瘤治療的晚期肺癌患者。納入標準:(1)病理確診為肺癌;(2)無法進行根治手術,TNM分期為Ⅲ~Ⅳ期;(3)接受一線抗腫瘤治療且至少連續完成4個治療周期。排除標準:(1)合并有其他惡性腫瘤;(2)病歷資料缺失或不完整。本研究已通過該醫院倫理委員會審核[審批號:2022年審(368)號]。根據樣本量估算公式[5]:
n=Zα2×P×(1-P)/δ2
①
其中Zα為α水平相應的標準正態差,P為總體率,δ為絕對誤差水平或容許的絕對精度水平。取α=0.05,查表得雙側Z0.05=1.96;根據國內文獻研究,晚期肺癌患者合并肌少癥的患病率為30%~60%[6],取患病率為30%,考慮到10%的質量問題,最終得出所需樣本量至少為248例。本研究選取285例晚期肺癌抗腫瘤治療患者納入分析,患者人口學資料見表1。
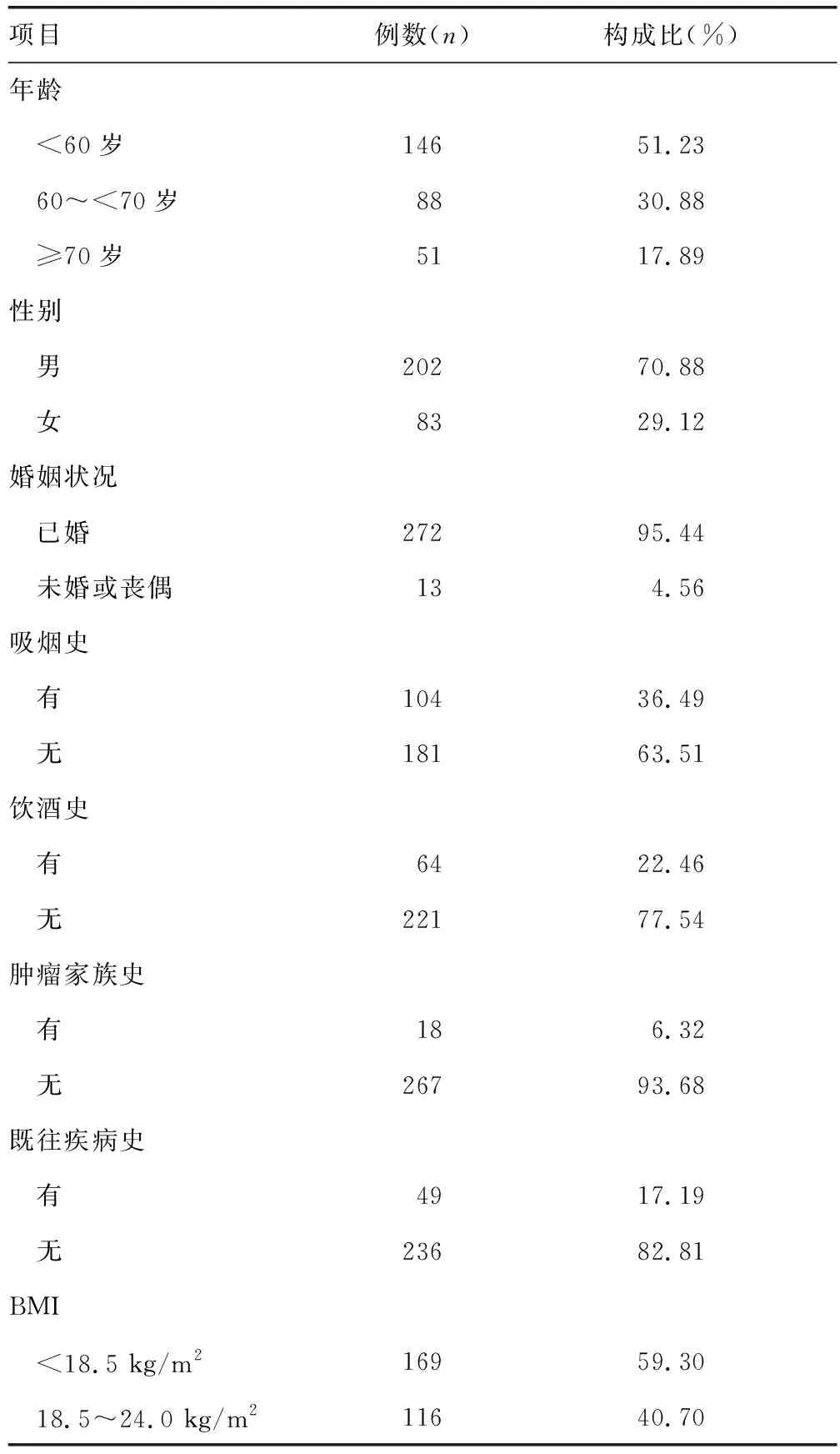
表1 晚期肺癌患者人口學資料(n=285)
1.2 方法
1.2.1肌少癥檢測方法
本研究采用患者胸部CT測量第12胸椎(T12)椎弓根水平肌肉組織的橫截面積 (cm2),計算得到骨骼肌指數(SMI)作為肌少癥的診斷標準。具體方法為收集患者入組后首次胸部CT影像,CT影像均使用16層螺旋CT掃描儀,切片厚度為5 mm,電壓設置為100~140 kV,電流強度(mA)根據患者的體型大小進行變化,檢測器準直度為0.75~1.50 mm。測量包括豎脊肌、背闊肌、內斜肌、外斜肌、腹直肌、肋間外肌和肋間肌在內的肌肉面積,肌肉組織CT值為-29~150 HU 。T12SMI診斷標準的臨界值參考之前研究對SMI臨界值的定義:男性<42.6 cm2/m2、女性<30.6 cm2/m2[7]則定義為肌少癥。
1.2.2臨床評價指標
通過醫院信息系統電子病歷系統收集患者各項臨床資料及數據。一般人口學資料包括:年齡、性別、婚姻狀況、吸煙史、飲酒史、腫瘤家族史、既往病史、BMI。疾病相關臨床數據包括:體力活動狀態(performance status,PS)評分、病理類型、病理分期、治療方案、合并基礎疾病等;實驗室檢查數據包括生化檢查和血常規檢查:血紅蛋白、清蛋白、淋巴細胞絕對值、肌酐等。本研究對患者生活質量評價采用生命質量核心量表(quality-of-life questionnaire-core 30,QLQ-C30)[8],該量表由30個項目構成,QLQ-C30量表得分經轉換為標準分后得分范圍為0~100 分。
1.4 統計學處理
2 結 果
2.1 兩組患者的基本臨床資料及肌少癥比較
285例患者中有123例(43.15%)診斷為肌少癥,納入肌少癥組,其余為非肌少癥組,單因素分析結果顯示:性別(P<0.001)、婚姻狀況(P=0.038)、病理診斷(P=0.007)、血紅蛋白(P=0.046)、淋巴細胞絕對值(P=0.019)、肌酐(P=0.008)、清蛋白(P=0.028)、BMI(P<0.001)在肌少癥組與非肌少癥組間差異有統計學意義,是晚期肺癌抗腫瘤治療患者并發肌少癥的影響因素,見表2。

表2 晚期肺癌抗腫瘤治療患者并發肌少癥相關影響因素分析(n=285)
2.2 晚期肺癌抗腫瘤治療患者并發肌少癥影響因素的多因素分析
以有無發生肌少癥作為因變量(賦值:否=0,是=1),將上述P<0.10的性別、婚姻狀況、病理分期、血紅蛋白、淋巴細胞絕對值、肌酐、清蛋白、BMI納入二元logistic回歸分析。計量資料直接用原始數值代入,二分類變量、多分類變量分別被賦值為0,1和相應的啞變量進入回歸模型(進入標準為0.05,剔除標準為0.10),結果顯示:性別(P<0.001)、病理分期(P=0.012)、肌酐(P=0.031)、BMI(P<0.001)是晚期肺癌抗腫瘤治療患者并發肌少癥的影響因素,見表3。
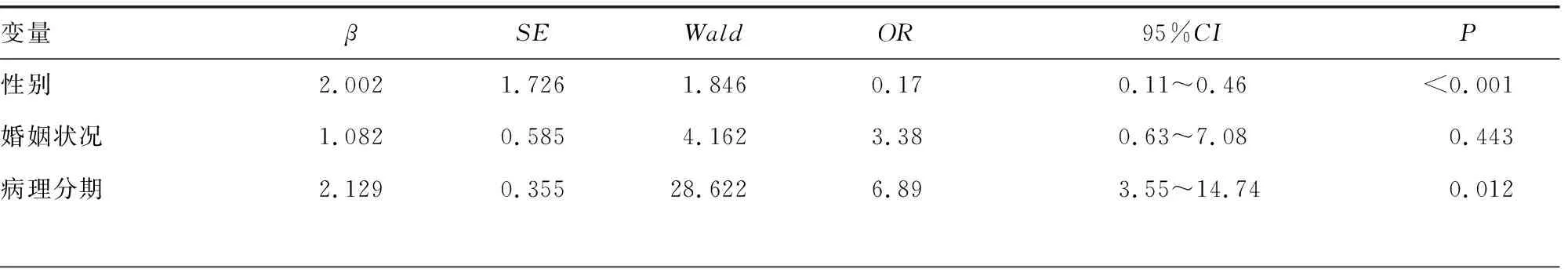
表3 晚期肺癌抗腫瘤治療患者并發肌少癥的多因素分析(n=285)
2.3 晚期化療患者QLQ-C30量表得分比較
肌少癥組患者QLQ-C30量表得分為(59.07±11.80)分,低于非肌少癥組的(62.12±12.19)分,兩組比較差異有統計學意義(t=2.14,P=0.035)。
3 討 論
3.1 國內外肌少癥相關研究
現有研究大多基于CT圖像判定特定區域的骨骼肌含量來診斷肌少癥[9-10],CT測量肌肉含量是基于肌肉與其他組織CT值的差異,圖形軟件可對此加以區別并自動測量。有研究報道,采用常規胸部CT掃描確定T12水平的橫斷面測算的SMI,與通過第3腰椎(L3)CT圖像測算的SMI[ 11],對晚期肺癌患者預后具有相似的預測價值。本研究285例肺癌患者中有123例(43.15%)存在肌少癥,JENSEN等[12]研究證明,肌少癥在晚期肺癌患者中的患病率可達52%。一項對TNM ⅢB~Ⅳ期的112例晚期肺癌患者的調查研究發現64例患者診斷為肌少癥,患病率為57.1%[13]。說明肌少癥廣泛存在于腫瘤患者中,要關注晚期肺癌患者肌少癥狀況,給予規范化治療,以期取得更好的臨床結局。
3.2 肌少癥與晚期肺癌抗腫瘤治療患者生活質量的關系
本研究分別對患者進行了QLQ-C30量表得分比較,結果提示肌少癥組總體得分低于非肌少癥組。晚期肺癌并發肌少癥患者生命質量較差,這與以往多項相關報道結論一致[14-15]。隨著時間的延長,生活質量得分降低越多,提示醫務人員應積極采取全方位、多途徑干預方法解決患者肌少癥的情況,以緩解對肺癌患者生活質量的影響,從而提高患者生命質量。
3.3 肌少癥在晚期肺癌抗腫瘤治療患者中的發生情況及預后影響
最新的腫瘤惡病質定義[16]已經將肌肉減少作為惡病質的核心組分。癌癥患者常因身體機能差、抗腫瘤治療不耐受等原因增加了肌少癥的發病率,癌癥患者肌少癥發生率在15%~50%[17]。近年來國內外已有研究關注肌少癥對晚期肺癌患者預后的預測價值[18]。有研究發現即使在BMI正常的腫瘤患者中,肌少癥也與腫瘤患者的預后密切相關。GINGRICH等[19]在對100例住院老年患者研究中發現,低BMI同時存在于肌少癥、營養不良及惡病質患者中,這可能是因為BMI降低會導致患者體內代謝異常,進而內源性氮丟失,增加谷氨酰胺分解代謝速度,蛋白質合成減少,骨骼肌含量不斷丟失,肌肉萎縮,進而加重營養不良的發生。有研究報道,肺癌患者在病程進展過程中會出現機體代謝功能紊亂[20],肌肉中肌糖原和脂質分子不斷降解,患者BMI下降從而引發嚴重營養不良,導致惡病質的發生。各項研究表明,合并肌少癥的晚期肺癌患者預后比未發生肌少癥的晚期肺癌患者預后更差,提示肌少癥可作為晚期肺癌預后預測指標,臨床評估肌少癥有助于預測患者預后,對指導臨床治療有重要意義。
目前,臨床對于晚期肺癌抗腫瘤患者并發肌少癥的關注明顯不足,本研究的局限性在于其為單中心回顧性研究,患者有些信息未能采集,可能存在選擇偏倚。未來研究應納入多中心進行前瞻性研究,納入更多的相關因素充分探討晚期肺癌抗腫瘤患者并發肌少癥的危險因素。
綜上所述,性別、病理分期、肌酐、BMI是晚期肺癌抗腫瘤患者并發肌少癥的影響因素,肌少癥可明顯影響患者生活質量,值得臨床重視和進一步深入研究。

