新橙皮苷治療潰瘍性結(jié)腸炎的網(wǎng)絡(luò)藥理學(xué)研究及實驗驗證
吳與倫,張欣然,沈阿靈,劉麗雅,魏麗慧,陳友琴,方 翌*
(1.福建中醫(yī)藥大學(xué)中西醫(yī)結(jié)合學(xué)院,福建 福州 350122;2.福建省中西醫(yī)結(jié)合老年性疾病重點實驗室,福建 福州 350122;3.福建中醫(yī)藥大學(xué)科技創(chuàng)新與轉(zhuǎn)化中心,福建 福州 350122;4.美國凱斯西儲大學(xué)醫(yī)學(xué)院,俄亥俄州 克利夫蘭 44106)
潰瘍性結(jié)腸炎(ulcerative colitis,UC)是一種慢性炎癥性腸病,以黏膜和胃腸道生理改變?yōu)樘卣鳎R床表現(xiàn)為腹痛、便血、腹瀉、體質(zhì)量減輕,但目前其發(fā)病機制尚不清楚[1]。UC 的主要病機以濕熱瘀血為標(biāo),脾腎虧虛為本;清熱化濕散瘀、止瀉止痢為其治法治則[2]。中醫(yī)藥治療UC 的歷史悠久,臨床療效確切,抗炎效果顯著[3]。清化腸飲是臨床治療UC 的常用方,方中厚樸苦燥降瀉,辛散溫通,入大腸經(jīng),是中醫(yī)學(xué)治療胃腸疾病要藥[4]。新橙皮苷作為厚樸中的活性成分,在最新的研究中被證實具有較強的抗炎、抗氧化、免疫調(diào)節(jié)等作用,可減輕DSS誘導(dǎo)的UC 小鼠結(jié)腸黏膜組織病理損傷,但其治療UC 中的作用機制尚未明確[5-7]。因此,本研究擬采用網(wǎng)絡(luò)藥理學(xué)分析和體內(nèi)實驗,初步探討新橙皮苷治療潰瘍性結(jié)腸炎的相關(guān)機制,以期闡明新橙皮苷治療UC 的新機制和新靶點,為臨床研發(fā)治療UC 藥物提供新的實驗依據(jù)。
1 實驗材料
1.1實驗動物 30 只雄性SPF C57BL/6J 小鼠,8~10 周齡,體質(zhì)量(21±3)g,購自上海SLAC 實驗動物科技有限公司,所有動物均飼養(yǎng)于福建中醫(yī)藥大學(xué)實驗動物中心SPF 級實驗室,動物使用許可證編號:SYXK(閩)2020-0002。本實驗已通過福建中醫(yī)藥大學(xué)倫理委員會批準(zhǔn)(FJTCM IACUC 2022185)。
1.2實驗藥物的配制 新橙皮苷給藥劑量按照人與動物體型系數(shù)換算,每只小鼠按照0.1 mL/10 g 的灌胃劑量配制藥物,以蒸餾水配置0.5、5、50 mg/(kg·d)的新橙皮苷混懸液,超聲4~5 h 至液體充分溶解澄清透明,每日現(xiàn)配現(xiàn)用。
1.3實驗試劑 DSS 購自美國MP Biochemicals 公司(貨號:0216011080-100 g);新橙皮苷購自北京MedChemExpress 有限公司,純度>98.48%(貨號:HY-N0101);便隱血(OB)試劑(匹拉米洞法)購自珠海市貝索生物技術(shù)有限公司(貨號:BA2020B);4%多聚甲醛固定液、蘇木素溶液購自北京索萊寶公司(貨號:LA0427、G1140);免疫組化超敏Ultra-SensitiveTMSP 試劑盒購自福州邁新生物技術(shù)有限公司(貨號:KIT-9710);p-p38 一抗購自南京SAB公司(貨號:12322);p38 一抗購自美國CST 公司(貨號:8690)。
1.4實驗儀器 生物組織脫水機和生物組織石蠟包埋機購自湖北孝感亞光有限公司;全自動石蠟切片機和倒置顯微鏡購自德國Leica 公司;熒光正置顯微鏡購自日本Nikon 公司。
2 實驗方法
2.1潰瘍性結(jié)腸炎疾病靶點的收集 以“ ulcerative colitis”為檢索詞,在GeneCards 數(shù)據(jù)庫(https://www.genecards.org/)和DisGenet(http://www.disgenet.org/)2 個數(shù)據(jù)庫中檢索UC 的相關(guān)人類基因靶點,并將2 個數(shù)據(jù)庫中的靶點取并集并刪除重復(fù)項。
2.2新橙皮苷作用靶點預(yù)測 在中藥系統(tǒng)藥理學(xué)數(shù)據(jù)庫與分析平臺(TCMSP,https://tcmspw.com/tcmsp.php)、中醫(yī)藥整合藥理學(xué)研究平臺(TCMIP,http://www.tcmip.cn/TCMIP/index.php)、Swisstargets數(shù)據(jù)庫(http://www.swisstargetprediction.ch/)、Sym-Map(http://www.symmap.org/)、BATMAN-TCM(http://bionet.ncpsb.org.cn/batman-tcm/)中檢索新橙皮苷潛在蛋白靶點,利用Unitprot 數(shù)據(jù)庫(http://www.Unitprot.org/)將獲取的蛋白靶點校準(zhǔn)其基因名并刪除重復(fù)項,與UC 的疾病相關(guān)靶點取交集獲得的新橙皮苷治療UC 的潛在靶點。
2.3GO 和KEGG 富集分析 將“2.2”項中預(yù)測的新橙皮苷治療UC 的潛在靶點基因名輸入DAVID數(shù)據(jù)庫(https://david.ncifcrf.gov/)中,設(shè)置物種為“ homo sapiens”,進(jìn)行GO 和KEGG 富集分析,篩選P<0.005的結(jié)果,從中選取KEGG 通路富集排名前20和GO 分類富集排名前10 的結(jié)果,使用R-Studio 軟件對結(jié)果進(jìn)行可視化,并分別繪制相應(yīng)氣泡圖。
2.4構(gòu)建靶點相互作用(PPI)網(wǎng)絡(luò) 將“2.2”中新橙皮苷治療UC 的潛在靶點基因名導(dǎo)入STRING 生物信息學(xué)數(shù)據(jù)庫(https://string-db.org/),設(shè)置物種為“ homo sapiens”,置信度設(shè)定>0.9,獲取作用靶點的互作信息。通過Cytoscape 3.7.2 軟件繪制PPI 網(wǎng)絡(luò)圖,并對網(wǎng)絡(luò)圖進(jìn)行拓?fù)浣Y(jié)構(gòu)分析,確定新橙皮苷治療UC 的核心靶點。
2.5小鼠潰瘍性結(jié)腸炎模型的構(gòu)建 采用口服2%葡聚糖硫酸鈉(DSS)溶液的方法建立潰瘍性結(jié)腸炎模型[8],讓小鼠自由飲用7 d 2% DSS 溶液,DSS溶液每天更換1 次,第8~10 d 恢復(fù)正常飲水,第11 d 取材,期間正常飲食。
2.6分組與干預(yù) 小鼠適應(yīng)性喂養(yǎng)7 d 后,在開始構(gòu)建模型前,通過隨機數(shù)字表法將其分為對照組、模型組和低、中、高劑量組,每組6 只。構(gòu)建模型后,對照組和模型組小鼠使用蒸餾水灌胃,低、中、高組(具體劑量參見“1.2”)使用配置好的不同濃度新橙皮苷溶液灌胃。
2.7疾病活動指數(shù)(disease activity index,DAI)評分及體質(zhì)量變化計算 造模期間每日通過盲法評估每只小鼠臨床特征:包括糞便性狀、體質(zhì)量改變和便血程度情況,并參考JACKSON 等[9]的評估標(biāo)準(zhǔn)計算DAI 評分。同時,每日記錄小鼠體質(zhì)量與給藥第1 天變化百分比,繪制小鼠體質(zhì)量變化百分率折線圖[10-11]。
2.8結(jié)腸組織免疫組化檢測 給藥干預(yù)11 d 后取材,小鼠結(jié)腸組織固定于4%多聚甲醛中;24 h 后,進(jìn)行組織梯度乙醇脫水及二甲苯石蠟透明,將結(jié)腸組織包埋于石蠟,切成4 μm 切片,用顯微鏡載玻片承載后60 ℃烘烤5 h,將其脫蠟至水化,以0.25%TritonX-100 的PBS 溶液破膜10 min。隨后,阻斷內(nèi)源性過氧化物酶活性10 min,并用封閉液阻斷抗體非特異性結(jié)合1 h。將切片與p-p38 或p38 抗體在4 ℃下孵育過夜,然后與酶標(biāo)二抗孵育1 h。最后使用二氨基聯(lián)苯胺(DAB)試劑盒和蘇木素對樣本進(jìn)行染色,然后在鏡下觀察并拍照。
2.9統(tǒng)計學(xué)方法 采用SPSS 26.0 統(tǒng)計軟件對數(shù)據(jù)進(jìn)行分析。計量資料服從正態(tài)分布以(±s)表示,多組間體質(zhì)量變化和免疫組化陽性率比較采用單因素方差分析;不符合正態(tài)分布的數(shù)據(jù)用[M(P25,P75)]表示,多組間DAI 評分比較采用秩和檢驗進(jìn)行分析。P<0.05 為差異具有統(tǒng)計學(xué)意義。
3 結(jié) 果
3.1新橙皮苷治療UC 的潛在作用靶點 由Gene-Cards 數(shù)據(jù)庫和DisGenet 數(shù)據(jù)庫檢索獲得2 374 個UC 疾病作用靶點,TCMSP、Swiss Target Prediction、TCMIP、SymMap、BATMAN-TCM 數(shù)據(jù)庫檢索合計獲取101 個新橙皮苷作用靶點。將新橙皮苷潛在蛋白靶點與UC 相關(guān)疾病靶點相映射,二者交集獲得51 個新橙皮苷治療UC 的潛在靶點,見圖1。
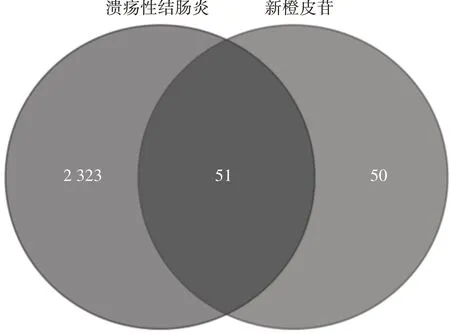
圖1 新橙皮苷治療UC 的潛在靶點
3.2GO 功能富集分析 采用DAVID 數(shù)據(jù)庫對新橙皮苷治療UC 的潛在靶點進(jìn)行GO 功能富集分析,獲得50 個涉及生物過程(biological process,BP),包括對外源性刺激的反應(yīng)、膠原分解代謝過程、細(xì)胞外基質(zhì)分解、蛋白水解、基因表達(dá)的負(fù)調(diào)控、環(huán)氧合酶途徑等,見圖2;20 個細(xì)胞組分(cellular component,CC),包括細(xì)胞外基質(zhì)、細(xì)胞外間隙、大分子復(fù)合物、外泌體、細(xì)胞質(zhì)膜等,見圖3;42 個分子功能(molecular function,MF),包括內(nèi)肽酶活性、金屬內(nèi)肽酶活性、絲氨酸內(nèi)肽酶活性、酶結(jié)合、相同蛋白質(zhì)結(jié)合、轉(zhuǎn)錄共激活因子結(jié)合等。見圖4。
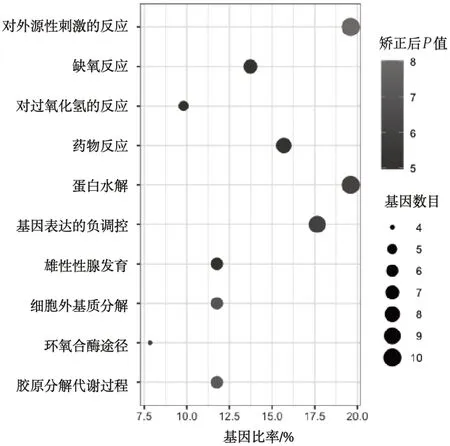
圖2 新橙皮苷生物過程分析圖
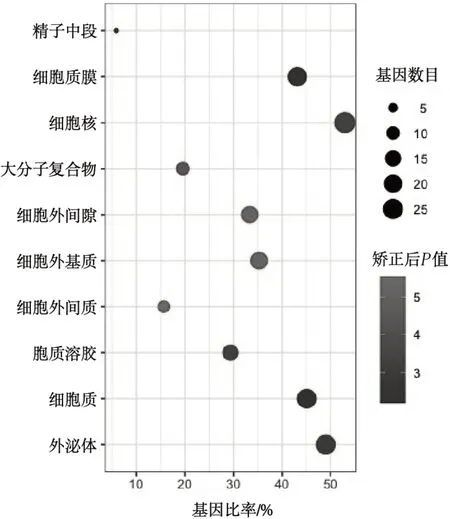
圖3 新橙皮苷細(xì)胞組分分析圖
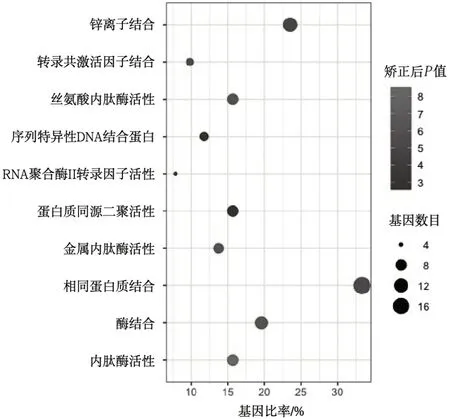
圖4 新橙皮苷分子功能分析圖
3.3KEGG 通路分析 使用DAVID 數(shù)據(jù)庫對潛在靶點進(jìn)行KEGG 通路分析,得到66 條通路,根據(jù)富集的基因數(shù)的多少進(jìn)行排序,整理出排名前20 名,繪制氣泡圖。這些交潛在靶點主要富集的通路包括MAPK 信號通路、癌癥的發(fā)病途徑、化學(xué)致癌-活性氧、內(nèi)分泌耐藥、雌激素信號通路、糖尿病并發(fā)癥的AGE-RAGE 通路、IL-17 信號通路等。見圖5。
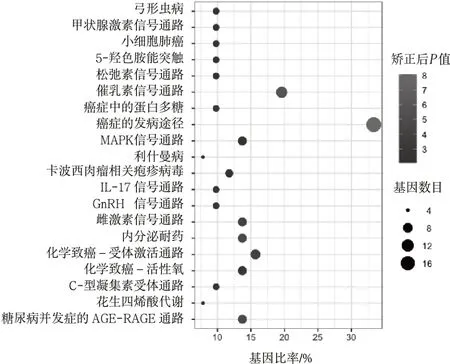
圖5 潛在靶點KEGG 信號通路富集分析結(jié)果
3.4潛在靶點PPI 網(wǎng)絡(luò)的構(gòu)建與分析 STRING 數(shù)據(jù)庫分析新橙皮苷治療UC 的潛在靶點,構(gòu)建獲取50 個節(jié)點,172 條節(jié)點連接線的蛋白互作PPI 網(wǎng)絡(luò)。Cytoscape 3.7.2 軟件繪制PPI 網(wǎng)絡(luò)圖,節(jié)點平均度值為10.244 897 96,接近中心性平均值為0.515 360 558,介數(shù)中心度平均值為0.021 421 335。其中,有19 個節(jié)點度值>平均數(shù),包括:絲裂原激活蛋白激酶14(MAPK14;p38)、白蛋白(ALB)、環(huán)狀素受體1(ESR1)、纖維連接蛋白1(FN1)、胱天蛋白酶3(CASP3)、環(huán)氧合酶2(PTGS2)、成纖維細(xì)胞生長因子2(FGF2)、干擾素(IFNG)、前列腺素-內(nèi)過氧化物合酶2(PTGS2)、胱天蛋白酶1(CASP1)等,以上節(jié)點為新橙皮苷治療UC 的核心靶點。見圖6。
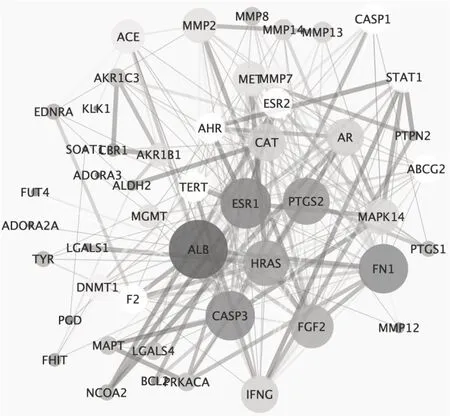
圖6 新橙皮苷治療UC 潛在靶點蛋白PPI 互作圖
3.5不同劑量新橙皮苷對UC 小鼠體質(zhì)量的影響 為進(jìn)一步驗證網(wǎng)絡(luò)藥理學(xué)的分析結(jié)果,本實驗采用不同劑量新橙皮苷干預(yù)UC 模型小鼠,初步分析新橙皮苷的藥效和作用機制。結(jié)果表明,與對照組相比,模型組在服用DSS 后體質(zhì)量出現(xiàn)顯著下降(P<0.05);然而與模型組相比,低、中、高劑量干預(yù)后,體質(zhì)量都出現(xiàn)顯著升高(P<0.05)。見圖7。
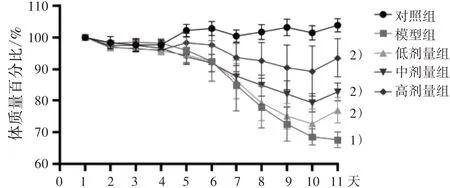
圖7 新橙皮苷干預(yù)對UC 小鼠體質(zhì)量的影響
3.6不同劑量新橙皮苷對UC 小鼠DAI 評分的影響 5 組小鼠的DAI 評分顯示,在第11 天時,對照組的小鼠DAI 評分為0;與對照組相比,模型組在服用DSS 后DAI 評分顯著上升(P<0.05);與模型組相比,低、中、高劑量新橙皮苷干預(yù)都能顯著降低DAI 評分(P<0.05)。見圖8。
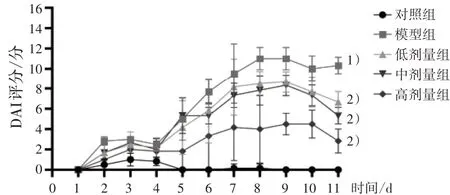
圖8 新橙皮苷干預(yù)對UC 小鼠DAI 評分的影響
3.7不同劑量新橙皮苷對UC 小鼠結(jié)腸組織中pp38、p38 蛋白的影響 KEGG 富集到的關(guān)鍵通路MAPK 通路中重要組成部分p38(MAPK14)同樣在的PPI 蛋白互作網(wǎng)絡(luò)中富集到,結(jié)合圖5 和圖6 的分析結(jié)果,對排分靠前的MAPK 通路關(guān)鍵蛋白pp38 和p38 進(jìn)行驗證分析。結(jié)果顯示:與對照組比較,模型組小鼠的結(jié)腸組織蛋白中p-p38 蛋白的表達(dá)水平顯著升高(P<0.05),p38 蛋白表達(dá)水平差異無統(tǒng)計學(xué)意義(P>0.05)。與模型組比較,低、中、高劑量組小鼠結(jié)腸組織蛋白p-p38蛋白的表達(dá)水平均顯著降低(P<0.05),p38 蛋白表達(dá)水平差異無統(tǒng)計學(xué)意義(P>0.05)。見圖9—12。
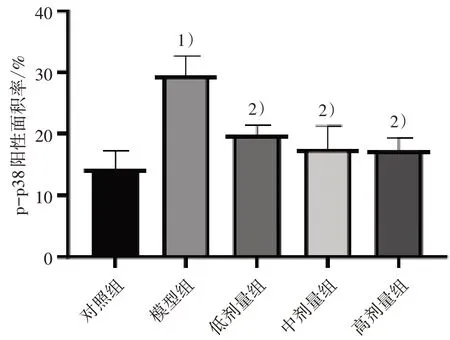
圖9 5 組結(jié)腸組織p-p38 蛋白陽性面積率比較

圖10 5 組結(jié)腸組織p-p38 蛋白表達(dá)(×400)

圖11 5 組結(jié)腸組織p38 蛋白表達(dá)(×400)
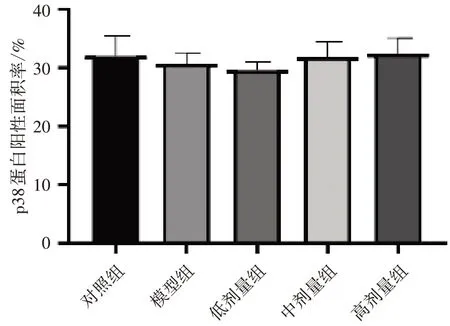
圖12 5 組結(jié)腸組織p38 蛋白陽性面積率比較
4 討 論
先前的研究發(fā)現(xiàn),新橙皮苷可通過降低結(jié)腸組織中促炎因子TNF-α、IL-6、IL-1β 的表達(dá)水平來發(fā)揮其對UC 的保護(hù)作用[5]。本研究通過TCMSP、Swiss Target Prediction、TCMIP、SymMap、BATMANTCM 數(shù)據(jù)庫進(jìn)行新橙皮苷靶點的挖掘,并通過Dis-Genet 和GeneCards 數(shù)據(jù)庫進(jìn)行UC 靶點的挖掘,篩選并確定新橙皮苷可能作用于UC的潛在靶點51個。通過KEGG 通路分析,富集到MAPK 信號通路、IL-17 信號通路、化學(xué)致癌-活性氧通路等信號通路。MAPK 信號通路的激活主要涉及JNK、ERK 和p38的磷酸化,進(jìn)一步激活細(xì)胞核中的轉(zhuǎn)錄信號從而在細(xì)胞增殖與分化、凋亡、調(diào)節(jié)炎癥等生理和病理過程中發(fā)揮重要作用[12]。林雄[13]發(fā)現(xiàn)MAPK通路的激活可以促進(jìn)NF-κB p65 的磷酸化,上調(diào)炎癥細(xì)胞因子如TNF-α、IL-6 和IL-1β 的表達(dá)水平,通過蒼術(shù)醇提物抑制MAPK 通路的激活可改善UC 癥狀。IL-17 是一種促炎因子,在多種細(xì)胞中都有表達(dá),通過促進(jìn)TNF-α、IL-6 等炎性因子的釋放,發(fā)揮擴(kuò)大炎癥等功能[14]。馬杰等[15]研究結(jié)果表明,黃芩多糖可通過抑制IL-17 的表達(dá)發(fā)揮對UC 的治療作用。活性氧(reactive oxygen species,ROS)的過量累積導(dǎo)致細(xì)胞膜通透性增加,促進(jìn)炎癥反應(yīng)[16]。研究發(fā)現(xiàn)在UC 腸道黏膜中會過量生成ROS,促進(jìn)組織損傷[17]。這些研究進(jìn)一步佐證了新橙皮苷可能通過調(diào)控MAPK 信號通路、IL-17 信號通路、活性氧相關(guān)通路來發(fā)揮其對潰瘍性結(jié)腸炎的保護(hù)作用。
本研究通過構(gòu)建新橙皮苷治療UC 的潛在作用靶點PPI 網(wǎng)絡(luò)圖,發(fā)現(xiàn)MAPK14(p38)、CASP1、PTGS2 等靶點可能參與新橙皮苷治療UC 的作用機制。陳賽等[18]研究證實白芍七物顆粒干預(yù)UC 小鼠,能降低p38 的磷酸化水平,通過阻斷NOXs-ROS-p38 信號通路的傳導(dǎo),緩解UC 小鼠結(jié)腸組織的炎癥反應(yīng);EPSTEIN 等[19]研究證實,姜黃素可通過阻斷p38 MAPK 信號通路,減輕結(jié)腸黏膜組織的白細(xì)胞浸潤,有效治療DSS 誘導(dǎo)的UC 小鼠的結(jié)腸炎性病變。Caspase-1 是介導(dǎo)細(xì)胞焦亡所依賴的核心蛋白,它的激活是細(xì)胞焦亡經(jīng)典途徑的核心,屬于免疫系統(tǒng)的重要組成部分[20]。研究表明,人炎性腸組織中Caspase-1 活化水平比正常腸組織中活化水平更高[21]。PTGS2 在調(diào)控免疫應(yīng)答發(fā)揮重要作用,主要表達(dá)在單核細(xì)胞和腸上皮細(xì)胞中,在UC發(fā)展過程中對結(jié)腸黏膜愈合有促進(jìn)作用[22]。這些研究提示新橙皮苷可能通過MAPK14(p38)、CASP1、PTGS2 等關(guān)鍵靶點的表達(dá)水平,調(diào)控相關(guān)免疫應(yīng)答,治療DSS 誘導(dǎo)的UC 小鼠的結(jié)腸炎性病變。
UC 的主要臨床表現(xiàn)是腹痛、腹瀉、黏液膿血便等,DSS 為經(jīng)典的UC 造模方法,利用DAI 評分能反映該模型中UC 體質(zhì)量下降、腹瀉、黏液膿血便情況。本研究體內(nèi)實驗中DSS 造模后的UC 小鼠出現(xiàn)了明顯的DAI 評分升高和體質(zhì)量下降,而新橙皮苷可顯著降低DSS 誘導(dǎo)的UC 小鼠體質(zhì)量下降和DAI評分升高,結(jié)果表明新橙皮苷可緩解DSS 誘導(dǎo)的UC 小鼠的UC 體質(zhì)量下降、腹瀉、黏液膿血便癥狀。再以該模型驗證網(wǎng)絡(luò)藥理學(xué)分析富集出的MAPK14(p38)關(guān)鍵靶點,通過體內(nèi)實驗的驗證,可得出以下結(jié)果:在DSS 誘導(dǎo)的UC 小鼠模型中,新橙皮苷干預(yù)能夠顯著逆轉(zhuǎn)模型組小鼠結(jié)腸組織中p38 蛋白磷酸化水平的升高,提示新橙皮苷對UC 的治療作用可能是通過發(fā)揮對p38 MPAK 通路的抑制而實現(xiàn)。
綜上,本研究通過網(wǎng)絡(luò)藥理學(xué)對新橙皮苷治療UC 的相關(guān)分子機制進(jìn)行探討。采用體內(nèi)實驗對新橙皮苷調(diào)控p38 MPAK 信號通路,進(jìn)而起到抑制UC 的發(fā)生、發(fā)展進(jìn)行驗證,為臨床中研發(fā)防治UC的藥物提供了有效的依據(jù)。不足之處在于,研究中僅對p38 MPAK 信號通路進(jìn)行了探索驗證,并未對該通路上下游相關(guān)通路蛋白進(jìn)一步分析,計劃在下一步的實驗中進(jìn)行探究。

