連續繼代培養下培養基降本措施對甘薯組培苗生長的影響
趙元增 王永剛 陳丹

摘要:為降低甘薯(Dioscorea esculenta (Lour.) Burkill)組培苗快繁培養的生產成本,提高工廠化育苗的經濟效益,在MS基本培養基的基礎上,通過簡化培養基組成、以自來水代替去離子水、以白砂糖代替蔗糖等降本措施,研究了連續繼代培養下培養基組成簡化或替代措施對甘薯組培苗生長的影響。結果表明,無論是初代培養還是繼代培養,以白砂糖代替蔗糖,對甘薯組培苗生長無顯著影響,但去除培養基中的微量元素、有機物質或以自來水代替去離子水,均對組培苗產生不利影響,導致株高降低、增殖系數減小、根系生長變差,且這種不利影響在經歷長時間的繼代培養后進一步加劇,組培苗生長更差。因此,在甘薯組培苗的工廠化生產中,可以用白砂糖代替蔗糖,降低組培生產成本,而其他降本措施不宜采用。
關鍵詞:甘薯(Dioscorea esculenta (Lour.) Burkill);組培苗;離體快繁;降本措施;連續繼代培養
中圖分類號:S531? ? ? ? ?文獻標識碼:A
文章編號:0439-8114(2024)04-0179-06
Effect of medium cost reduction measures on the growth of sweet potato tissue culture seedlings under continuous subculture
Abstract: In order to reduce the production cost of rapid propagation of sweet potato (Dioscorea esculenta (Lour.) Burgill) tissue culture seedlings and improve the economic benefits of factory seedling cultivation,on the basis of MS basic culture medium, the effects of simplifying or replacing the composition of culture medium on the growth of sweet potato tissue culture seedlings under continuous subculture were studied through cost reduction measures such as simplifying the composition of culture medium, replacing deionized water with tap water, and replacing sucrose with granulated sugar. The results showed that using white sugar instead of sucrose had no significant effect on the growth of sweet potato tissue cultured seedlings, whether in primary or secondary culture. However, removing trace elements and organic matter from the culture medium, or using tap water instead of deionized water, all had adverse effects on tissue culture seedlings, leading to a decrease in plant height, a decrease in proliferation coefficient, and poorer root growth,and this adverse effect was further exacerbated after prolonged subculture, resulting in poorer growth of tissue cultured seedlings. Therefore, in the factory production of sweet potato tissue culture seedlings, white sugar could be used instead of sucrose to reduce the production cost of tissue culture, while other cost reduction measures were not suitable.
Key words: sweet potato(Dioscorea esculenta (Lour.) Burgill); tissue culture seedlings; in vitro rapid propagation; cost reduction measures; continuous subculture
甘薯(Dioscorea esculenta (Lour.) Burkill)為無性繁殖作物,在長期種植與連年留種過程中會因病毒感染、逐年積累和世代相傳而使病情逐代加重,最終導致甘薯種性退化、產量降低、品質下降而失去應用價值[1,2]。通過組織培養技術培育脫毒甘薯苗并進行規模化擴繁仍是目前國內外防治甘薯病毒病、提高甘薯產量與品質較有效的方法[3-5],但其偏高的生產成本是制約工廠化生產的瓶頸,不僅影響甘薯脫毒原原種的生產與供應,而且直接決定種苗的價格、用戶的經濟承受能力、脫毒甘薯的普及程度和生產單位的經濟效益[6]。
在現代工廠化脫毒苗的生產中,脫毒苗的組培擴繁是首要環節,也是重要的組成部分,在保證種苗質量的前提下,降低組培環節的生產成本是種苗生產技術體系中降本增效的重要措施[7]。為此,許多研究采用優化培養基配方[8-10]、簡化培養基組成(如減少或去除培養基中的微量元素或有機成分)[11,12]、應用廉價的替代品(如以自來水或白開水代替去離子水,以白砂糖代替蔗糖等降本措施)[13-15],應用到草莓[7,16]、甘薯[6,11]、馬鈴薯[17-19]、葡萄[20]、石竹[21]等植物的組培快繁中,在不降低組培苗質量的情況下,明確了這些降本措施的有效性。但這些研究普遍存在2個方面的問題,第一,試驗材料來源于標準培養基,在培養基組成簡化或替代的培養基上培養會受到前代培養基的影響;第二,試驗結論來自1代培養的結果,培養周期短。在工廠化種苗生產中,脫毒苗擴繁是一個反復繼代且長期進行的增殖過程,培養基的簡化或替代措施必須在多次繼代和長期培養的情況下保持有效。為此,本研究在借鑒前人研究的基礎上,以經簡化或替代處理的培養基為甘薯脫毒苗擴繁培養基,采用對應處理連續繼代、長期培養的方式,探討培養基組成簡化和替代處理措施對甘薯組培苗擴繁的影響。
1 材料與方法
1.1 試驗材料
甘薯品種龍薯9號、洛薯13號的脫毒組培苗,擴繁培養基為MS+0.1 mg/L IBA+6.0 g/L瓊脂粉+30 g/L蔗糖。
1.2 試驗方法
1.2.1 培養基 在MS基本培養基的基礎上,通過去除或替代某些成分配制A~E 5種不同的培養基。A(對照處理):MS+蔗糖3%;B:MS+蔗糖3%(去除微量元素);C:MS+蔗糖3%(去除有機物質);D:MS+白砂糖3%(以白砂糖代替蔗糖);E:MS+蔗糖3%(以自來水代替去離子水)。以上培養基均添加0.1 mg/L IBA,6.0 g/L瓊脂粉,pH調節為5.8,分裝量30 mL/瓶。
配制培養基所用的量筒、燒杯、培養瓶等器皿在洗刷干凈后,用去離子水漂洗3遍。以自來水代替去離子水是指除母液用去離子水配制外,溶解瓊脂粉與定容均采用自來水,而其他處理全部為去離子水。白砂糖為南京甘汁園股份有限公司市售食糖;其他試劑均為上海阿拉丁生化科技股份有限公司生產的分析純。
1.2.2 接種方法 初代培養:選取來源、培養周期一致,且主莖粗壯、長勢均一的龍薯9號與洛薯13號的組培苗,將其切成至少帶有1個腋芽的長度為1.5~2.0 cm的莖段,接種到A~E培養基中。每個處理接種5瓶,每瓶6個莖段,重復3次。
繼代培養:初代培養的組培苗在完成結果調查后,將同一處理的組培苗按照初代培養時的接種方法,將其切成1.5~2.0 cm的莖段,接種到對應的新配制A~E培養基中(培養基組成不變),即A處理初代培養的組培苗莖段接種到新配制的A培養基中,B處理的莖段接種B培養基,依次類推。
1.2.3 培養條件 溫度(25±1)℃,光照度2 000~? ? 3 000 lx,光照周期12 h/d。
1.2.4 數據統計 在1代的培養周期內,進行2次結果調查:接種莖段培養20 d后調查各處理的成苗率、組培苗株高、根系生長狀況等;接種莖段培養60 d后調查各處理的單瓶成苗數、增殖系數、平均株高等。在每代培養結束時,將組培苗切成1.5~2.0 cm的莖段,統計每個處理截取的莖段數,據此計算增殖系數,計算公式如下。
K=a/b? (1)
式中,K為增殖系數;a為培養結束后每個處理的莖段數;b為該處理接種的莖段數。
采用SPSS 20.0軟件進行數據處理與單因素方差分析。
2 結果與分析
2.1 培養基組成簡化和替代措施對甘薯組培苗初代培養的影響
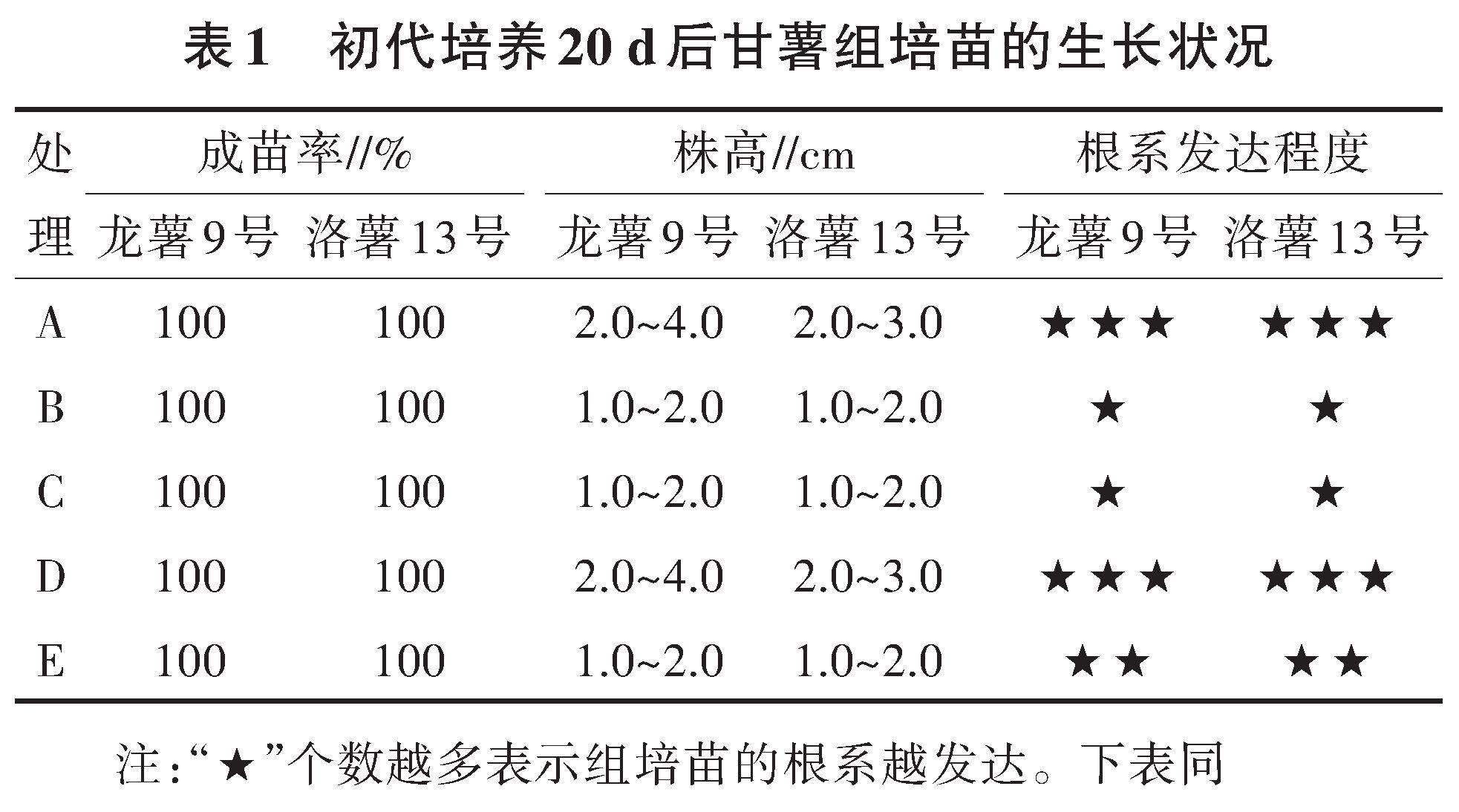
2.1.1 初代培養20 d后甘薯組培苗的性狀差異 初代培養20 d后,所有處理的接種莖段都已萌發成苗,成苗率均達100%,各處理的萌芽莖葉生長狀況差異不大,不同處理間的差異主要表現在根系上(表1,圖1)。無論是龍薯9號還是洛薯13號,A、D處理中甘薯組培苗形成的根系發達,不僅根數多,而且初生根上形成的須根多而長,根在瓶底邊緣纏繞成束,株間根系交錯纏繞形成密集的根系網絡;其次是E處理,組培苗形成的根系較發達,雖然在瓶底邊緣纏繞成束,但瓶底中央的根系稀疏,沒有形成密集交叉的根系網絡;與A、D、E處理相比,B、C處理形成的根數明顯減少,根短,根雖然在株間重疊,但根系稀疏,沒有形成密集的根系網絡。B、C處理的根系也存在細微差異,B處理的初生根數量少,其上形成的須根少且短,而C處理形成的初生根較多,其上形成的須根多而長。
綜上,在初代培養的早期,與對照(A處理)相比,去除培養基中的微量元素、有機物質或以自來水代替去離子水,主要影響組培苗根的分化和伸長,而對組培苗莖葉的生長影響較小。以白砂糖代替蔗糖,對組培苗的生長無明顯影響。2個甘薯品種的生長狀況呈相似規律,不存在基因型差異。
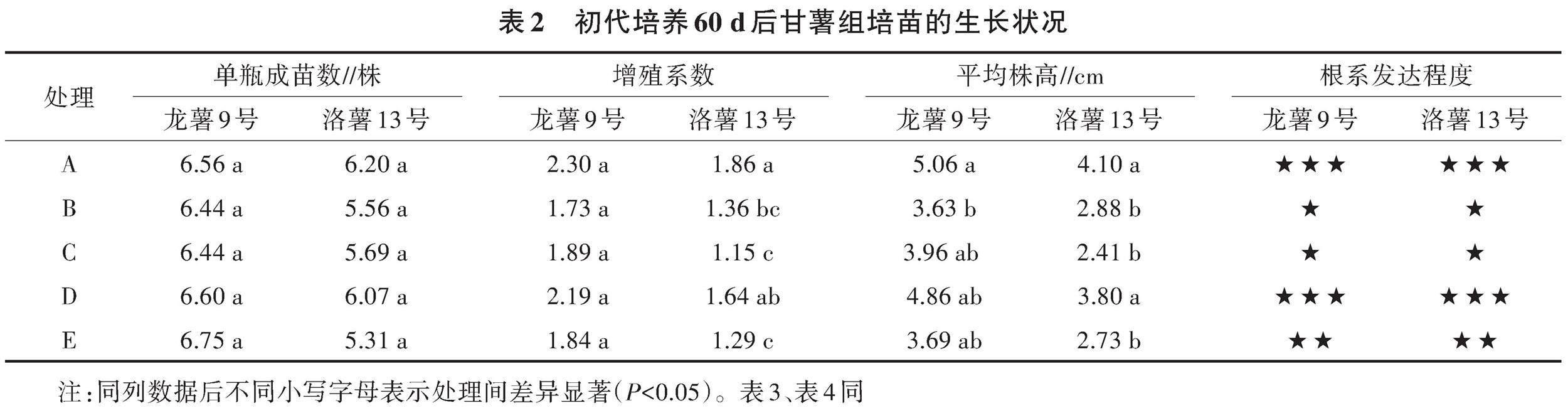
2.1.2 初代培養60 d后甘薯組培苗的性狀差異 經過60 d的持續培養,龍薯9號、洛薯13號組培苗在各處理間的根系特征與培養20 d后的特征基本一致(表2),即A、D處理的根系發達,其次是E處理,根系較發達,B、C處理的根系不發達。在A、D處理中,植株形成的根系交錯纏繞布滿瓶底,不僅根數多且根細長,形成發達的根系網絡。與A、D處理相比,B、C、E處理形成的根數量明顯減少,多數植株僅有3~5條/株,初生根上形成的須根較短,根系稀疏,沒有形成發達的根系網絡。值得注意的是,在去除微量元素的B處理中,形成的根顏色偏黃,根尖出現棕褐色壞死,黃化枯死的葉片數也高于其他處理,表現出明顯的缺素癥狀。初代培養60 d后,洛薯13號組培苗各處理的莖葉生長狀況存在明顯區別, A、D處理的植株生長狀況較好,平均株高為4.10 cm,顯著高于其他處理;而在培養基簡化處理的B、C處理和以自來水代替去離子水的E處理中,大多數植株低矮,平均株高均低于3.00 cm。洛薯13號各處理的增殖系數由大到小依次為A、D、B、E、C,A、D處理的增殖系數顯著高于C、E處理;B、C、E處理的增殖系數較小,處理間無顯著差異。
龍薯9號組培苗的單瓶成苗數、增殖系數在各處理間無顯著差異,B、C、E處理中組培苗平均株高、增殖系數、根系發達程度明顯低于A、D處理。龍薯9號組培苗的單瓶成苗數、增殖系數和平均株高均高于洛薯13號。
綜上,在甘薯組培苗的擴繁培養中,可以用白砂糖代替培養基中的蔗糖,組培苗生長狀況與對照無顯著差異。但去除培養基中的微量元素、有機物質或以自來水代替去離子水的降本措施,對甘薯組培苗的生長均產生不利影響,導致植株變矮、增殖系數降低、根系生長受到抑制,特別是去除培養基中的微量元素,對組培苗生長的不利影響更大。
2.2 培養基組成簡化和替代措施對甘薯組培苗繼代培養的影響
2.2.1 繼代培養20 d后甘薯組培苗的性狀差異 由表3可知,組培苗繼代培養20 d后,A、D處理的組培苗根系與株高表現較好,其次是E處理,B、C處理的表現較差;2個甘薯品種的成苗率在初代培養20 d后均達100%,但在繼代培養20 d后,2個甘薯品種的成苗率降低,其中B處理的成苗率顯著低于A、C、D處理。由圖2可知,與對照和初代培養20 d后的組培苗相比,繼代培養20 d后龍薯9號B處理的組培苗植株低矮、葉片稀少,且形成的葉片小而狹長。
2.2.2 繼代培養60 d后甘薯組培苗的性狀差異 由表4可知,在繼代培養60 d后,洛薯13號組培苗在A、D、E處理中茁壯生長,平均株高均高于3.40 cm。A、D、E處理中洛薯13號的增殖系數較高且處理間差異不顯著。B、C處理中洛薯13號組培苗節間長度短、植株低矮、葉片較小,其中B處理的增殖系數顯著低于對照A,C處理的增殖系數顯著低于A、D、E處理。A、D、E處理中洛薯13號組培苗的根數多且長,須根發達,株間根系相互纏繞布滿瓶底,形成異常發達的根系網絡;B處理形成的根粗壯,但根數少,單株生根數3~5條,須根少且短,根系稀疏不發達;C處理的根細長,根數多,單株生根數4~7條,須根多而細長。此外,與其他處理形成的青綠色根不同,B處理的根呈棕黃色,多數根上出現棕褐色或黑褐色的節點,或根尖2~3 mm呈棕褐色。
龍薯9號組培苗的單瓶成苗數、增殖系數、平均株高與根系發達程度在各處理間均存在差異,且處理間的差異表現與洛薯13號相似。A、D處理中龍薯9號組培苗生長表現較好,E處理次之,B、C處理表現較差。E處理中龍薯9號組培苗平均株高、增殖系數均顯著低于A對照(處理)。
綜上,在甘薯組培苗擴繁中,去除培養基中的微量元素、有機物質或以自來水代替去離子水的降本措施,對苗的莖葉生長和根系形成均產生不利影響。以白砂糖代替蔗糖,對組培苗的生長無不良影響,可降低組培苗生產成本。
2.3 連續繼代培養對甘薯組培苗生長的影響
無論是初代培養還是繼代培養,均表現為A、D處理的甘薯組培苗綜合生長表現較好,E處理次之,B、C處理表現較差(表2、表4,圖3、圖4)。
初代培養60 d后,龍薯9號組培苗單瓶成苗數與增殖系數在各處理間均不存在顯著差異(表2),但在繼代培養60 d后,B處理中龍薯9號組培苗單瓶成苗數顯著低于A、D處理;B、C處理中龍薯9號組培苗增殖系數顯著低于A、D處理,E處理的增殖系數顯著低于A處理(表4)。與初代培養相比,龍薯9號繼代培養60 d后的組培苗株高、葉片的形態大小在處理間的差異進一步加大(表2、表4、圖3),相較初代培養,繼代培養結束時B、C、E處理的組培苗節間更短、株高更低,與A、D處理的株高差距呈增大的趨勢,特別是B處理的組培苗,不僅植株低矮,而且葉片小而狹,尤其是植株中上部葉片更細小,葉長寬僅有2~3 mm×1~2 mm,葉面出現黃色褪綠斑紋,甚至整片葉出現黃褐色。
洛薯13號組培苗的生長狀況在初代培養與繼代培養間也存在差異,特別是B、C處理的組培苗,繼代培養的性狀表現不及初代培養。由表2、表4、圖4可知,初代培養60 d后洛薯13號單瓶成苗數在各處理間無顯著差異,但繼代培養60 d后B處理的單瓶成苗數卻顯著低于對照處理;B、C處理中初代培養的組培苗葉片形態大小正常,株高較高,而繼代培養中B、C處理的組培苗葉片相比其他處理明顯變小,株高較低。
綜上,與初代培養相比,去除培養基中的微量元素、有機物質或以自來水代替去離子水,在經歷長時間的初代培養、繼代培養后,組培苗的綜合性狀進一步變差。
3 小結與討論
在植物組織培養中,培養基中的蔗糖、去離子水的用量較大,培養基成本較高[7,15],在不影響培養效果的前提下,若能采用相對廉價的替代物,可顯著降低培養基的配制成本[22]。作為培養基中必不可少的成分,植物組培中一般用分析純蔗糖作為碳源和滲透調節物,白砂糖的主要成分也是蔗糖,但通常情況下蔗糖的市場價為白砂糖的3倍,以白砂糖代替蔗糖配制培養基,可顯著降低培養基的制作成本[15]。本研究結果表明,在甘薯組培苗擴繁中,以白砂糖代替蔗糖,組培苗的成苗率、平均株高、增殖系數、根系發達程度等均與對照處理無顯著差異,即使經歷120 d的初代培養、繼代培養,白砂糖的培養效果與蔗糖無顯著差異。因此,在甘薯組培苗的工廠化快繁中,白砂糖可替代蔗糖作為組培苗快繁的培養基糖源,這與閆明明等[6]、姜秀芳等[23]的研究結果一致。為避免水中離子的干擾,植物組培研究中一般用去離子水配制培養基,但制備去離子水耗電費水,成本高。有研究表明,用白開水或自來水代替去離子水用于植物組培,對組培苗的增殖和生長無不良影響[6,14],但也有研究認為自來水代替去離子水會導致組培苗生長變差,增殖倍數降低[15]。本研究中,龍薯9號2次培養的結果都表明,用自來水代替去離子水,導致甘薯組培苗株高降低,根系變差,初代培養的增殖系數與對照無顯著差異,但繼代培養的增殖系數顯著低于對照;洛薯13號組培苗在初代培養中E處理的平均株高、增殖系數都顯著低于對照,但繼代培養中組培苗的平均株高、增殖系數與對照無顯著差異。結果表明,用自來水配制培養基,試驗的重復性較差,造成這種差異的原因可能與不同批次的自來水水質有關。與去離子水相比,自來水中的離子雜質多,不同時間接取的自來水中離子雜質存在差異[24]。
在一些植物的組培快繁中,微量元素可以被部分或全部去除,對培養物的生長并沒有顯著的影響[25],對于一些痕跡量的微量元素,可通過瓊脂粉或其他試劑得到補充[26]。但本研究的結果表明,去除培養基中的微量元素,在初代培養時已經顯著影響甘薯組培苗的生長,導致株高降低、增殖系數減小、根系生長變差,在經歷連續繼代培養后,這種不利影響會進一步加劇。因此,在甘薯組培快繁中,不能去除培養基中的微量元素,特別是在長期的規模化生產中更是如此。
一般認為,大多數培養的細胞都能合成所有必需的維生素和部分氨基酸,但合成量卻難以滿足細胞分裂分化的需要[27]。本研究結果表明,去除培養基中的有機物質,無論初代培養還是繼代培養,均對甘薯組培苗的生長不利,導致組培苗整體生長狀況變差。也有研究表明,去除培養基中的有機成分,對組培苗的生長無顯著影響[25,28]。因此,對于植物快繁培養時培養基中有機物質保留與否,應該與植物種類和外植體類型有關,不能一概而論。
不同基因型甘薯組培苗對培養基成分有較強的選擇性,高淀粉型甘薯品種成苗率低、莖段增殖系數小,而含水量較大的鮮食型甘薯品種,成苗率較高、莖段增殖系數大[29,30]。本研究采用了高淀粉型品種洛薯13號和鮮食型品種龍薯9號,2次培養的結果都表明,龍薯9號的株高與增殖系數均高于同等培養條件下的洛薯13號,這與前人的研究結果[29,30]一致。初代培養與繼代培養相比,2個甘薯品種的組培苗在不同處理間的生長差異,均是繼代培養各處理間的差異比初代培養更大,這表明培養基中營養元素的匱乏,如微量元素的缺失,在經歷連續的長期培養后會進一步加劇,從而對組培苗的生長不利。值得注意的是,在同樣的不利培養條件下(如去除培養基中的微量元素),2個甘薯品種在經歷長期的繼代培養后,組培苗生長狀況也存在差異:龍薯9號B處理的組培苗葉片顯著變小、畸形、黃化,根尖變褐;而洛薯13號B處理的組培苗雖然葉片變小,但變化幅度相對較小。造成這種差異的原因,可能與甘薯類型有關,在一定條件下,洛薯13號對不利培養條件的耐受性可能比龍薯9號更強。
參考文獻:
[1] 趙永強,張成玲,孫厚俊,等.甘薯病毒病復合體(SPVD)對甘薯產量的影響[J].西南農業學報,2012,25(3):909-911.
[2] 董 芳,張超凡.甘薯病毒病防控措施研究進展與展望[J].作物雜志,2016(3):6-11.
[3] MALIOGKA V I,SKIADA F G,ELEFTHERIOU E P,et al. Elimination of a new ampelovirus(GLRaV-Pr) and grapevine rupestris stem pitting associated virus (GRSPaV) from two Vitis vinifera cultivars combining in vitro thermotherapy with shoot tip culture[J].Scientia horticulturae,2009,123(2):280-282.
[4] RETHEESH S T,BHAT A I. Simultaneous elimination of cucumber mosaic virus and cymbidium mosaic virus infecting Vanilla planifolia through meristem culture[J].Crop protection, 2010,29(10):1214-1217.
[5] 遲惠榮,毛碧增.植物病毒檢測及脫毒方法的研究進展[J].生物技術通報,2017,33(8):26-33.
[6] 閆明明,徐碧蓮,吳 瓊,等.高效低耗的甘薯脫毒苗快繁技術研究[J].南京農業大學學報,2015,38(4):689-694.
[7] 張春芬,鄧 舒,聶園軍,等.草莓脫毒組培苗低成本快繁技術研究[J].山西農業科學,2019,47(3):379-382.
[8] 孟德璇,孫周平.6-BA和NAA對不同甘薯品種莖尖培養的影響[J].雜糧作物,2010,30(4):286-287.
[9] 阮先樂,陳 璨.甘薯莖尖分生組織培養及快繁技術的研究[J].周口師范學院學報,2015,32(2):94-96.
[10] 閆明明,陳秋駿,唐 敏,等.不同濃度的激素組合和有機物組合對甘薯脫毒苗快繁的影響[J].作物雜志,2018(2):68-72.
[11] 黃 萍,顏 謙,雷尊國,等.改變培養基成分對甘薯試管苗生長的影響[J].種子,2008,27(9):84-86.
[12] 宋鵬慧,王春艷,梁文衛,等. 不同比例MS培養基對脫毒馬鈴薯快繁生長的影響[J].安徽農業科學, 2014,42(31):10853-10854.
[13] 張梅秀,魏玉杰,臧廣鵬,等.青島大花脫毒種苗快繁技術研究[J].南方農業學報,2011,42(2):128-130.
[14] 梁發輝,柴慈江,何 丹,等.降低栒子試管苗培養成本的方法研究[J].北方園藝,2013(17):107-109.
[15] 胡禮娥,劉艷梅.桔梗莖段組織培養降低成本及成本核算初步研究[J].江西農業,2021,39(4):608-613.
[16] 張利英,李賀年,張 鑫,等.草莓莖尖組培技術的簡化和降低成本試驗[J].北方園藝,2010(11):147-148.
[17] 張春華,廉美蘭,樸炫春.植物組織培養中降低培養基成本的研究[J].延邊大學農學學報,2005,27(4):261-264.
[18] 劉君馨,溫 靜.馬鈴薯組培苗簡易培養繁殖研究[J].河北北方學院學報(自然科學版),2011,27(3):56-58.
[19] 頡瑞霞,張小川,王效瑜,等.白糖對馬鈴薯試管薯誘導的影響[J].分子植物育種,2015,13(8):1766-1770.
[20] 張肖凌,張梅秀,李哲琴,等.不同水質制作培養基對葡萄試管苗生長發育的影響[J].現代農業科學,2009,16(9):30-31.
[21] 周四敏,王樹彥,徐 軍.黑玫瑰石竹組培快繁中不同影響因子的優化[J].北方農業學報,2016,44(2):23-28.
[22] 郝智勇.馬鈴薯脫毒快繁中的培養基元素組成及成本[J].安徽農學通報,2017,23(1):25,87.
[23] 姜秀芳,賈朝陽,王生軍,等.甘薯莖尖分化及試管苗快繁培養基的創新[J].中國園藝文摘,2014(7):34-35.
[24] 楊 濤,錢 蕾,呂永桂,等.豐花月季低成本組織培養快繁的研究[J].江蘇農業科學,2015,43(8):53-55.
[25] 毛堂芬,劉作易,朱國勝,等.培養基組成對環草石斛試管苗生長的影響[J].安徽農業科學,2009,37(35):17367-17368.
[26] 李友勇,李秀菊.應用生物技術[M].第二版.北京:中國農業科技出版社,2004.55-56.
[27] 柳 俊,謝從華. 植物細胞工程[M].第二版.北京:高等教育出版社,2011.83-84.
[28] 劉新濤,黃冰艷,劉文軒,等.脫毒甘薯切段快繁培養基的簡化[J].河南農業科學,1999(4):4-5.
[29] 何鳳發,王季春,張啟堂,等.甘薯莖尖脫毒與快速繁殖技術研究[J].西南農業大學學報,2002,24(6):509-511,528.
[30] 關崇梅,秦靜遠,徐志英,等.甘薯莖尖分生組織培養與快速繁殖技術研究[J].中國農學通報,2004,20(4):33,35.

