數字PCR和熒光定量PCR檢測轉基因番木瓜中外源基因拷貝數方法的建立及其應用
謝秀菊 夏啟玉 劉帥 麥賢俊 賈瑞宗 郭安平 徐志勝 李峰 孔祥義 趙輝

關鍵詞:轉基因番木瓜;拷貝數;內參基因;數字PCR;熒光定量PCR
中圖分類號:S667.9 文獻標志碼:A
番木瓜(Carica papaya L.)是世界四大熱帶、亞熱帶暢銷水果之一。番木瓜環斑病毒(Papayaringspot virus,PRSV)是危害番木瓜最嚴重的病毒,其侵染番木瓜植株后,造成番木瓜大面積減產甚至整片果園死亡。1986 年,ABEL 等[1]發現將病毒基因轉入寄主植物,可以導致寄主植物對病毒產生抗性,此后轉基因技術被應用到番木瓜的抗病育種中。第一個轉基因番木瓜品種是將夏威夷PRSV 55-1 的外殼蛋白(coat protein, CP)基因轉入Sunset 品種中[2],田間抗性表現相當良好,該轉基因品種于1997 年在夏威夷獲得商業化應用。隨后,2009 年美國弗羅里達大學的轉基因番木瓜X17-2 品系[3]也獲得商業化應用。我國的番木瓜轉基因育種是從1996 年開始的,華南農業大學研發出了抗病品系華農1 號,并且在2010 年獲得了國家頒發的番木瓜農業轉基因生物安全證書。我國臺灣中興大學的CHENG 等[4]和BAU 等[5-6]也研發出了轉基因番木瓜抗病品系16-0-1、18-2-4等。近些年來,研究人員仍在不斷進行新的番木瓜轉基因育種研究。
在轉基因植物育種研究中,外源基因整合進入受體植物基因組的拷貝數會影響外源目的基因的表達及其遺傳穩定性[7]。當外源基因以1~2 個拷貝數整合到受體基因組時,一般能夠穩定高效表達,而當外源基因以多拷貝數整合到受體基因組時,可能會出現表達水平較低甚至基因沉默,從而無法得到表現目的性狀的轉基因植株[8-9]。因此,研究人員往往會選擇單低拷貝整合的株系,然而,單低拷貝整合的轉基因株系往往需要從大量T0代植株中篩選得到。此外,純合轉基因植株的獲得,也需要從大量性狀分離的T1 代轉基因植株中篩選。因此,高效的外源基因拷貝數檢測方法對轉基因育種至關重要。
傳統的檢測轉基因植株中外源基因拷貝數的方法為Southern 雜交,該方法特異性強、靈敏度高,但其對樣品DNA 的質量和含量要求較高,且成本高,周期長,難以滿足高通量外源基因拷貝數檢測的需求。因此,亟需建立簡單、快速、高效的檢測轉基因植株中外源基因拷貝數的方法。本研究以已知外源基因為單拷貝整合的轉CP基因番木瓜為參照,篩選出番木瓜基因組中的單拷貝基因;進一步以其為內參基因,建立基于絕對定量的數字PCR 技術(digital PCR, dPCR)和熒光定量PCR技術(fluorescence quantitative PCR,qPCR)檢測轉基因番木瓜中外源基因拷貝數的方法,為轉基因番木瓜育種提供新的高通量拷貝數檢測方法。
1 材料與方法
1.1 材料
1.1.1 植物材料轉基因番木瓜株系來自中國熱帶農業科學院三亞研究院,包含:21 株轉入海南PRSV 的CP 基因的T1 代番木瓜、55 株轉入海南PRSV 的輔助成分-蛋白酶基因(HC-Pro)發夾結構的T0 代番木瓜苗和28 株轉入海南PRSV 的復制酶基因(Nib)發夾結構的T0 代番木瓜苗。
1.1.2 試劑 廣譜植物基因組DNA 快速提取試劑盒(CZ301-01)購自北京博邁德基因技術有限公司; QuantStudio? 3D 數字PCR 預混液v2、QuantStudio 3D 數字PCR 20K 芯片v2 、QuantStudio 3D 數字PCR 芯片罩蓋v2 、QuantStudio 3D 數字PCR 上樣刀片、注射器裝浸液、浸液吸頭等均購自賽默飛世爾科技(中國)有限公司;2X Q3 SYBR qPCR Master mix 購自吐露港生物科技有限公司,PCR 平蓋八排管購自Labselect 公司。引物均由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 番木瓜單拷貝內參基因的篩選及鑒定(1)番木瓜單拷貝基因的篩選及dPCR 引物與探針設計。在phytozome(https://phytozome-next.jgi.doe.gov/blast-search)網站的番木瓜基因組中,挑選出可能為單拷貝的2 個基因Cpa03g018830 和Cpa03g018770 作為候選內參基因,下載這2 個基因的DNA 序列。使用Premier 5.0 軟件設計特異性引物(F/R)與探針(P),Cpa03g018830 和Cpa03g018770 的探針5端連接VIC 熒光基團,3′端連接MGB 熒光猝滅基團,該基團散發紅色熒光。轉基因番木瓜外源基因CP 和NPTⅡ(neomycin phosphotransferase)的探針5′端連接FAM 熒光基團,3′端連接BHQ1 熒光猝滅基團,該基團散發綠色熒光。本實驗使用的所有引物及探針序列見表1。
(2)轉CP 基因番木瓜的T1代陽性植株的篩選。以T0代經過Southern 雜交驗證為單拷貝的轉CP 基因番木瓜的T1代陽性植株幼苗作為內參基因拷貝數鑒定的參照,首先通過PCR 篩選出轉CP 番木瓜的T1 代陽性植株。采集21 株轉CP 基因番木瓜的T1 代幼苗的葉片,提取其基因組DNA,通過常規PCR 篩選陽性幼苗。反應體系為:Green Master Mix 12.5 μL,CP-F1(10 μmol/L)1 μL,CP-R1(10 μmol/L)1 μL,DNA 模板1 μL,Nuclease-free water 9.5 μL,總體積25 μL。擴增程序為:94 ℃預變性3 min;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸45 s,共35 個循環;最后72 ℃延伸10 min,4 ℃保存。PCR 擴增反應結束后,取10 μL PCR 產物在2%瓊脂糖凝膠上進行電泳檢測。
(3)dPCR 鑒定候選內參基因的拷貝數。從上述轉CP 基因番木瓜的T1代陽性植株中隨機選取8 株,編號為CP1~CP8。使用QuantStudioTM3DAnalysisSuiteTM 數字PCR 儀,通過dPCR 檢測候選內參基因Cpa03g018830 在番木瓜基因組中的拷貝數。反應體系為:2×dPCR Master Mix 7.3 μL,CP 基因、Cpa03g018830 基因的正向引物和反向引物(10 μmol/L)各1.3 μL,探針(10 μmol/L) 0.36μL,DNA 模板(10 ng/μL)1 μL,Nuclease-free water0.28 μL,總體積14.50 μL。擴增程序為:96 ℃變性10 min;60 ℃ 2 min,98 ℃ 30 s,39 個循環;60 ℃ 2 min。反應結束后,將芯片放入dPCR 讀取儀中讀取FAM 和VIC 熒光信號,并使用對應軟件進行熒光數據分析,得到檢測樣品DNA 中CP 基因和Cpa03g018830 基因的拷貝數( copy/μL ), 計算樣品中CP 基因與Cpa03g018830 基因的拷貝數比值,通過比值判斷Cpa03g018830 基因在番木瓜基因組中的拷貝數。
選取已確認為單拷貝雜合的植株CP7 作為Cpa03g018770 基因在番木瓜基因組中拷貝數鑒定的參照,通過數字PCR 檢測Cpa03g018770 基因在番木瓜基因組中的拷貝數; 同時以Cpa03g018830 基因為單拷貝對照來進一步驗證Cpa03g018770 基因的拷貝數。Cpa03g018770 基因和Cpa03g018830 基因的dPCR 實驗各設3 個重復。1.2.2 dPCR 檢測轉基因番木瓜T0 代的外源基因拷貝數 以轉番木瓜PRSV 病毒HC-Pro 基因的T0代陽性番木瓜苗為待測樣品, 編號為HC-Pro-1~HC-Pro-11,采集11 株幼苗的葉片,提取其基因組DNA。以Cpa03g018770 基因和Cpa03g018830 基因為內參基因,以番木瓜轉基因常用的篩選基因NPTⅡ 為外源目的基因,通過dPCR 檢測外源基因在轉HC-Pro 基因番木瓜基因組中的拷貝數。其中,以Cpa03g018770 基因為內參基因,檢測6 株轉HC-Pro 基因番木瓜苗(HC-Pro-1~HC-Pro-6);以Cpa03g018830 基因為內參基因,檢測全部11 株轉HC-Pro 基因番木瓜苗。數字PCR 儀反應體系和擴增程序同1.2.1。反應結束后,將芯片放入dPCR 讀取儀中讀取FAM 和VIC 熒光信號,并使用對應軟件進行熒光數據分析,得到檢測樣品DNA 中NPTⅡ基因、Cpa03g018830 基因、Cpa03g018770 基因的拷貝數( copy/μL ), 計算樣品中NPTⅡ 基因與Cpa03g018830 基因、Cpa03g018770 基因的拷貝數比值,通過比值判斷NPTⅡ基因在番木瓜基因組中的拷貝數。
1.2.3 熒光定量PCR 檢測轉基因番木瓜T0代植株的外源基因拷貝數 (1)引物驗證。熒光定量PCR 引物同數字PCR 引物一樣,且不需要探針。以2 份已知拷貝數的轉基因番木瓜的基因組DNA為模板,進行熒光定量PCR 實驗,驗證內參Cpa03g018830、Cpa03g018770 基因和外源基因NPTⅡ的引物有效性。反應在LighterCycler? 96熒光分析儀中進行,反應體系為:2X Q3 SYBRqPCR Master Mix(Universal)10 μL,正向引物和反向引物(10 μmol/L)各0.4 μL,Template DNA(50 ng/μL)1 μL,ddH2O 8.2 μL,總體積為20 μL。擴增程序為:95 ℃預變性30 s;95 ℃變性10 s,58 ℃退火30 s,40 個循環;熔解曲線95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。實驗設置3 個重復,反應結束后,通過擴增曲線及溶解曲線判定引物是否有效。
(2)qPCR 檢測待測樣品的外源基因拷貝數。以轉HC-Pro 基因的T0 代陽性番木瓜苗為待測樣品,編號為HC-Pro-12~HC-Pro-55。以轉Nib 基因的T0 代陽性番木瓜苗為待測樣品,編號為Nib-1~Nib-28。分別采集番木瓜幼苗的葉片,提取其基因組DNA 。此外, HC-Pro-1~HC-Pro-11 和CP1~CP8 也作為待測樣品通過qPCR 再次驗證其拷貝數,待測樣品共91 份。以Cpa03g018770 基因和Cpa03g018830 基因為內參基因,以NPTⅡ基因為外源目的基因,以單拷貝純合的轉基因番木瓜株系作為對照,通過qPCR 檢測所有待測樣品的外源基因在轉基因番木瓜基因組中的拷貝數。qPCR 反應體系及擴增程序同引物驗證,每個樣品重復3 次。反應結束后,使用LightCycler?96SW 1.1 系統對數據進行分析,采用2?ΔΔCT法分析轉基因植株中NPTII 基因的相對拷貝數。
2 結果與分析
2.1 番木瓜單拷貝內參基因的篩選及鑒定
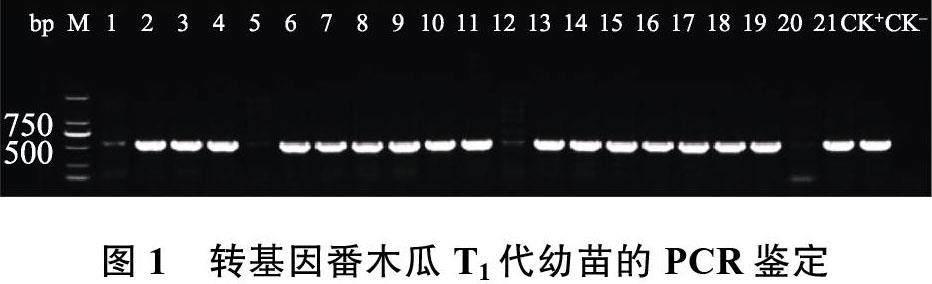
2.1.1 CP 基因陽性植株的PCR 鑒定 PCR 產物經電泳檢測后,若出現500 bp 左右的目的條帶則為轉基因陽性植株,可能為CP 基因純合或CP 基因雜合,若無目的條帶則為非轉基因植株。21 株T1 代幼苗的PCR 檢測結果見圖1,其中,有17株為CP 基因陽性植株,這17 株番木瓜植株可作為內參基因拷貝數鑒定的參照。
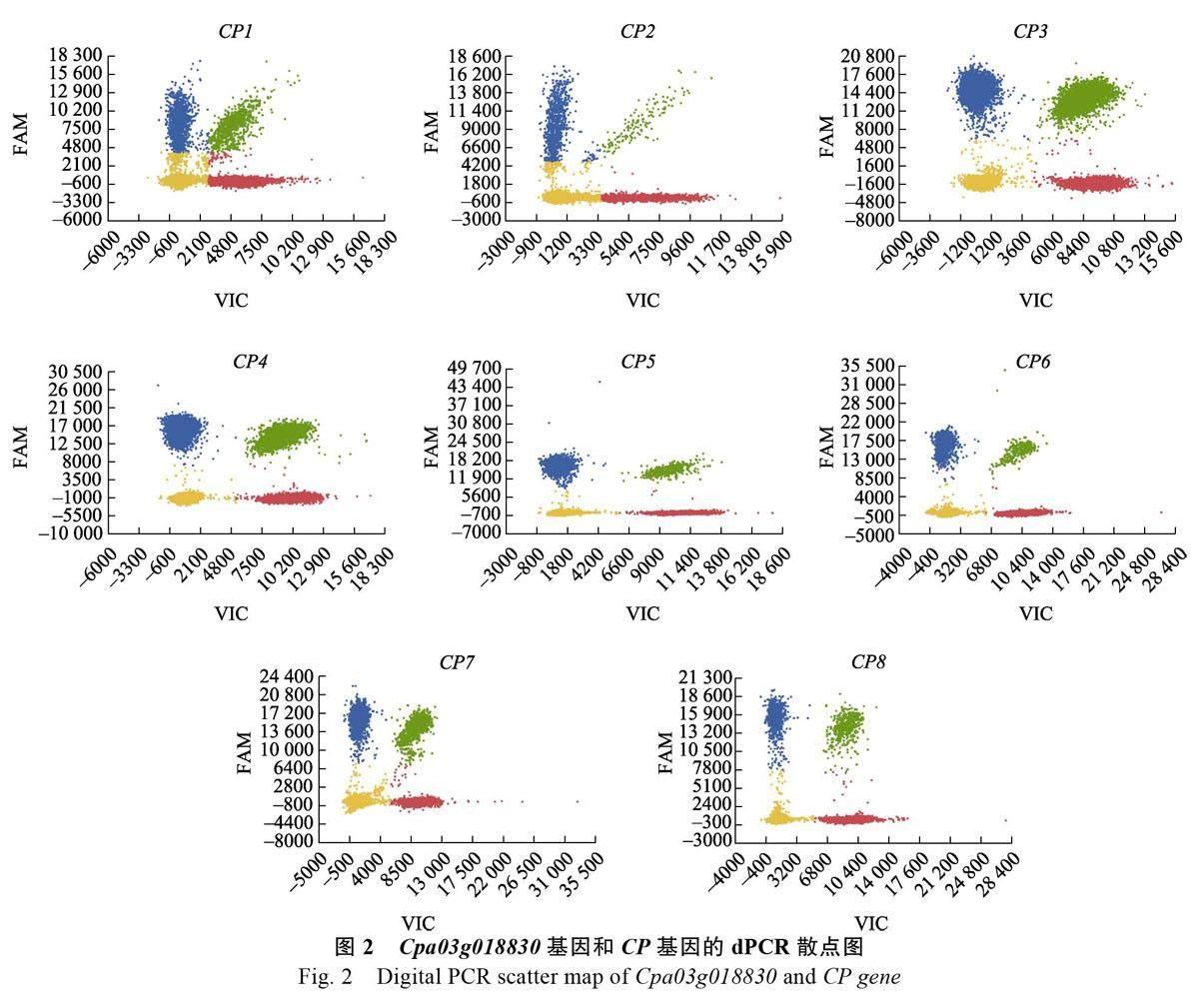
2.1.2 dPCR 鑒定候選內參基因的拷貝數 由于番木瓜屬于二倍體植物,轉CP 基因番木瓜單拷貝株系的T1 代陽性植株的CP 基因與Cpa03g018830基因的拷貝數比值為1 或0.5 時,Cpa03g018830基因為單拷貝基因。且根據CP 基因與目的基因的拷貝數比值,可得出轉CP 基因番木瓜的T1 代陽性植株為純合或雜合,拷貝數比值為1 時為單拷貝純合CP 植株,拷貝數比值為0.5 時為單拷貝雜合CP 植株。8 個樣品的數字PCR 散點圖見圖2,其中,藍色散點為CP 基因熒光孔數;紅色散點為Cpa03g018830 基因熒光孔數;綠色散點為CP 基因和Cpa03g018830 基因熒光孔數,黃色散點為無信號孔數。dPCR 實驗的拷貝數結果(表2)顯示,7 個樣品的CP 基因與Cpa03g018830 基因的拷貝數比值接近為1 或0.5,CP8 樣本的拷貝數比值為0.12, 結果異常, 將其排除。因此,Cpa03g018830 基因在番木瓜基因組中為單拷貝基因。且CP3 與CP4 樣品為單拷貝純合植株,CP1、CP2、CP5、CP6、CP7 樣品為單拷貝雜合植株。
由于CP7 為單拷貝雜合植株,其CP 基因與目的基因的拷貝數比值為0.5 時,則目的基因為單拷貝基因。CP7 的dPCR 實驗的結果(表3)顯示,CP 基因與Cpa03g018770 基因和Cpa03g018830 基因的拷貝數比值均接近0.5。因此,Cpa03g018770基因和Cpa03g018830 基因在番木瓜基因組中均為單拷貝基因,可作為內參基因應用于轉基因番木瓜中外源基因拷貝數的檢測。
2.2 dPCR 法檢測轉基因番木瓜T0代植株的外源基因拷貝數
番木瓜是二倍體植物,因此單拷貝整合的外源基因片段與內參基因的拷貝數比值約為0.5,雙拷貝整合的外源基因片段與內參基因的拷貝數比值約為1,三拷貝整合的外源基因片段與內參基因的拷貝數比值約為1.5,四拷貝、五拷貝等多拷貝外源基因片段整合拷貝數以此類推。
以Cpa03g018770 基因為內參基因,以NPTⅡ基因為外源目的基因,11 株轉HC-Pro 基因的T0代陽性番木瓜苗的dPCR 檢測結果表明,HC-Pro-1 、HC-Pro-2 、HC-Pro-3 、HC-Pro-4 、HC-Pro-5 檢測為單拷貝,HC-Pro-6 檢測為五拷貝(表4)。以Cpa03g018830 基因為內參基因的數字PCR 結果表明,HC-Pro-1、HC-Pro-2、HC-Pro-3、HC-Pro-4、HC-Pro-5 檢測為單拷貝,HC-Pro-6 檢測為五拷貝,HC-Pro-7、HC-Pro-8 和HC-Pro-10檢測為四拷貝,HC-Pro-9 和HC-Pro-11 檢測為六拷貝。其中,HC-Pro-1~HC-Pro-6 經2 個內參基因檢測的結果一致(表5)。
2.3 qPCR 檢測轉基因番木瓜T0代植株的外源基因拷貝數
2.3.1 qPCR 引物的驗證 3 對引物的擴增曲線及融解曲線表明,3 對引物均有明顯的擴增曲線,且融解曲線均具有唯一的吸收峰,可作為qPCR檢測引物(圖3)。
2.3.2 qPCR 檢測待測樣品的外源基因拷貝數采用2?ΔΔCT法分析轉基因植株中NPTII 基因的相對拷貝數,定義已知單拷貝純合轉基因植株對照為參照因子,即為1,各樣本相對于參照因子拷貝數的倍數為2?ΔΔCT。由于T0 代植株的插入為雜合型,因此單拷貝植株的相對定量值(RQ)應為純合單拷貝參照的1/2,相對表達量約為0.5;而雙拷貝植株的RQ 值與純合單拷貝對照相等,相對表達量約為1;三拷貝植株的相對定量值RQ應該為純合單拷貝對照的3/2,相對表達量約為1.5;多拷貝外源基因整合拷貝數以此類推。樣品HC-Pro-12~HC-Pro-55 的qPCR 檢測拷貝數的結果見圖4,其中,有25 個是單拷貝轉基因植株,有1 個是雙拷貝轉基因植株,有2 個是三拷貝轉基因植株,其余均為三拷貝以上轉基因植株。樣品Nib-1~Nib-28 的qPCR 檢測拷貝數的結果見圖5,有5 個是單拷貝轉基因植株,有2 個是雙拷貝轉基因植株,有6 個是三拷貝轉基因植株,其余均為三拷貝以上轉基因植株。樣品CP1~CP8 和HC-Pro-1~HC-Pro-11 的qPCR 檢測拷貝數的結果見圖6,CP1、CP2、CP5、CP6 和CP7 樣品為單拷貝雜合植株,CP3、CP4 和CP8 樣品為單拷貝純合植株,除CP8 號的dPCR 結果異常,其余均與dPCR 檢測的拷貝數結果一致。HC-Pro-1、HC-Pro-2、HC-Pro-3、HC-Pro-4 和HC-Pro-5 均為單拷貝轉基因植株, HC-Pro-7 、HC-Pro-8 和HC-Pro-10 為四拷貝轉基因植株,HC-Pro-6 為五拷貝轉基因植株,以上植株的拷貝數檢測結果與dPCR 的檢測結果一致;HC-Pro-9 和HC-Pro-11經qPCR 檢測為十五拷貝和五拷貝,然而dPCR的檢測結果均為六拷貝,結果不一致,這可能是因為熒光定量對外源基因單低拷貝整合的檢測靈敏度較高,而對多拷貝整合的檢測靈敏度低的緣故。
3 討論
在轉基因番木瓜檢測中,外源基因的拷貝數檢測是不可缺少的一環,因此獲得一種簡便、高效、精準的檢測方法至關重要。傳統的Southern雜交的結果準確可信,但其成本高,耗時長,一次檢測樣品少,操作要求高。qPCR 也常用于轉基因植株中外源基因拷貝數的檢測,可分為熒光染料法和探針法,探針法相比于染料法,能更精確地對低拷貝的目的DNA 片段進行定量分析,但探針價格較昂貴,成本高。染料法雖然相較于探針法精準度稍有降低,但在檢測外源基因的單低拷貝整合時的準確性也足以滿足育種工作需求,且其成本較低,更適宜高通量檢測。目前,qPCR 測定外源基因拷貝數已成功應用于轉基因水稻[10-11]和棉花[12]等作物的拷貝數檢測。dPCR 技術是在qPCR 技術基礎上的一次技術革新,其分析結果可直接得出DNA 分子的個數,對起始樣品進行絕對定量。相比qPCR,dPCR 無需任何校準物,具有更高的靈敏度、特異性和準確性。dPCR 在基因表達研究[13]、miRNA 研究[14-16]、基因組拷貝數鑒定[17-18]等方面具有廣闊前景。HINDSON 等[19]研究表明,dPCR 能夠簡單而準確地測定水稻、柑橘、馬鈴薯、玉米、番茄和小麥中的外源基因拷貝數。NARANCIO 等[20]比較了qPCR 和dPCR 方法在白三葉中外源基因拷貝數檢測中的優劣,結果表明,dPCR 在白三葉中的拷貝數檢測上具有更高的準確性。
要建立qPCR 和dPCR 檢測轉基因植株中外源基因拷貝數的方法,需要拷貝數明確的單拷貝基因作為內參基因。XUE 等[21]通過對甘蔗多個基因的檢測發現,APRT 基因最適合作為甘蔗DNA含量定量的內源參考基因,可應用于轉基因甘蔗中外源基因拷貝數的鑒定。本研究篩選出了2 個番木瓜單拷貝基因Cpa03g018830 與Cpa03g018770,驗證了其作為內參基因準確可用,且可將2 個內參基因同時使用,若2 個內參結果相一致,則結果更準確,因此,這2 個基因可作為內參基因應用于qPCR 或dPCR 鑒定轉基因番木瓜中外源基因拷貝數的研究。
本研究中,利用dPCR 與qPCR 方法分別測定了轉基因番木瓜中外源基因的拷貝數,HC-Pro-9 和HC-Pro-11 經qPCR 檢測為十五拷貝和五拷貝,然而dPCR 的檢測結果均為六拷貝,可能是因為qPCR 對外源基因單的低拷貝整合的檢測靈敏度較高,而對外源基因多拷貝整合的檢測靈敏度低較低。相比較來說,數字PCR 不依賴標準曲線定量,并不受PCR 擴增效率影響,具有更高的靈敏度和檢測準確度, 基于陣列式的QuantStudio 3D dPCR 系統等商業平臺也已成為臨床應用的關鍵設備,dPCR 的結果對外源基因拷貝數的檢測更準確。qPCR 成本較低,簡單快速,適合用來在大量轉基因植株中初篩出單低拷貝整合的植株,經qPCR 初步篩選到的單低拷貝整合的株系可進一步用Southern 雜交進行驗證,不僅進一步提高實驗結果的準確性與權威性,還節省成本。本研究建立的利用dPCR 和qPCR 技術高通量檢測轉基因番木瓜中外源基因拷貝數的方法,可為番木瓜轉基因抗病育種中單低拷貝株系的選育提供新的方法。

