探究高血糖與胰島素干預對大鼠腦損傷的影響
康旭暉 史占華

基金項目:內蒙古自治區衛生健康科技計劃項目(編號:wsjkkj038)
作者簡介:康旭暉,碩士研究生,醫師,研究方向:顱腦損傷合并糖尿病的診療。
通信作者:史占華,博士研究生,主任醫師,研究方向:顱腦損傷合并糖尿病的診療。E-mail:793361405@qq.com
【摘要】目的 通過大鼠動物實驗探討高血糖與腦損傷的關聯性及對后胰島素干預腦損傷的影響。方法 選取45只健康大鼠,根據隨機數字表法分為對照組、糖尿病組、胰島素恢復組,各15只。對后兩組進行相應的建模比較3組大鼠血糖、體質量、學習記憶功能、海馬區病理結果、海馬小膠質細胞活化情況。結果 實驗后,糖尿病組和胰島素恢復組大鼠血糖濃度均高于對照組,且糖尿病組高于胰島素恢復組(均P<0.05)。實驗后,糖尿病組大鼠平均體質量降低,胰島素恢復組和對照組大鼠平均體質量均增加,且胰島素恢復組低于對照組(均P<0.05)。在定位航行實驗中,3組大鼠逃避潛伏期具有交互效應、時間差異、組間差異(F時間=91.23,P時間<0.05;F組間=6.89,P組間<0.05;F交互效應=6.89,P交互效應<0.05)。3組大鼠逃避潛伏期均縮短,且糖尿病組和胰島素恢復組均長于對照組,糖尿病組長于胰島素恢復組(均P<0.05);在空間探索實驗中,糖尿病組大鼠穿臺次數少于胰島素恢復組和對照組(均P<0.05)。糖尿病組大鼠CA3區神經元細胞核固縮、深染,胰島素恢復組和對照組未見明顯異常;糖尿病組大鼠海馬CA1區細胞排列相對疏松,部分神經元出現腫脹現象,胰島素恢復組和對照組未見明顯異常;糖尿病組大鼠海馬小膠質細胞呈活化態,胰島素恢復組大鼠和對照組呈靜息態。結論 高血糖可導致大鼠學習記憶能力及平均體質量下降,神經元損傷嚴重,小膠質細胞明顯活化。經胰島素干預后可將糖尿病大鼠血糖控制在正常范圍,減輕腦組織損傷,但其對腦組織的保護具有一定限度,但糖代謝對 DM 腦損傷的確切作用機制有待進一步研究。
【關鍵詞】高血糖;胰島素;腦損傷;腦損傷轉歸
【中圖分類號】R295 【文獻標識碼】A 【文章編號】2096-2665.2024.08.00.04
DOI:10.3969/j.issn.2096-2665.2024.08.003
糖尿病(diabetes mellitus, DM)是由內分泌系統紊亂導致的代謝性疾病,屬于全身性疾病,臨床表現為持續的高血糖狀態,嚴重影響患者身體健康、威脅生命安全[1]。DM引發的腦損傷主要表現為認知功能障礙,包括智力、反應速度、注意力、學習記憶和執行能力等功能下降,嚴重影響患者日常生活和生存質量[2]。胰島素具有調節營養攝入、調節急性代謝效應、監測能量儲存的作用,主要來源為胰島β細胞,也可在中樞神經系統中的海馬體、額葉、下丘腦等部位的神經元中少量合成。胰島素轉運體、胰島素受體和胰島素下游信號分子分布在大腦的神經元和神經膠質細胞中,大量的胰島素受體存在于內側顳葉、海馬區和前額皮質,這些區域與認知功能密切相關[3]。基于此,本研究觀察血糖濃度升高和血糖調控后大鼠腦組織的生理改變,分析高血糖與大鼠腦損傷的關聯性及胰島素干預后腦損傷的轉歸,現報道如下。
1 材料與方法
1.1 實驗動物和建模 選取45只健康大鼠,根據隨機數字表法分為對照組、糖尿病組、胰島素恢復組,各15只。本研究采用1型糖尿病(T1DM)動物模型,研究過程遵循國際通行的動物福利和倫理準則。對照組大鼠注射檸檬酸鹽緩沖液[賽默飛世爾科技(中國)有限公司,國藥準字2291837,規格:100 mL]2 mL/kg,提供正常食物和10%蔗糖溶液,于實驗第2天將蔗糖溶液換成飲用水并保持不變。其余兩組大鼠一次性腹腔注射鏈脲佐菌素(北京普利萊基因技術有限公司,規格:100 mg/支),65 mg/kg,注射后第7天進行血糖檢測,大鼠空腹血糖值≥16.7 mmol/L為高血糖建模成功。于高血糖模型制作完成后第2天,胰島素恢復組大鼠每天上午8時、下午4時皮下注射低精蛋白鋅胰島素注射液(江蘇萬邦生化醫藥集團有限責任公司,國藥準字H20060845,規格:3 mL∶300單位)2~3 單位,保持空腹血糖 <10 mmol/L,對照組、糖尿病組大鼠同時注射等量生理鹽水。3組大鼠每天均正常飼養,持續飼養12周。
1.2 觀察指標 ⑴血糖濃度。血糖檢測前12 h禁食,檢測時用75%乙醇溶液擦拭大鼠尾部,用采血針于大鼠尾尖部位采血,第2滴血流出時滴入血糖儀試紙中讀取血糖儀顯示的數值并記錄。⑵平均體質量。每周使用電子天平測量3組大鼠體質量,本組大鼠平均體質量=本組大鼠體質量之和/15。⑶學習記憶功能。于飼養結束后第1,2,3d,利用Morris水迷宮實驗檢測大鼠學習記憶功能,實驗方案由定位航行實驗和空間探索實驗兩部分組成。定位航行實驗:先將泳池分為4個象限,實驗大鼠面朝泳池內壁,將之分別由4個象限依次放入泳池并開始視頻追蹤,實驗時間為120 s,記錄實驗大鼠找到水下平臺所需時間,2次/d。若實驗大鼠在120 s內未找到水下平臺,則將逃避潛伏期記為120 s,并將實驗大鼠人工引導至水下平臺休息10 s,取兩次實驗的平均值并記錄為逃避潛伏期。空間探索實驗:開始時去掉水下平臺,將實驗大鼠面朝池壁放入水迷宮內,實驗時間60 s,記錄大鼠在60 s內穿過平臺標記位置的次數,取兩次穿過次數的平均值。⑷海馬區病理學變化。3組各取1只實驗大鼠,進行麻醉后從心臟灌注生理鹽水,取全腦置于甲醛中固定24 h。將固定好的腦組織進行常規石蠟包埋、切片、蘇木精-伊紅染色(HE染色)。最后在光學顯微鏡下觀察圖像并采集分析。⑸海馬小膠質細胞活化情況。3組各取1只實驗大鼠,組織樣品取材、固定方法同⑷,制作封片后使用掃描共聚焦顯微鏡觀察組織切片,并記錄海馬小膠質細胞活化情況。
1.3 統計學分析 采用SPSS 21.0統計學軟件處理數據。計數資料以[例(%)]表示,組間比較采用χ2檢驗;計量資料以(x)表示,組間比較采用獨立樣本t檢驗,組間多時間點比較采用重復測量方差分析,兩組間比較采用 LSD-t檢驗,不符合同質性檢驗的采用Games-Howell檢驗。以P<0.05為差異有統計學意義。
2 結果
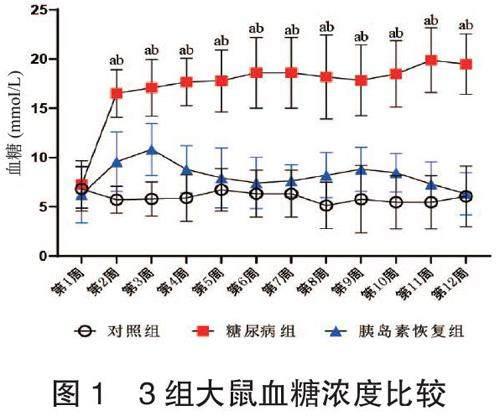
2.1 3組大鼠血糖濃度比較 實驗后,糖尿病組和胰島素恢復組大鼠血糖濃度均高于對照組,且糖尿病組高于胰島素恢復組,差異均有統計學意義(均P<0.05),見圖1。
2.2 3組大鼠平均體質量比較 實驗后,糖尿病組大鼠平均體質量降低,胰島素恢復組和對照組平均體質量均增加,且胰島素恢復組低于對照組,差異均有統計學意義(均P<0.05),見圖2。
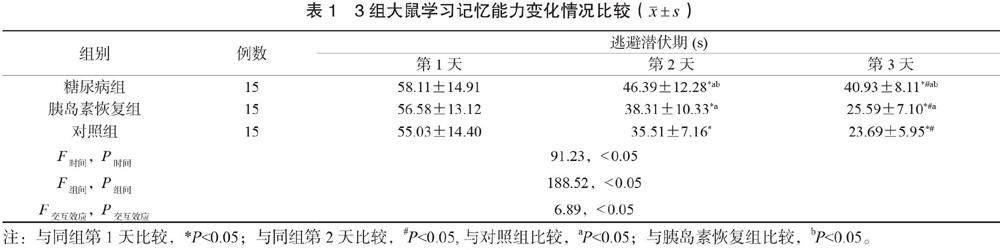
2.3 3組大鼠學習記憶能力變化情況比較 在定位航行實驗中,3組大鼠逃避潛伏期具有時間差異、組間差異、交互效應(F時間=91.23,P時間<0.05;F組間=6.89,P組間<0.05;F交互效應=6.89,P交互效應<0.05)。3組大鼠逃避潛伏期均縮短,且糖尿病組和胰島素恢復組均長于對照組,糖尿病組長于胰島素恢復組,差異均有統計學意義(均P<0.05)。糖尿病組大鼠穿臺次數為(2.38±1.41)次,胰島素恢復組為(3.63±1.78)次,對照組為(5.07±1.77)次,糖尿病組穿臺次數介于胰島素恢復組和對照組,胰島素恢復組少于對照組,差異均有統計學意義(均P<0.05),見表1。
2.4 3組大鼠海馬病理學變化 糖尿病組大鼠CA3區神經元細胞核固縮、深染;胰島素恢復組大鼠CA3區神經元均質紅染,細胞核較清晰;對照組大鼠CA3區神經元均質紅染,細胞核清晰可見,未見明顯異常,見圖3。糖尿病組大鼠海馬CA1區細胞排列相對疏松,部分神經元出現腫脹現象,但并未見神經元細胞質深染、細胞核固縮等情況出現;胰島素恢復組大鼠海馬CA1區神經元排列恢復正常,細胞形態未見異常;對照組大鼠海馬CA1區神經元均質紅染排列緊密,細胞核清晰可見,未見明顯異常,見圖4。
2.5 3組大鼠海馬小膠質細胞活化情況 糖尿病組大鼠海馬小膠質細胞呈明顯的阿米巴狀,細胞的體積明顯增大,小膠質細胞突觸變短、變粗乃至巨噬細胞樣,呈明顯的活化態;胰島素恢復組大鼠海馬小膠質細胞凸起顯著變長,胞體變小,細胞由活化態恢復為靜息態;對照組大鼠海馬小膠質細胞胞體相對較小,突觸長且并未出現顯著的回縮現象,形態呈靜息態,見圖5。
3 討論
本研究通過單次腹腔注射鏈脲佐菌素破壞大鼠胰島β細胞,導致胰島素釋放不足,引起持續性血糖濃度升高,使大鼠出現多飲、多尿、體質量減輕的癥狀。本研究結果顯示,實驗后,糖尿病組和胰島素恢復組大鼠血糖濃度均高于對照組,且糖尿病組高于胰島素恢復組,糖尿病組大鼠平均體質量降低,胰島素恢復組和對照組平均體質量均增加,且胰島素恢復組低于對照組。這提示糖尿病可對實驗大鼠體質量產生明顯的影響,在進行血糖轉歸后大鼠體質量恢復。由高血糖引起的腦損傷主要表現為記憶力減退、認知能力障礙、邏輯能力混亂,在動物模型的實驗中主要表現為Morris水迷宮的逃避潛伏期或轉移潛伏期延長,游泳距離延長。海馬區是哺乳動物空間學習和記憶的重要結構功能區,也是神經可塑性的主要腦區。本研究結果顯示,定位航行實驗中,糖尿病組和胰島素恢復組大鼠逃避潛伏期均長于對照組,且糖尿病組長于胰島素恢復組;在空間探索實驗中,糖尿病組大鼠穿臺次數少于對照組和胰島素恢復組。這提示糖尿病可降低實驗大鼠學習記憶能力,且在血糖調控后大鼠學習記憶能力恢復,糖尿病發病可能是實驗大鼠學習記憶功能損傷的關鍵因素,這與Erukainure等[4]研究結果一致。分析原因為,腦組織所消耗的能量主要來源于葡萄糖代謝,糖代謝受損可導致血糖穩態失調,嚴重影響機體認知功能[5]。有研究表明,DM腦損傷患者常表現出空腹血糖受損、慢性持續性高血糖癥、大腦雙側海馬區細胞損傷并萎縮、認知功能障礙等癥狀[6-7]。
本研究結果顯示,糖尿病組大鼠CA3區神經元細胞核固縮、深染,胰島素恢復組和對照組大鼠未見明顯異常;糖尿病組大鼠海馬CA1區細胞排列相對疏松,部分神經元出現腫脹現象,胰島素恢復組和對照組大鼠未見明顯異常。這提示高血糖可導致海馬CA1、CA3區神經細胞變性壞死。分析原因為,高血糖引起的腦損傷的發病機制復雜,包括氧化應激、神經炎癥、神經遞質變化、腦組織修復過程受損等綜合過程[8]。其中,氧化應激產生的毒性物質會導致血腦屏障和大腦微脈管系統出現滲透性破壞,進一步損害神經細胞,是DM 患者腦部出現神經炎癥、神經細胞變性和凋亡及進行性認知減退的主要原因[9-10]。
本研究結果顯示,糖尿病組大鼠海馬小膠質細胞呈明顯的活化態,胰島素恢復組和對照組大鼠呈靜息態。這提示血糖濃度升高可導致小膠質細胞活化,而在胰島素干預后形態異常的神經元數量減少,神經元形態逐漸趨于正常。分析原因為,小膠質細胞作為腦的固有免疫效應細胞,在受到刺激時活性增強,并通過分泌和釋放細胞因子、生長因子等維持神經元的正常功能[11]。海馬區高血糖狀態造成腦細胞損傷、凋亡,進而激發小膠質細胞活化[12]。當胰島素調控血糖濃度趨于正常后,受損腦細胞逐漸恢復正常形態、功能,小膠質細胞活化程度降低,呈靜息態。
綜上所述,高血糖可導致大鼠學習記憶能力及平均體質量下降,神經元損傷嚴重,小膠質細胞明顯活化。經胰島素干預后可將糖尿病大鼠血糖控制在正常范圍,減輕腦組織損傷,但其對腦組織的保護具有一定限度,但糖代謝對 DM 腦損傷的確切作用機制有待進一步研究。
參考文獻
[1]董雯, 劉美琴, 倫永志, 等. 糖脂代謝參與糖尿病腦損傷的研究進展[J]. 邵陽學院學報(自然科學版), 2020, 17(5): 103-108.
[2]SCHMIDT A M.Highlighting diabetes mellitus: The epidemic continues[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2018, 38(1): el-e8.
[3]胥智超,李潤芝,米東華,中樞胰島素抵抗與腦血管病的關系[J].中國卒中雜志,2022,17(11):1276-1282.
[4]ERUKAINURE O L, IJOMONE O M, OYEBODE O A, et al.Hyperglycemia-induced oxidative brain injury:Therapeutic effects of Cola nitida infusion against redox imbalance,cerebellar neuronal insults,and upregulated Nrf2 expression in type 2 diabetic rats[J].Food And Chemical Toxicology, 2019, 127:206-217.
[5]LI Y, TENG D,SHI X,et al.Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: National cross sectional study[J]. The British Medical Journal, 2020, 369:m997.
[6]ALSHARIF A A, WEI L, MA T,et al.Prevalence and incidence of dementia in people with diabetesMmellitus[J].Journal of Alzheimers Disease,2020,75(2):607-615.
[7]YU J H, HAN K, PARK S,et al.Incidence and risk factors for dementia in type 2 diabetes mellitus:A nationwide population-based study in Korea[J].Diabetes Metabolism Journal, 2020, 44(1): 113-124.
[8]王琳, 趙婭東. 伴糖尿病或應激性高血糖的重癥顱腦外傷患者炎癥因子與胰島素組分的相關性[J].醫學臨床研究, 2023, 40(11): 1747-1750.
[9]HAMED S A.Brain injury with diabetes mellitus: evidence, mechanisms and treatment implications[J]. Expert Review of Clinical Pharmacology, 2017, 10(4):409-428.
[10]PINTI M V, FINK G K,HATHAWAY Q A, et al.Mitochondrial dysfunction in type 2 diabetes mellitus:an organ-based analysis[J].American Journal of Physiology.Endocrinology and Metabolism, 2019, 316(2): E268-E285.
[11]王冬雪, 蔣玟依, 林萍, 等.rhFGF21調控小膠質細胞/巨噬細胞介導的神經炎癥促進2型糖尿病小鼠缺血性腦卒中后神經功能的修復[J]. 中國藥理學與毒理學雜志, 2023, 37(7):503.
[12]GUO X Y, SHI Y, DU P,et al.HMGB/TLR4 promotes apoptosis and reduces autophagy of hippocampal neurons in diabetes combined with OSA in diabetes combined with OSA[J].Life sciences, 2019, 239: 117020.

