基于非靶向代謝組學挖掘兩種日糧模式下蛋雞回腸代謝物的差異
張應胡 秦緒光 馬麗 王皓杰 胡玲 田光明

摘要:為探究飼喂基礎日糧(CON)和含5.0%益生菌發酵飼料(PFF)2種日糧條件下蛋雞回腸內容物代謝物差異,采用液相色譜-質譜和非靶向代謝組學相結合的方法,檢測2種日糧條件下蛋雞回腸中代謝產物,通過差異代謝物篩選和KEGG富集分析,篩選出蛋雞回腸中的差異代謝物及代謝通路。結果表明,與CON組相比,PFF組中膽酸、牛磺鵝去氧膽酸、鵝去氧膽酸等膽汁酸含量顯著降低,異亮氨酸-亮氨酸-甘氨酸-丙氨酸、苯丙氨酸-谷氨酸-纈氨酸-谷氨酸、亮氨酸-酪氨酸-蘇氨酸-賴氨酸等小肽含量顯著增加;KEGG通路富集分析表明,代謝物主要與膽汁分泌、初級膽汁酸生物合成等通路相關,初級膽汁酸在宿主脂質和脂溶性物質的消化代謝、抗氧化狀態、膽固醇代謝和宿主-微生物相互作用中發揮重要作用。蛋雞日糧中添加益生菌發酵飼料可通過改變腸道代謝產物來改善腸道吸收功能。
關鍵詞:發酵飼料;蛋雞;回腸代謝產物;非靶向代謝組學
中圖分類號:S831.5? ? ? ? ?文獻標識碼:A
文章編號:0439-8114(2024)06-0213-05
DOI:10.14088/j.cnki.issn0439-8114.2024.06.035 開放科學(資源服務)標識碼(OSID):
Exploring the differences in ileal metabolites of laying hens under two different dietary patterns based on non targeted metabolomics
ZHANG Ying-hu1, QIN Xu-guang2, MA Li1, WANG Hao-jie1, HU Ling1, TIAN Guang-ming1
(1.College of Animal Science and Technology, Yangtze University, Jingzhou? 434025, Hubei, China; 2.Rizhao Animal Disease Prevention and Control Center, Rizhao? 276826, Shandong, China)
Abstract: To investigate the differences in metabolites in the ileum contents of laying hens fed with two different dietary conditions: basal diet (CON) and fermented feed containing 5.0% probiotics (PFF),a combination of liquid chromatography-mass spectrometry and non targeted metabolomics was used to detect metabolites in the ileum of laying hens under two different dietary conditions. Differential metabolite screening and KEGG enrichment analysis were performed to screen for differential metabolites and metabolic pathways in the ileum of laying hens. The results showed that compared with the CON group, the content of bile acids such as bile acid, taurine goose deoxycholic acid, and goose deoxycholic acid in the PFF group was significantly reduced, while the content of small peptides such as isoleucine-leucine-glycine-alanine, phenylalanine-glutamate-valine-glutamate, and leucine-tyrosine-threonine-lysine was significantly increased;KEGG pathway enrichment analysis showed that metabolites were mainly related to pathways such as bile secretion and primary bile acid biosynthesis. Primary bile acids played important roles in the digestion and metabolism of host lipids and lipophilic substances, antioxidant status, cholesterol metabolism, and host-microbial interactions. Adding probiotic fermented feed to the diet of laying hens could improve intestinal absorption function by altering intestinal metabolites.
Key words:fermented feed; laying hens; ileal metabolites; non-targeted metabolomics
蛋雞養殖是中國畜禽行業的重要組成部分。然而,在集約化養殖中蛋雞運動受限,導致蛋雞腸道代謝性能下降,降低了營養物質的消化吸收效率,進而降低了生產性能。育雛期是蛋雞養殖的關鍵時期,該時期的蛋雞與其他畜禽相比消化道較短,未完全發育的腸道免疫力較弱,腸道消化吸收與屏障功能易受影響。有研究表明,飼喂益生菌發酵飼料能夠減少抗生素的使用,提高畜禽生產性能、機體免疫力及產品品質等[1,2]。目前,發酵飼料在蛋雞中的研究集中在生產性能、血清指標、腸道組織形態及腸道微生物菌群等方面[3,4],而益生菌發酵飼料如何影響蛋雞腸道代謝產物的相關研究較少。
代謝組學可以對生物體液、細胞和組織中的代謝物進行分析,通常用作生物標志物發現的工具[5]。腸道代謝物能夠調控機體新陳代謝和炎癥反應等,通過對代謝物的定性、定量及差異分析,有助于尋找代謝物與生物過程之間的聯系[6]。近年來,代謝組學技術已廣泛應用于畜禽行業,Huang等[7]基于血清代謝組學發現飼喂發酵飼料仔豬血清中的亮氨酸、異亮氨酸、纈氨酸和乳酸水平顯著升高。Chen等[8]利用非靶向和靶向代謝組學鑒定發現L-脯氨酸、L-纈氨酸和L-去甲亮氨酸可以作為雞腸炎沙門氏菌污染的生物標志物。然而,使用代謝組學進行蛋雞腸道代謝物研究鮮見報道。
本研究利用液相色譜-質譜(LC-MS)結合非靶向代謝組學技術,以飼喂基礎日糧(CON)和含5.0%益生菌的發酵飼料(PFF)2組蛋雞回腸內容物為試驗材料,通過篩選找出差異代謝物,并對差異代謝物進行KEGG通路分析。旨在探究益生菌發酵飼料對蛋雞腸道代謝產物的影響及相關代謝通路的變化。
1 材料與方法
1.1 試驗設計與樣品采集
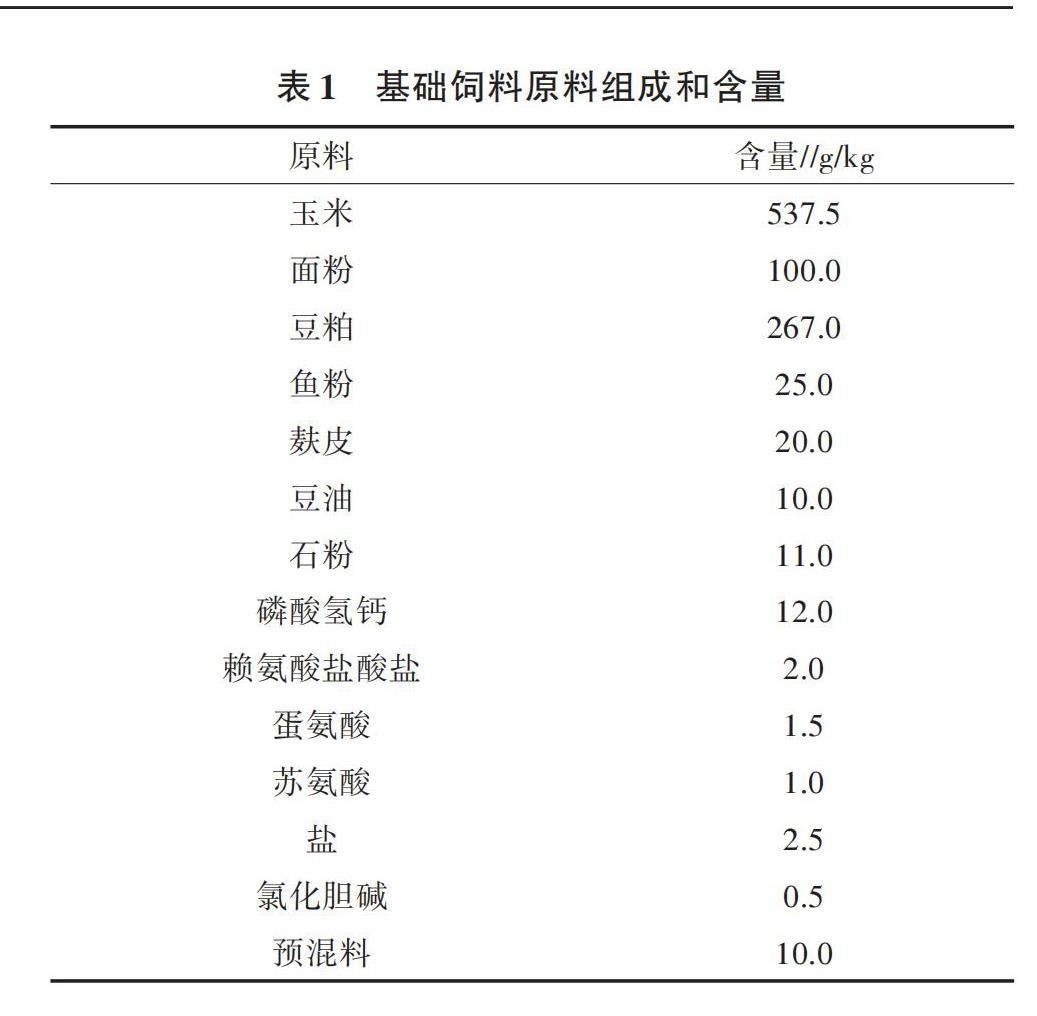
選擇體重相近的1日齡蛋雞(京粉1號)180只,隨機分為2組,每組6個重復,每個重復15只,雞舍光照和溫度根據養殖指導手冊進行調整,蛋雞自由飲水采食。對照組(CON)飼喂基礎日糧(基礎日糧成分如表1、表2所示),試驗組(PFF)將5.0%基礎日糧替換為益生菌發酵飼料,參考Guo等[9]的方法制備益生菌發酵飼料。試驗第42天,在每個重復中隨機選擇1只雞。將雛雞頸椎脫臼法安樂死,收集2~3 g回腸內容物至凍存管中,液氮速凍,-80 ℃存儲,以備下一步分析。
1.2 回腸內容物代謝組檢測與分析
1.2.1 樣本處理與檢測 冰上解凍樣品,取20 mg樣品加入400 μL 70%甲醇水內標提取液,渦旋3 min,冰浴超聲波10 min,渦旋1 min,于-20 ℃靜置30 min后離心去除沉淀。取上清液在4 ℃ 12 000 r/min條件下離心3 min,取200 μL上清液進行LC-MS分析。
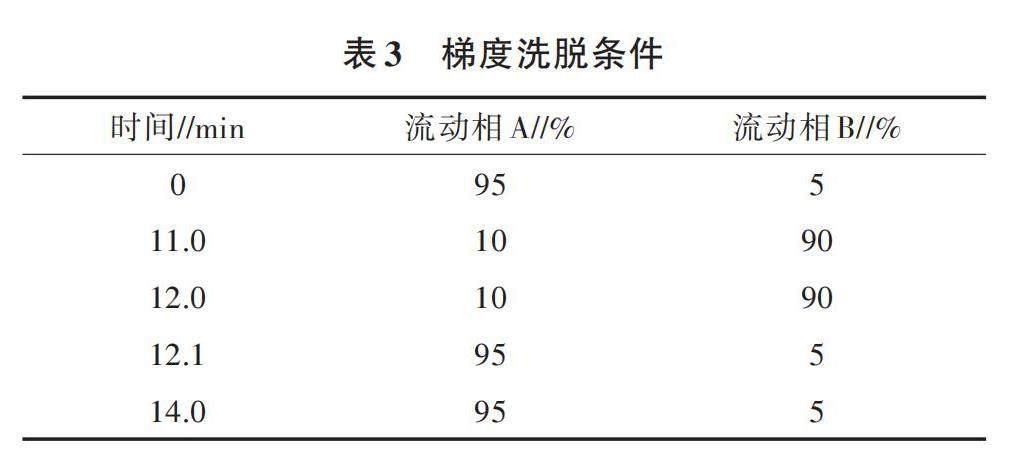
色譜條件:色譜柱為ACQUITY UPLC HSS T3 C18(2.1 mm×100 mm,1.8 μm);柱溫為40 ℃;采用二元流動相洗脫,流速為0.4 mL/min;進樣量為2 μL;流動相A為0.1%甲酸水溶液,流動相B為0.1%甲酸乙腈溶液;梯度洗脫方法如表3所示。
1.2.2 數據處理與分析 通過ProteoWizard軟件將LC-MS獲取的原始數據文件轉換為mzML格式。用XCMS程序分別進行峰提取、峰對準和保留時間校正。采用支持向量回歸(SVR)方法對峰面積進行校正。過濾每組樣品中檢出率低于50%的峰,并通過檢索實驗室自建數據庫、綜合公共數據庫、AI數據庫及metDNA方法得到代謝物鑒定信息。
以變量投影重要性(Variable importance in projection,VIP)和差異倍數(Fold change,FC)為條件進行差異代謝物的篩選(VIP≥1,|Log2FC|≥1.0)。使用KEGG Compound數據庫對差異代謝物進行標注,然后映射到KEGG pathway數據庫。
2 結果與分析
2.1 腸道代謝產物總覽
本試驗選取2組共12個樣品進行代謝研究,共檢測到8 125個代謝物,正、負離子模式下分別有? ? 4 697、3 428個代謝物。對所有的代謝化合物進行分類分析發現,正離子模式下主要為氨基酸及其代謝產物(24.78%)、苯及其取代衍生物(14.12%)、雜環化合物(13.31%)、有機酸及其衍生物(7.45%)等;負離子模式下主要為苯及其取代衍生物(15.61%)、氨基酸及其代謝產物(14.47%)、雜環化合物(14.00%)、有機酸及其衍生物(11.41%)等(圖1)。
2.2 差異代謝物結果的判斷
OPLS-DA模型分析結果如圖2所示,通過200次的隨機組合試驗,發現正離子模式下模型R2X=0.457、Q2=0.675、R2Y=1.000,負離子模式下模型R2X=0.448、Q2=0.658、R2Y=1.000。2個模式下的Q2都大于0.500,表明模型有效;R2Y的P都低于0.005,表明該模型可根據VIP分析篩選差異代謝物。
2.3 差異代謝物火山圖
利用t檢驗和變異系數法比較2組代謝產物之間的差異,在VIP+FC雙重篩選條件下,對正、負離子模式下檢測到的所有代謝物進行差異分析,采用火山圖進行可視化展示(圖3),CON組和PFF組在正、負離子模式下篩選出的差異表達代謝物分別為337、253個,其中正離子模式下差異代謝物有93個上調、244個下調,負離子模式下差異代謝物有44個上調、209個下調,部分差異代謝物如表4所示。
2.4 差異代謝物KEGG富集分析
對差異代謝物進行KEGG pathway富集分析,P越接近于0,表示富集越顯著,圖中點的大小代表富集到相應通路上的差異代謝物個數。由圖4可知,正離子模式下的差異基因顯著富集在初級膽汁酸生物合成(Primary bile acid biosynthesis)、氧化磷酸化(Oxidative phosphorylation)、類固醇激素生物合成(Steroid hormone biosynthesis)等KEGG信號通路。負離子模式下的差異代謝物顯著富集在初級膽汁酸生物合成(Primary bile acid biosynthesis)、甘油磷脂代謝(Glycerophospholipid metabolism)、膽汁分泌(Bile secretion)等KEGG信號通路。綜合分析發現,在正、負離子下膽汁酸相關差異代謝物顯著下降,并顯著富集在初級膽汁酸生物合成、膽汁分泌等KEGG信號通路。
3 討論
本研究對飼喂基礎日糧和發酵飼料的2組蛋雞回腸內容物樣本進行代謝組比較分析。結果顯示,發酵飼料組蛋雞腸道中590個代謝物發生顯著變化,其中,正、負離子模式下篩選出的差異表達代謝物分別為337、253個。KEGG通路富集分析表明,代謝物主要與膽汁分泌、初級膽汁酸生物合成等通路相關。初級膽汁酸在宿主脂質和脂溶性物質的消化代謝、抗氧化狀態、膽固醇代謝和宿主-微生物相互作用中發揮重要作用。膽汁酸可與細胞質G蛋白偶聯受體TGR5(TGR5/M-bar)和核法尼醇X受體(FXR)結合調節脂肪、葡萄糖和能量消耗的代謝[10]。Yang等[11]研究發現,通過飲食、糞便微生物菌群移植等方式調控膽汁酸、腸道菌群可以緩解炎癥性腸病,表明腸道菌群和膽汁酸在腸道穩態和炎癥中起著關鍵作用。本研究中,富集于膽汁分泌、初級膽汁酸生物合成通路的膽酸、牛磺鵝去氧膽酸、鵝去氧膽酸、牛磺膽酸含量顯著下降,且蛋雞未出現消瘦、消化不良等癥狀。可能原因是試驗對象為健康蛋雞,其腸道處于正常狀態,沒有炎癥發生,同時發酵飼料中益生菌可助力營養物質消化,因此膽汁酸分泌低于CON組,但其具體調控機制仍有待進一步研究。
本研究還發現PFF組中氨基酸及其代謝產物相比CON組差異顯著。氨基酸在生物體中合成蛋白質不可或缺,并可影響代謝生理學和信號傳導,在宿主與微生物互作中充當重要的角色。腸道微生物合成氨基酸是促進宿主氨基酸穩態的重要方式,Lin等[12]的研究發現,腸道微生物群可以合成多種營養必需氨基酸,這是氨基酸穩態的潛在調節因素。谷氨酸、精氨酸、脯氨酸可以在動物機體內相互轉化,并發揮重要作用的生理作用[13],例如,日糧丙氨酸補充劑改善了肉雞的生長性能和肌肽含量,改善了抗氧化能力和肉質,上調了肌肽合成相關酶的基因表達[14]。谷氨酸在提高家禽生長性能、生產性能及飼料效率方面作用顯著[15]。本研究發現,PFF組蛋雞腸道中的異亮氨酸-亮氨酸-甘氨酸-丙氨酸、苯丙氨酸-谷氨酸-纈氨酸-谷氨酸、亮氨酸-酪氨酸-蘇氨酸-賴氨酸等物質顯著上調,表明飼喂發酵飼料可以增加回腸中氨基酸含量,從而促進蛋雞生長性能和生產性能。
4 小結
本研究運用非靶向代謝組學結合LC-MS的方法,研究了2種日糧模式下蛋雞腸道內容物代謝產物的變化。結果表明,飼喂發酵飼料減少了蛋雞回腸內容物膽酸、牛磺鵝去氧膽酸、鵝去氧膽酸等膽汁酸含量,增加了回腸中氨基酸的含量。
參考文獻:
[1] LV J, GUO L J, CHEN B X, et al. Effects of different probiotic fermented feeds on production performance and intestinal health of laying hens[J]. Poultry science, 2022, 101(2): 101570.
[2] LU Z J, ZENG N, JIANG S G, et al. Dietary replacement of soybean meal by fermented feedstuffs for aged laying hens:Effects on laying performance, egg quality, nutrient digestibility, intestinal health, follicle development, and biological parameters in a long-term feeding period[J]. Poultry science, 2023, 102(3): 102478.
[3] ZHU X, TAO L J, LIU H, et al. Effects of fermented feed on growth performance, immune organ indices, serum biochemical parameters, cecal odorous compound production, and the microbiota community in broilers[J]. Poultry science, 2023, 102(6): 102629.
[4] ZHANG A R, WEI M, YAN L, et al. Effects of feeding solid-state fermented wheat bran on growth performance and nutrient digestibility in broiler chickens[J]. Poultry science, 2022, 101(1): 101402.
[5] JOHNSON C H, IVANISEVIC J, SIUZDAK G. Metabolomics:Beyond biomarkers and towards mechanisms[J]. Nature reviews molecular cell biology, 2016, 17(7): 451-459.
[6] 鄭倩婷, 孟立娜. 腸道菌群代謝產物對腸道免疫影響的研究進展[J]. 國際消化病雜志, 2021, 41(3): 164-167.
[7] HUANG L, REN P, OUYANG Z, et al. Effect of fermented feed on growth performance, holistic metabolism and fecal microbiota in weanling piglets[J]. Animal feed science and technology, 2020, 266: 114505.
[8] CHEN L, DING H, ZHU Y, et al. Untargeted and targeted metabolomics identify metabolite biomarkers for Salmonella enteritidis in chicken meat[J]. Food chemistry, 2023, 409: 135294.
[9] GUO W, XU L N, GUO X J, et al. The impacts of fermented feed on laying performance,egg quality,immune function,intestinal morphology and microbiota of laying hens in the late laying cycle[J]. Animal, 2022, 16(12): 100676.
[10] MCGLONE E R, BLOOM S R. Bile acids and the metabolic syndrome[J]. Annals of clinical biochemistry, 2019,56(3):326-337.
[11] YANG M, GU Y, LI L, et al. Bile acid-Gut microbiota axis in inflammatory bowel disease: From bench to bedside[J]. Nutrients, 2021, 13(9): 3143.
[12] LIN R, LIU W, PIAO M, et al. A review of the relationship between the gut microbiota and amino acid metabolism[J]. Amino acids, 2017, 49(12): 2083-2090.
[13] LI X, ZHENG S, WU G. Nutrition and metabolism of glutamate and glutamine in fish[J]. Amino acids, 2020, 52(5): 671-691.
[14] QI B, WANG J, MA Y B, et al. Effect of dietary β-alanine supplementation on growth performance, meat quality, carnosine content, and gene expression of carnosine-related enzymes in broilers[J]. Poultry science, 2018, 97(4): 1220-1228.
[15] HE W, FURUKAWA K, TOYOMIZU M, et al. Interorgan metabolism, nutritional impacts, and safety of dietary l-glutamate and l-glutamine in poultry[J]. Advances in experimental medicine and biology, 2021, 1332: 107-128.

