水禽細小病毒SYBR Green I熒光定量PCR檢測方法的建立與應用
汪宏才 商雨 馬瑤 曾哲 張蓉蓉 姚倫 羅玲 李麗 溫國元 羅青平
摘要:為了建立水禽細小病毒(WPV)快速檢測方法,根據序列比對結果在水禽細小病毒NS基因SF3保守區域內設計特異性引物,建立SYBR Green I熒光定量PCR通用檢測方法。該方法的擴增效率(E)為90.0%,相關系數(R2)=0.99,標準曲線方程為y=-3.607x+38.77;除WPV出現S形擴增曲線外,新城疫病毒(NDV)、H9亞型禽流感病毒(H9 AIV)、鴨坦布蘇病毒(DTMUV)、鴨肝炎病毒(DHAV)、鴨腸炎病毒(DEV)、鴨呼腸孤病毒(DRV)樣品均未出現S形陽性擴增曲線;批內變異系數(CV)為0.15%~0.23%,批間變異系數為0.09%~0.28%。結果表明,SYBR Green I熒光定量PCR檢測方法重復性好、靈敏度高和特異性強。臨床樣品檢測結果表明,SYBR Green I熒光定量PCR與普通PCR的符合率達98.4%,靈敏度是普通PCR的1 000倍。SYBR Green I熒光定量PCR檢測方法不僅能定性檢測WPV,還可以進行定量檢測,可用于種鴨場、種鵝場的WPV凈化檢測,也可用于WPV臨床大量樣品的快速檢測。
關鍵詞:水禽細小病毒;檢測方法;SYBR Green I;熒光定量PCR
中圖分類號:S855.3? ? ? ? ?文獻標識碼:A
文章編號:0439-8114(2024)06-0218-08
DOI:10.14088/j.cnki.issn0439-8114.2024.06.036 開放科學(資源服務)標識碼(OSID):
Establishment and application of a SYBR Green I fluorescence quantitative PCR detection method for waterfowl parvoviruses
WANG Hong-cai1,2,SHANG Yu1,2,MA Yao1a,ZENG Zhe1,2,ZHANG Rong-rong1,2,YAO Lun1,2,
LUO Ling1,2,Li Li1a,WEN Guo-yuan1,2,LUO Qing-ping1,2
(1a.Institute of Animal Husbandry and Veterinary; 1b. Key Laboratory of Animal Bacterial Disease Prevention and Control Formulations of the Ministry of Agriculture and Rural Affairs; 1c.Hubei Key Laboratory of Pathogenic Microbiology of Livestock and Poultry, Hubei Academy of Agricultural Sciences ,Wuhan 430064, China; 2. Hubei Hongshan Laboratory,Wuhan 430070, China)
Abstract: In order to establish a rapid detection method for waterfowl parvoviruses (WPV), specific primers were designed within the conserved SF3 region of the NS gene of waterfowl parvoviruses based on sequence alignment results, and a SYBR Green I fluorescence quantitative PCR universal detection method was established. The amplification efficiency (E) of this method was 90.0%, the correlation coefficient (R2) was 0.99, and the standard curve equation was y=-3.607x+38.77;except for WPV with an S-shaped amplification curve, the newcastle disease virus (NDV), H9 subtype avian influenza virus (H9 AIV), duck tembusu virus (DTMUV), duck hepatitis A virus (DHAV), duck enteritis virus (DEV), and duck reovirus (DRV) samples did not show an S-shaped positive amplification curve;the coefficient of variation (CV) within a batch was 0.15% to 0.23%, and the coefficient of variation between batches was 0.09% to 0.28%. The results indicated that the SYBR Green I fluorescence quantitative PCR detection method had good repeatability, high sensitivity, and strong specificity. The clinical sample testing results showed that the coincidence rate between SYBR Green I fluorescence quantitative PCR and conventional PCR was 98.4%, and the sensitivity was 1 000 times higher than that of conventional PCR. The SYBR Green I fluorescence quantitative PCR detection method could not only qualitatively detect WPV, but also quantitatively detect it. It could be used for WPV purification detection in duck and goose breeding farms, as well as for rapid detection of WPV in large clinical samples.
Key words: waterfowl parvoviruses; detection method; SYBR Green I; fluorescence quantitative PCR
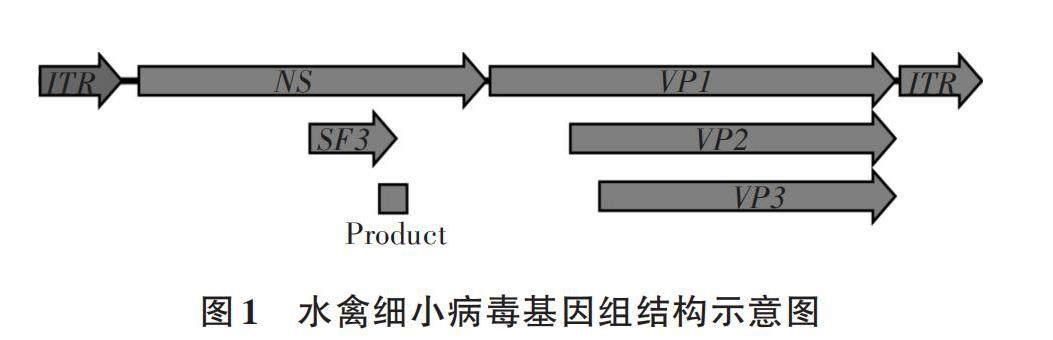
水禽細小病毒(Waterfowl parvoviruses,WPV)屬于雁形目依賴細小病毒1型(Anseriform dependoparvovirus 1)[1],包括鵝細小病毒(Goose parvovirus, GPV)、番鴨細小病毒(Muscovy duck parvovirus,MDPV)和鴨細小病毒(Duck parvovirus,DPV),三者在病毒形態、培養特性、理化性質及基因組結構等方面具有相似性,但致病性和抗原性卻存在很大差異[2]。GPV主要引起雛鵝和番鴨發病,MDPV僅引起番鴨發病,而對鵝、鴨等不致病,DPV是GPV變異株,主要引起鴨發生短喙侏儒綜合征(Short beak and dwarfism, SBDS)。WPV具有二十面體結構,無包膜,基因組為線性單鏈DNA,大小為4~6 kb[3]。基因組包含2個主要的開放閱讀框,編碼非結構蛋白(Non-structural protein, NS)和結構蛋白(Viral structural protein, VP)。最大的NS蛋白是一種多結構域蛋白,含有高度保守的解旋酶超家族3(Superfamily 3, SF3)結構域,具有解旋酶和ATP酶活性[4]。
為了準確快速診斷水禽細小病毒,國內外學者建立了多種檢測方法。早期建立的抗原抗體檢測方法主要有乳膠凝集法(Latex particle agglutination test, LPA)[5]、間接免疫熒光法(Immunofluorescence assay, IFA)[6]、ELISA法[7,8]等。而分子生物學檢測方法由于快捷方便、敏感性高、特異性強等特點,常用于病原的快速檢測,主要包含常規PCR方法、不同血清型鑒別診斷PCR方法[9,10]、基于VP3基因的熒光定量PCR檢測方法[11-13]等。
由于水禽細小病毒的基因具有變異快、易重組等特點,因此在診斷時很容易漏檢或造成假陰性。在缺少通用、快速檢測水禽細小病毒方法的情況下,建立一種通用型細小病毒SYBR Green I 熒光定量快速檢測方法,為水禽細小病毒進一步鑒定和分型提供初步診斷。該方法不僅特異性高、敏感性強,而且操作簡便、成本低廉。因此對臨床上水禽細小病毒的快速診斷具有重要意義。
1 材料和方法
1.1 材料
1.1.1 主要試劑 新城疫病毒(Newcastle disease virus, NDV)、H9亞型禽流感病毒(H9 subtype avian influenza virus, H9 AIV)、鴨坦布蘇病毒(Duck tembusu virus, DTMUV)、鴨肝炎病毒(Duck hepatitis A virus, DHAV)、鴨腸炎病毒(Duck enteritis virus, DEV)、鴨呼腸孤病毒(Duck reovirus, DRV)和水禽細小病毒(WPV)均由湖北省農業科學院畜牧獸醫研究所分離保存。AxyPrep Body Fluid Viral DNA/RNA Miniprep Kit試劑盒購自康寧生命科學(吳江)有限公司;Plasmid Mini Kit I試劑盒、Gel Extraction Kit試劑盒購自OMEGA BIO-TEK公司;pMD18-T載體、E.coli DH5α感受態細胞購自寶日醫生物技術(北京)有限公司;2×Rapid Taq Master Mix、AceQ Universal SYBR qPCR Master Mix購自南京諾唯贊生物科技股份有限公司。
1.1.2 主要儀器 SimpliAmp PCR儀為Thermo Fisher公司產品,Light Cycler 96實時熒光定量PCR系統為Roche公司產品。
1.2 方法
1.2.1 引物設計 根據GenBank上公開的WPV基因組序列,通過序列多重比對,在保守區設計引物,用于熒光定量PCR試驗。
1.2.2 陽性標準品制備 按照試劑盒說明書提取DNA,并以GPV DNA為模板,使用“1.2.1”中設計的引物,通過2×Rapid Taq Master Mix進行PCR反應擴增目的片段。反應體系(50.0 μL):Rapid Taq Master Mix 25.0 μL,Forward Primer 2.0 μL,Reverse Primer 2.0 μL,DNA 4.0 μL,ddH2O 17.0 μL。反應程序:95 ℃預變性5 min;95 ℃變性10 s,55 ℃退火10 s,72 ℃延伸10 s,35個循環;72 ℃延伸5 min,4 ℃保存。
PCR產物經1.5%瓊脂糖凝膠電泳后,切取目的片段,回收純化后克隆至pMD18-T載體上,轉化至DH5α感受態細胞中,送至生工生物工程(上海)股份有限公司進行測序鑒定。測序正確后提取陽性質粒pMD18-NS作為陽性標準品,檢測其濃度并計算陽性標準品的拷貝數。
1.2.3 熒光定量反應條件與標準曲線的建立 將重組質粒pMD18-NS按10倍梯度進行稀釋。SYBR Green I熒光定量PCR反應體系(20.0 μL):2×AceQ Universal SYBR qPCR Master Mix 10.0 μL,上下游引物(10 μmol/L)各0.5 μL,模板DNA 1.0 μL,ddH2O補充至20.0 μL。反應條件:95 ℃預變性10 min;95 ℃變性10 s,60 ℃退火30 s,40個循環。熔解曲線反應:65 ℃到95 ℃,每個循環溫度增加0.5 ℃,孵育時間保持20 s。
1.2.4 重復性試驗 將陽性標準品進行10倍梯度稀釋,取10-3、10-5、10-7 3個稀釋度的標準品作為生物學重復,用建立的SYBR Green I熒光定量檢測方法進行檢測。同時每個樣品設置3個技術重復。根據Ct計算批內(技術重復)和批間(生物學重復)的變異系數,檢驗建立方法的重復性。
1.2.5 特異性試驗 提取NDV、H9 AIV、DTMUV、DHAV、DEV、DRV和WPV的DNA/RNA后,將RNA反轉錄成cDNA,利用本試驗建立的熒光定量檢測方法,對上述病毒cDNA進行檢測,驗證建立方法的特異性。
1.2.6 靈敏度檢測 將陽性標準品進行10倍梯度稀釋,按“1.2.3”中反應體系和反應條件進行SYBR Green I熒光定量PCR反應,并設立陰性對照。儀器的最低檢測量即為該方法的靈敏度。
1.2.7 通用性檢測 提取GPV、MDPV和DPV 3種病毒的DNA,使用建立的檢測方法進行通用性驗證。
1.2.8 臨床樣品的檢測 為了驗證建立的熒光定量檢測方法與常規PCR檢測方法的符合率,使用新建的熒光定量PCR方法對實驗室保存的湖北省、安徽省、湖南省等地區送檢的128份疑似水禽細小病毒感染發病的臨床樣品進行檢測,同時使用普通PCR進行對比驗證,計算2種檢測方法的符合率。
2 結果與分析
2.1 引物設計
根據GenBank上公開的GPV、DPV、MDPV基因組序列,下載386條完整的WPV核苷酸序列,使用Muscle[14]軟件進行多重比對,選擇非結構蛋白NS解旋酶(SF3)基因附近保守區域(圖1),使用Primer Premier 5軟件,設計了一組熒光定量PCR特異性擴增引物,Forward Primer:5′-TACAATGGAACACAGAATWCC-3′,Reverse Primer:5′-TCAGACACAACAGGAACWA-3′,擴增片段大小為150 bp。
2.2 陽性標準品制備
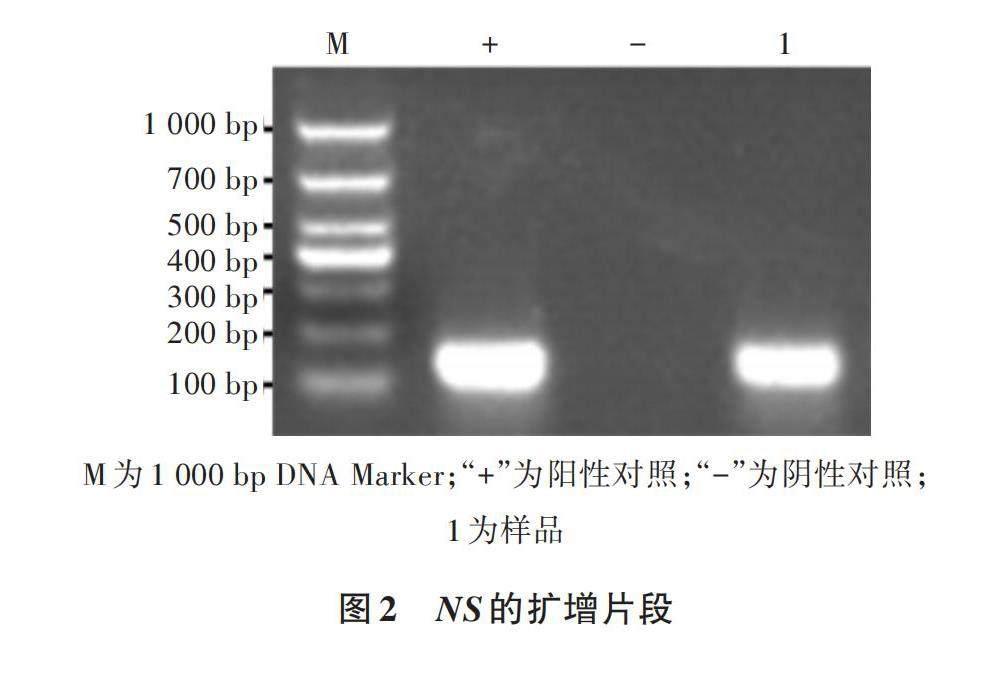
采用“2.1”中設計的引物進行擴增,目的條帶大小為150 bp,與預期大小相同(圖2)。將目的片段回收純化,連接到pMD18-T載體上,得到重組質粒pMD18-NS,轉化至DH5α感受態細胞后,經測序鑒定正確后,提取質粒作為陽性標準品,經測定質粒濃度為298.9 ng/μL,拷貝數為9.59×1010 copies/μL。
2.3 熒光定量反應條件與標準曲線的建立
將構建成功的重組質粒pMD18-NS,按10倍梯度進行稀釋。選取10-7~10-3共5個稀釋度的標準品,每個稀釋度設3個樣品重復,按照“1.2.3”的反應體系和反應條件進行擴增,擴增正常(圖3),標準曲線如圖4所示。結果顯示,本方法擴增效率(E)為90.0%,R2=0.99,標準曲線的方程為y=-3.607x+38.77。熔解曲線(圖5)顯示,在79.00 ℃有單一峰,表明擴增產物特異性好。
2.4 重復性試驗
由表1可知,批內變異系數(CV)在0.15%~0.23%。通過3個生物學重復試驗測定批間變異系數,為0.09%~0.28%。建立的熒光定量PCR檢測方法,批內和批間變異系數均低于0.30%,表明SYBR Green I熒光定量PCR檢測方法重復性好、穩定性高。
2.5 特異性試驗
用建立的SYBR Green I熒光定量檢測方法對實驗室保存的NDV、H9 AIV、DTMUV、DHAV、DEV、DRV和WPV進行檢測,除WPV出現S形擴增曲線、結果呈陽性外,其他樣品均未出現S形陽性擴增曲線,結果呈陰性(圖6)。
2.6 靈敏度檢測
由圖7可知,當樣品稀釋度為10-6時可以看到PCR條帶,當樣品稀釋度為10-7時無肉眼可見的條帶出現。而建立的熒光定量PCR方法,當樣品稀釋至10-9時,對應的質粒拷貝數為95.9 copies/μL,仍出現S形擴增曲線,而陰性對照無擴增曲線。結果表明SYBR Green I熒光定量PCR檢測方法靈敏度較高,靈敏度是普通PCR的1 000倍。
2.7 通用性驗證
提取實驗室分離鑒定的3種水禽細小病毒GPV、MDPV和DPV的DNA后,采用“1.2.3”中反應體系和反應程序,驗證該方法對WPV的通用性,結果如圖8所示。GPV、MDPV和DPV都出現S形擴增曲線,陰性對照無擴增。
2.8 臨床樣品的檢測
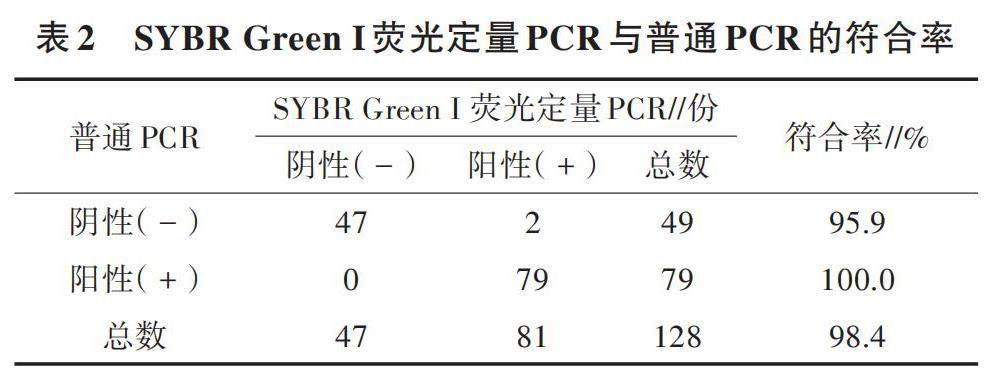
采用SYBR Green I熒光定量PCR檢測方法對湖北省、安徽省、湖南省等地區送檢的蛋鴨、番鴨、鵝128份臨床樣品進行檢測,同時使用普通PCR進行驗證,計算2種檢測方法的符合率。由表2可知,SYBR Green I熒光定量PCR與普通PCR的符合率達98.4%。
3 討論
近年來,水禽生產上細小病毒的發病率一直居高不下,病毒在環境中受到自然選擇壓力的作用,產生基因突變或重組,并能突破種間屏障實現跳躍式進化,造成新的基因型不斷出現。基因重組是病毒遺傳變異和進化的主要手段,尤其是細小病毒VP基因,極易發生重組。GPV DY16株可能由匈牙利的B株和國內弱毒疫苗SYG61v株參與的重組毒株,重組區域主要發生在VP1基因內部[15],MDPV JH10株為經典型MDPV和GPV之間的重組產物,主要在VP3基因中通過重組獲得不同來源的GPV序列[16]。MDPV NY18株是多個病毒之間重組的產物,以典型MDPV YY株為主要親本,經典型GPV強毒株DY16株和鵝胚化的弱毒疫苗株SYG61v株作為次要親本參與了重組,重組區域主要發生在VP1和VP3區域[17]。
早期研究發現VP3蛋白是細小病毒的主要抗原蛋白,含量約占整個病毒粒子的80%[18],因此常將VP3基因的同源性作為細小病毒分類的主要依據。很多學者在VP3區域設計引物,建立了LAMP快速檢測方法[19,20]、多聯PCR檢測方法[21]等。早期也有學者[22]針對WPV在鵝和番鴨中傳播,在ITR區域設計引物和探針,建立了探針法熒光定量PCR檢測方法。VP3基因編碼結構蛋白,易突變和重組;ITR區域為高GC區域,易形成發夾結構。NS基因相對保守,更具有種屬特征,尤其是SF3基因序列更具有保守性,因此,在NS基因上設計檢測引物,檢測水禽細小病毒。
本研究根據NS基因保守序列設計引物,建立SYBR Green I熒光定量PCR檢測方法,其特異性強、靈敏度高,與普通PCR的符合率達98.4%,靈敏度是普通PCR的1 000倍。SYBR Green I熒光定量PCR檢測方法不僅能定性檢測WPV,還可以進行定量檢測,可用于種鴨場、種鵝場的WPV凈化檢測,也可用于WPV臨床快速診斷。同時,由于SYBR Green I熒光定量PCR檢測方法具有精準、快速的特點,因此更適用于臨床大量樣品的快速檢測。
參考文獻:
[1] WO?NIAKOWSKI G, KOZDRU? W, SAMOREK-SALAMONOWICZ E. Genetic variance of Derzsys disease strains isolated in Poland[J]. Journal of molecular & genetic medicine, 2009,3(2): 210-216.
[2] CHEN Y, AFUMBA R, PANG F, et al. Advances in research on genetic relationships of waterfowl parvoviruses[J]. Journal of veterinary research, 2021,65(4): 391-399.
[3] COTMORE S F, AGBANDJE-MCKENNA M, CANUTI M, et al. ICTV virus taxonomy profile: Parvoviridae[J]. Journal of general virology, 2019,100(3): 367-368.
[4] P?NZES J J, S?DERLUND-VENERMO M, CANUTI M, et al. Reorganizing the family Parvoviridae:A revised taxonomy independent of the canonical approach based on host association[J]. Archives of virology, 2020,165(9): 2133-2146.
[5] 朱小麗, 陳少鶯, 林鋒強, 等. 應用膠乳凝集技術診斷番鴨小鵝瘟病[J]. 中國預防獸醫學報, 2012,34(9): 715-718.
[6] 俞 博, 朱小麗, 程曉霞, 等. 應用間接免疫熒光法診斷鴨短嘴矮小綜合征[J]. 福建農業學報, 2017,32(12): 1332-1334.
[7] 宮曉華. 新型鴨細小病毒DS-15株生物學特性研究及間接ELISA方法的建立[D]. 合肥:安徽農業大學, 2017.
[8] 劉 銘. 鴨細小病毒抗體ELISA檢測方法的建立及卵黃抗體的制備[D]. 河北保定:河北農業大學, 2020.
[9] 劉家森, 姜 騫, 司昌德, 等. 番鴨細小病毒與鵝細小病毒PCR鑒別診斷方法的建立[J]. 中國獸醫科學, 2007(6): 469-472.
[10] WAN C, CHENG L, CHEN C, et al. A duplex PCR assay for the simultaneous detection and differentiation of Muscovy duck parvovirus and goose parvovirus[J]. Molecular and cellular probes, 2019,47: 101439.
[11] 周潔文, 湯傲星, 戚睿斌, 等. 新型鴨細小病毒SYBR Green I 熒光定量PCR檢測方法的建立及初步應用[J]. 中國動物傳染病學報, 2020,28(4): 47-51.
[12] NIU X, CHEN H, YANG J, et al. Development of a TaqMan-based real-time PCR assay for the detection of Novel GPV[J]. Journal of virological methods, 2016,237: 32-37.
[13] 曹旭陽, 王宇飛, 張志飛, 等. 鴨源新型鵝細小病毒TaqMan熒光定量PCR方法的建立及初步應用[J]. 中國動物傳染病學報, 2020,28(5): 31-36.
[14] EDGAR R C. MUSCLE:Multiple sequence alignment with high accuracy and high throughput[J]. Nucleic acids research, 2004,? ? 32(5): 1792-1797.
[15] 賈婧宇, 凌玨怡, 王志仙, 等. 鵝細小病毒DY16株的分子鑒定及重組分析[J]. 中國獸醫學報, 2019,39(5): 848-852.
[16] 王志仙, 秘清靈, 凌玨怡, 等. 重組型番鴨細小病毒JH10株的分子特征解析[J]. 中國動物傳染病學報, 2020,28(2): 66-71.
[17] 鮑 芳, 秘清靈, 徐靜雯, 等. 1株重組型番鴨細小病毒的分子特征解析[J]. 中國獸醫學報, 2021,41(1): 33-37.
[18] TU M, LIU F, CHEN S, et al. Role of capsid proteins in parvoviruses infection[J]. Virology journal, 2015,12: 114.
[19] 尚 毅, 董嘉文, 孫敏華, 等. 鵝細小病毒LAMP快速檢測方法的建立[J]. 華南農業大學學報, 2011,32(1): 98-102.
[20] 王 耕, 田克恭, 張 薇, 等. 鴨細小病毒實時熒光LAMP檢測方法的建立與應用[J]. 畜禽業, 2022,33(3): 6-8.
[21] 季艷菊, 王林川. 番鴨三種細小病毒多聯PCR檢測方法的建立與初步應用[J]. 中國動物檢疫, 2016,33(4): 85-90.
[22] WO?NIAKOWSKI G, SAMOREK-SALAMONOWICZ E, KOZDRU? W. Quantitative analysis of waterfowl parvoviruses in geese and Muscovy ducks by? real-time polymerase chain reaction: correlation between age, clinical symptoms and DNA copy number of waterfowl parvoviruses[J]. BMC veterinary research, 2012,8: 29.

