隔藥餅灸對動脈粥樣硬化兔血清Ox-LDL、IFN-γ表達的影響
〔摘要〕 目的 觀察隔藥餅灸對動脈粥樣硬化(atherosclerosis, AS)兔血清氧化低密度脂蛋白(oxidized low-density lipoprotein,Ox-LDL)、干擾素(interferon-γ, IFN-γ)的影響,探討隔藥餅灸抗AS的作用機制。方法 將18只新西蘭兔隨機分為正常組、模型組、隔藥餅灸組,每組6只。正常組給予普通飼料喂養,其余2組給予高脂飼料喂養,其中隔藥餅灸組邊造模邊干預:2組穴位(巨闕、天樞、豐隆;心俞、肝俞、脾俞)交替行隔藥餅灸干預,每穴灸4壯,每日1次,干預12周。HE染色觀察主動脈組織病理變化,比色法檢測總膽固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白膽固醇(low density liporotein cholesterol, LDL-C)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol, HDL-C)含量,ELISA法檢測Ox-LDL、IFN-γ含量。結果 與正常組比,模型組主動脈內皮明顯增厚,平滑肌排列絮亂,泡沫細胞大量聚集,血清TC、TG、LDL-C、Ox-LDL、IFN-γ含量均顯著升高(P<0.05,P<0.001),HDL-C含量顯著下降(P<0.001)。與模型組比,隔藥餅灸組主動脈內皮結構完整,平滑肌排列整齊,少見泡沫細胞,血清TC、TG、LDL-C、ox-LDL、IFN-γ含量均顯著下降(P<0.05,P<0.01,P<0.001),HDL-C含量明顯升高(P<0.05)。結論 隔藥餅灸可能通過降低AS兔血清Ox-LDL、IFN-γ含量,減少巨噬細胞脂質攝取,抑制泡沫細胞形成,發揮抗AS的作用。
〔關鍵詞〕 動脈粥樣硬化;隔藥餅灸;氧化低密度脂蛋白;干擾素-γ;泡沫細胞;脂質
〔中圖分類號〕R245 〔文獻標志碼〕A 〔文章編號〕doi:10.3969/j.issn.1674-070X.2024.09.009
Effects of moxibustion on medicines on serum expressions of Ox-LDL and IFN-γ in rabbits with atherosclerosis
YI Hongfen1, CHEN Xinyu1, PENG Han1, XIAO Mengxia1, OUYANG Lizhi1, LIU Honghua2*, LIU Mailan1*
1. School of Acupuncture-moxibustion, Tuina and Rehabilitation, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. School of Nursing, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To observe the effects of moxibustion on medicines on serum levels of oxidized low-density lipoprotein (Ox-LDL) and interferon-γ (IFN-γ) in rabbits with atherosclerosis (AS), and to explore the anti-AS mechanism of moxibustion on medicines. Methods Eighteen New Zealand rabbits were randomly divided into normal group, model group, and moxibustion on medicines group, with six rabbits in each group. The normal group was fed a normal diet, while the other two groups were fed a high-fat diet. The moxibustion on medicines group received intervention during the modeling process. Alternating moxibustion on medicines was applied to two sets of acupoints ["Juque" (CV14), "Tianshu" (S25), "Fenglong" (S40); "Xinshu" (BL15), "Ganshu"(BL18), and "Pishu"(BL20)] , with four cones per acupoint, once daily for 12 weeks. The pathological changes of aorta were observed using HE staining. Total cholesterol (TC), triglyceride (TG), low density liporotein cholesterol (LDL-C), and high density lipoprotein cholesterol (HDL-C) content were measured by colorimetric method. Ox-LDL and IFN-γ levels were determined by ELISA. Results Compared with the normal group, the model group showed significant thickening of the aortic endothelium, disordered arrangement of smooth muscle cells, and massive accumulation of foam cells. Serum content of TC, TG, LDL-C, Ox-LDL, and IFN-γ were significantly elevated (P<0.05, P<0.001), while HDL-C content was significantly lower (P<0.001). Compared with the model group, the moxibustion on medicines group showed intact aortic endothelial structure, orderly arrangement of smooth muscle cells, and rare foam cells. Serum content of TC, TG, LDL-C, ox-LDL, and IFN-γ were significantly lower (P<0.05, P<0.01, P<0.001), while HDL-C content was significantly higher (P<0.05). Conclusion Moxibustion on medicines may exert anti-AS effects by decreasing serum content of Ox-LDL and IFN-γ in rabbits with AS, thereby reducing macrophage lipid uptake and inhibiting the formation of foam cells.
〔Keywords〕 atherosclerosis; moxibustion on medicines; oxidized low density lipoprotein; interferon-γ; foam cells; lipids
動脈粥樣硬化(atherosclerosis, AS)是由多因素導致的一種炎性致病性動脈疾病,是心血管疾病的主要發病原因。研究表明,動脈血管壁內血脂代謝紊亂,富含脂質的泡沫細胞形成與聚集是AS早期主要病變特征[1]。泡沫細胞釋放大量炎性細胞因子、基質金屬蛋白酶及其他炎癥介質,促進AS炎癥反應[2]。同時,泡沫細胞在血管壁內堆積形成脂質條紋,參與粥樣斑塊形成[3]。研究發現,巨噬細胞吞噬大量的氧化低密度脂蛋白(oxidized low-density lipoprotein, Ox-LDL)和巨噬細胞膽固醇流出的不平衡會促進泡沫細胞的形成[4-5]。Ox-LDL作為致AS的關鍵脂蛋白,促使巨噬細胞轉變為泡沫細胞,釋放炎性因子,導致動脈血管炎癥和粥樣斑塊形成[6]。干擾素(interferon-γ, IFN-γ)是經典的巨噬細胞激活因子,啟動巨噬細胞促進Ox-LDL攝取,并通過信號傳導通路介導巨噬細胞脂質代謝,阻礙膽固醇反向轉運,促進脂質超載和泡沫細胞形成[7]。
中醫學認為,AS歸屬于“胸痹”“脈痹”“偏枯”等疾病范疇,其病機為本虛標實,以臟腑虧虛為本,以痰瘀毒邪為標,痰瘀互結是AS的主要病理機制,辨治多從痰、瘀、毒入手[8-9]。隔藥餅灸是一種綜合性的中醫傳統特色療法,采用活血化瘀、行氣導滯、化痰通絡的藥餅配方(丹參、山楂、澤瀉、大黃、郁金)和強心利脈、化痰除濕、去瘀排毒的臟腑辨證取穴處方(心俞、脾俞、肝俞、巨闕、天樞、豐隆)[10],可降低血脂水平,調節脂質代謝[11-12],抑制炎癥反應[13-14]。但隔藥餅灸抗炎、抗AS的具體作用機制還需進一步闡明。本研究觀察隔藥餅灸對血清Ox-LDL、IFN-γ表達的影響,探討隔藥餅灸抗AS的作用機制。
1 材料與方法
1.1 動物與分組
3月齡普通級新西蘭純種兔18只,雄性,體質量1.5~2.5 kg,購自湖南太平生物有限公司[動物許可證號:SCXK(湘)2020-0005]。每只兔分籠圈養于湖南中醫藥大學動物中心實驗室,飼養溫度20~25 ℃,濕度50%~70%。
1.2 主要儀器與試劑
酶標儀(美國Thermo公司,型號:MultiskanFC);石蠟包埋機、手動輪轉式切片機(德國萊卡公司,型號分別為EG1150、HistoCore BIOCUT R);倒置熒光顯微鏡(德國蔡司公司,型號:Axio Vert. A1);高速低溫離心機(美國Scilogex公司,型號:D3024R)。
蘇木素-伊紅染液(武漢谷歌生物科技有限公司,批號:G1005);4%組織細胞固定液(北京索萊寶科技有限公司,批號:P1110);乙醇、二甲苯(中國醫藥集團有限公司,批號分別為10009257、100234192);甘油三酯(triglyceride, TG)測定試劑盒、總膽固醇(total cholesterol, TC)測定試劑盒、低密度脂蛋白膽固醇(low density liporotein cholesterol, LDL-C)測定試劑盒、高密度脂蛋白膽固醇(high density lipoprotein cholesterol, HDL-C)測定試劑盒(南京建成生物工程研究所,批號分別為A110-1-1、A111-1-1、A113-1-1、A112-1-1);IFN-γ ELISA試劑盒、Ox-LDL ELISA試劑盒(武漢Elabscience公司,批號分別為E-EL-R0009c、E-EL-H6021)。
1.3 分組與造模
18只實驗兔適應性喂養1周后,將其隨機分為正常組、模型組、隔藥餅灸組,每組6只。正常組喂養普通飼料12周,模型組與隔藥餅灸組采用高膽固醇飲食喂養120 g/d,其中隔藥餅灸組邊造模邊干預,連續12周。高膽固醇飲食配方:膽固醇1%、蛋白粉10%、豬油5%、正常粗顆粒飼料84%、丙硫氧嘧啶[10 mg/(kg·d)]。AS模型成功標準[15]:兔TC值高于正常血清TC含量(1~2 mmol/L)3倍以上,血清TG和LDL-C顯著升高(P<0.05),且解剖可見腹主動脈有脂質粥樣斑塊凸出。
1.4 干預方法
將隔藥餅灸組兔以仰臥位捆綁于固定臺上,參照《實驗針灸學》,并根據兔子骨骼和體型取巨闕、天樞(雙側)、豐隆(雙側)、心俞(雙側)、肝俞(雙側)、脾俞(雙側),穴位處局部剪毛,穴位聚維酮碘溶液消毒后涂抹凡士林并沾上厚0.5 cm、直徑1 cm的藥餅(將丹參、山楂、郁金、大黃、澤瀉按照等比例進行粉碎成末),將0.5 cm的艾炷放在藥餅上點燃施灸,待艾炷燃盡后更換另一壯,每穴連續灸4壯,每日1次,兩組穴位(Ⅰ組:巨闕、天樞、豐隆;Ⅱ組:心俞、肝俞、脾俞)隔日交替施灸,連續治療12周。
1.5 標本采集
3%戊巴比妥鈉(1 mL/kg)經兔耳緣靜脈麻醉注射,取腹主動脈血液樣本,3 000 r/min半徑16 cm離心15 min,分離血清,置于-80 ℃冰箱中保存。取血后將主動脈及其根部相連心臟組織一同取出,PBS反復漂洗,并用2 mL無菌凍存管采集主動脈組織,置入干冰,所有樣本采集結束即刻轉入-80 ℃冰箱保存。
1.6 指標檢測
1.6.1 HE染色觀察腹主動脈組織病理變化 將兔腹主動脈組織用4%多聚甲醛固定,依次放入乙醇、二甲苯Ⅰ、二甲苯Ⅱ進行脫水,石蠟包埋、成塊切片,烘干脫蠟并進行蘇木精、伊紅染色,中性樹膠封片后于顯微鏡下分析主動脈組織形態。
1.6.2 比色法檢測TC、TG、LDL-C、HDL-C含量 分別取各組兔血液樣本10 μL,依次加入TC、TG、LDL-C、HDL-C試劑盒中的工作液1 mL,混勻,取200 μL混合液轉移至96孔板,37 ℃孵育10 min。酶標儀在510 nm波長下檢測各孔的吸光度值。根據公式計算各指標含量:指標含量=[(樣本吸光度值-空白吸光度值)/(標準對照吸光度值-空白吸光度值)]×標準品濃度。
1.6.3 ELISA法檢測Ox-LDL、IFN-γ含量 取出血清樣品,置于冰上融化,將Ox-LDL、IFN-γ標準品離心,加入稀釋液配制成所需濃度的工作液,確保標準品完全溶解并混勻。向微孔板的標準孔和測試孔中分別加入標準品和待測樣品,封板后在37 ℃下孵育90 min,去除孵育液,加入生物素化抗體工作液,孵育60 min。反復洗滌后加入酶結合物工作液,孵育30 min,并用底物溶液TMB進行顯色,之后加入終止液停止反應。在450 nm波長下測量各孔的吸光度值,最后根據標準曲線,計算每個組織的指標含量。
1.7 統計學分析
采用SPSS 25.0統計軟件進行數據分析,所有檢測數據均以“x±s”表示。組間比較時,若數據符合正態性且方差齊,則采用LSD法,若方差不齊則使用Tamhane方法進行方差分析;若數據不符合正態分布,則選擇秩和檢驗進行分析。P<0.05時,認為差異具有統計學意義。
2 結果
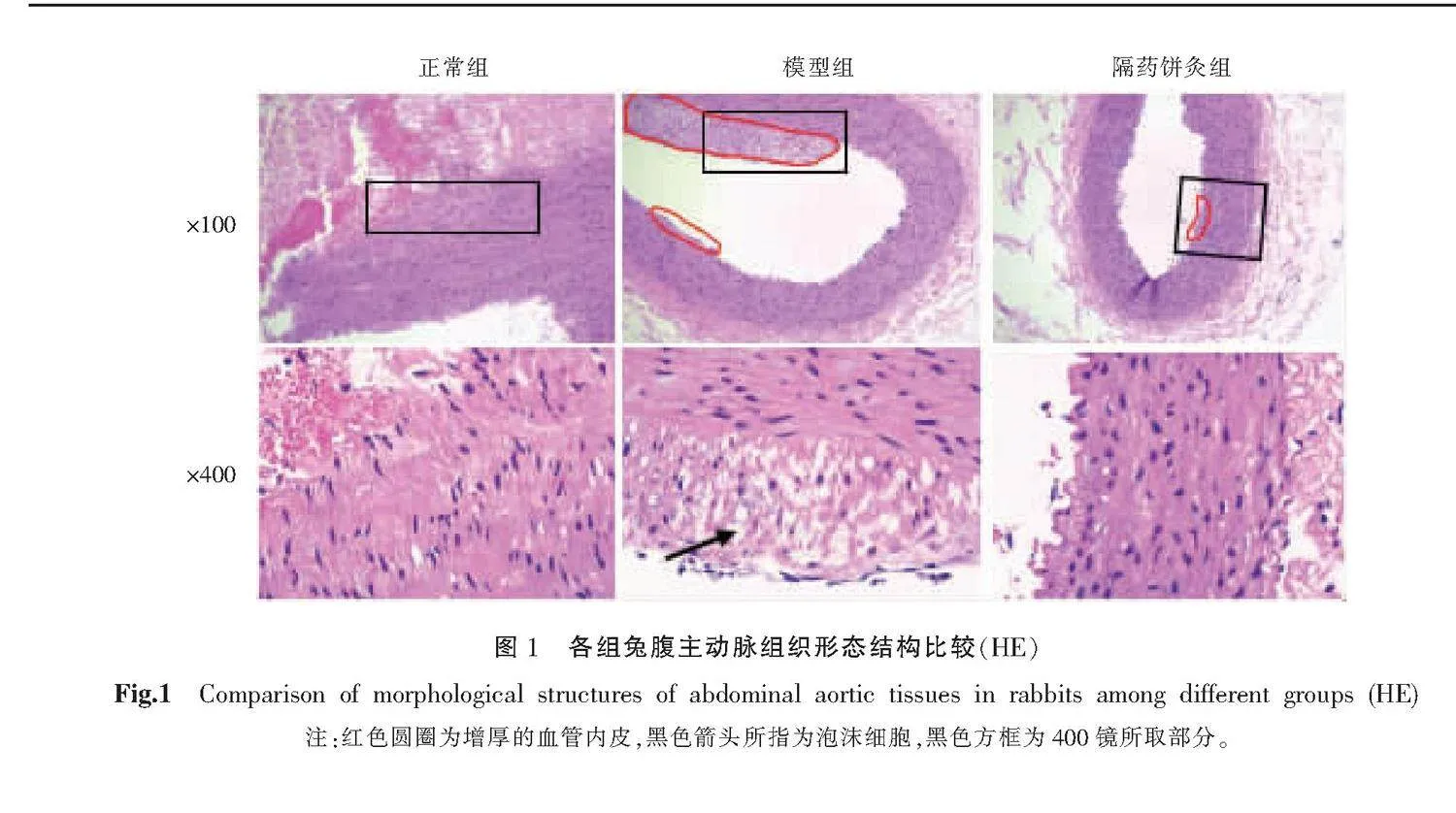
2.1 各組兔腹主動脈組織病理變化
正常組:主動脈血管內皮結構完整,中膜平滑肌細胞排列整齊;模型組:主動脈血管內皮明顯增厚,中膜平滑肌排列絮亂,泡沫細胞大量聚集;隔藥餅灸組:主動脈血管內皮結構完整,血管中膜平滑肌排列整齊,血管內皮增厚被抑制,少見泡沫細胞。詳見圖1。
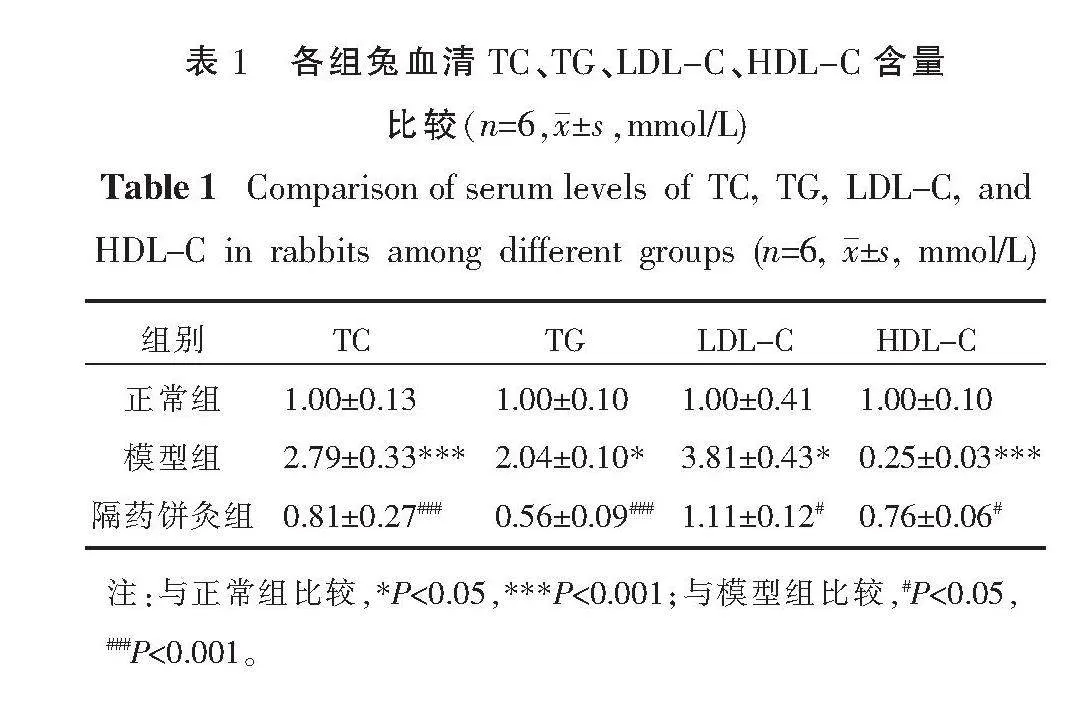
2.2 各組兔血清TC、TG、LDL-C、HDL-C含量變化
與正常組相比,模型組血清TC、TG、LDL-C含量均升高(P<0.05,P<0.001),HDL-C含量顯著下降(P<0.001);與模型組相比,隔藥餅灸組血清TC、TG、LDL-C含量均下降(P<0.05,P<0.001),HDL-C含量升高(P<0.05)。詳見表1。
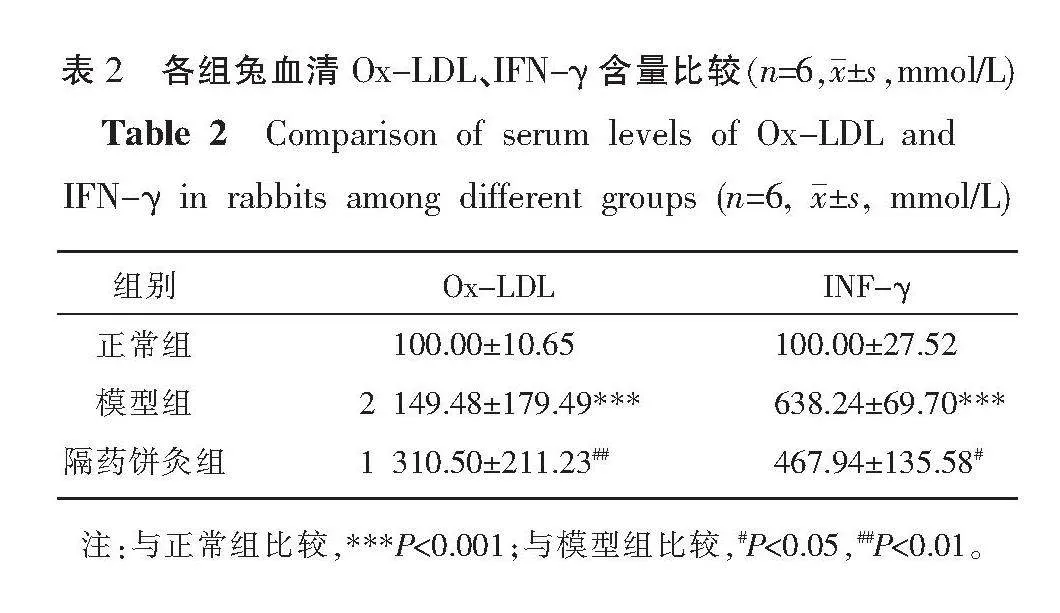
2.3 各組兔血清Ox-LDL、IFN-γ含量變化
與正常組相比,模型組兔血清Ox-LDL、IFN-γ含量均明顯上升(P<0.001);與模型組相比,隔藥餅灸組Ox-LDL、IFN-γ含量均下降(P<0.05,P<0.01)。詳見表2。
3 討論
AS是一種以脂質代謝失常為特征的慢性炎性動脈疾病,其病變過程涉及動脈內膜的脂質沉積、泡沫細胞積聚、炎性細胞浸潤及粥樣斑塊形成。目前,AS模型建立的方法主要為單純高脂飼料喂養,高脂飼料喂養引起的血脂水平異常是導致AS的主要因素[16]。兔在脂肪代謝和AS病變演化等方面與人類相似,通過表達血漿膽固醇酯轉移蛋白(cholesteryl ester transfer protein,CETP),增加對膽固醇的敏感性,并且經高脂飼料喂養后可快速形成粥樣斑塊[17-18]。新西蘭兔因其性格溫順,有較強的適應性、繁殖性及抗病力等特點,成為AS模型中最常用的模型動物。研究表明,AS模型制備成功的標準主要以血脂水平變化和病理形態學顯示粥樣斑塊為主,而血脂指標主要包括TC、TG、LDL-C、HDL-C等[19-20]。本研究以新西蘭兔為研究對象,采用高脂飼料喂養12周,其結果顯示,與正常組比,模型組血清TC、TG、LDL-C均明顯升高,HDL-C明顯降低,HE染色見大量泡沫細胞和脂質斑塊形成,提示AS模型制備成功。
脂質代謝紊亂是AS的主要病理基礎,血脂異常是其最常見的危險因素,故目前AS的治療手段主要以調節血脂為主。周莉等[21]發現,神闕透刺結合中藥治療可調整肥胖伴高脂血癥患者的脂質代謝,具有減肥和降脂的雙重作用。楊海艷[22]在治療老年冠狀AS性心臟病并高同型半胱氨酸的研究中發現,溫針灸結合西藥常規治療可顯著降低其血脂水平。徐驲等[23]通過研究發現,健脾化濁調脂顆粒可降低AS患者TC、TG、LDL-C水平,提高HDL-C水平,改善其血脂狀態,發揮治療AS的作用。本課題組前期研究表明,隔藥餅灸能有效降低血清TC、TG、LDL-C等含量,升高HDL-C含量,調節血脂水平與脂質代謝,發揮抗AS的作用[11-12, 24]。本研究結果顯示,與模型組比,隔藥餅灸組TC、TG、LDL-C明顯降低,HDL-C明顯升高,與前期研究結果一致,表明隔藥餅灸可通過調節血脂水平影響AS的發展。
泡沫細胞形成與聚集是AS病變的關鍵環節,泡沫細胞參與AS炎癥反應和粥樣斑塊形成,促進AS的發展。研究發現,泡沫細胞的形成是巨噬細胞脂質攝取與流出的動態失衡而導致,這與Ox-LDL增加、膽固醇流出減少等因素密切相關[3]。Ox-LDL作為AS早期發病關鍵分子,經LDL在血管內皮下累積及其氧化修飾形成,與清道夫受體(scavenger receptors, SRS)結合增加單核細胞-內皮細胞黏附[25-26],加速巨噬細胞泡沫化[27]。凝集素樣氧化低密度脂蛋白受體-1(lectin-like oxidized low-density lipoprotein receptor-1,LOX-1)是Ox-LDL在內皮細胞中的主要受體,Ox-LDL與LOX-1結合,介導細胞間黏附分子1、血管細胞黏附分子1等多種黏附分子和趨化因子的釋放,促進巨噬細胞吞噬大量的Ox-LDL,使Ox-LDL在巨噬細胞累積,形成泡沫細胞[28-29]。研究發現,Ox-LDL與清道夫受體CD36結合,可激活絲裂原活化激酶1和絲裂原活化激酶2,上調CD36表達,進一步促進Ox-LDL的攝取,加速巨噬細胞向泡沫細胞分化[30]。
IFN-γ是一種與先天免疫和適應性免疫有關的關鍵細胞因子,由T細胞和巨噬細胞產生,已在AS患者的冠狀動脈中檢測到[31]。IFN-γ可增加趨化因子CXC配體16和清道夫受體A的表達,啟動巨噬細胞產生趨化因子和細胞毒性分子,促進巨噬細胞攝取Ox-LDL形成泡沫細胞[32]。此外,研究發現,IFN-γ通過信號轉導與轉錄激活因子1依賴性途徑抑制ATP結合盒轉運子A1表達[33],減少巨噬細胞載脂蛋白E合成[34],從而減少膽固醇流出。DONG等[35]證實,IFN-γ可減輕巨噬細胞中腺嘌呤核苷三磷酸結合盒亞家族G成員1介導的膽固醇外流,導致巨噬細胞中的膽固醇累積,促進泡沫細胞的生成。本研究結果發現,與正常組比,模型組血清Ox-LDL、IFN-γ顯著上升;與模型組比,隔藥餅灸組Ox-LDL、IFN-γ明顯下降。這提示隔藥餅灸可能通過降低AS血清Ox-LDL、IFN-γ的表達,減少巨噬細胞對Ox-LDL的攝取及細胞內膽固醇的累積,降低巨噬細胞內脂質堆積,抑制泡沫細胞形成,從而發揮抗AS的作用。
綜上所述,隔藥餅灸可調節AS血脂水平,可能通過降低AS兔血清Ox-LDL、IFN-γ含量,抑制泡沫細胞形成,緩解AS進程,發揮抗AS的作用。
參考文獻
[1] GOLIA E, LIMONGELLI G, NATALE F, et al. Inflammation and cardiovascular disease: From pathogenesis to therapeutic target[J]. Current Atherosclerosis Reports, 2014, 16(9): 435.
[2] LISCO G, GIAGULLI V A, DE PERGOLA G, et al. The pathogenic role of foam cells in atherogenesis: Do they represent novel therapeutic targets?[J]. Endocrine, Metabolic & Immune Disorders Drug Targets, 2022, 22(7): 765-777.
[3] 劉子歌, 劉 洋, 宋國瑞, 等. 泡沫細胞在動脈粥樣硬化形成過程中的作用研究進展[J]. 陜西醫學雜志, 2020, 49(10): 1363-1366, 封3.
[4] LUSIS A J. Atherosclerosis[J]. Nature, 2000, 407(6801): 233-241.
[5] SHASHKIN P, DRAGULEV B, LEY K. Macrophage differentiation to foam cells[J]. Current Pharmaceutical Design, 2005, 11(23): 3061-3072.
[6] 李玉成, 楊 楠, 海鵬麗. 氧化低密度脂蛋白及脂聯素在動脈粥樣硬化中的作用研究進展[J]. 國際檢驗醫學雜志, 2023, 44(19): 2402-2406.
[7] VOLOSHYNA I, LITTLEFIELD M J, REISS A B. Atherosclerosis and interferon-γ: New insights and therapeutic targets[J]. Trends in Cardiovascular Medicine, 2014, 24(1): 45-51.
[8] 張 艷, 宮麗鴻, 禮 海. 淺談動脈粥樣硬化的中醫病因病機[J]. 時珍國醫國藥, 2010, 21(5): 1125-1126.
[9] 劉美之, 郎艷松, 張鑫月, 等. 從痰、瘀、毒論治動脈粥樣硬化研究進展[J]. 中醫雜志, 2014, 55(9): 800-803.
[10] 吳雪芬, 易麗貞, 劉 欣, 等. 隔藥餅灸治療動脈粥樣硬化的研究進展[J]. 時珍國醫國藥, 2020, 31(3): 688-690.
[11] 嚴 潔, 常小榮, 岳增輝, 等. 隔藥餅灸對高脂血癥兔血脂含量的影響[J]. 中國中醫藥科技, 2004, 11(6): 358.
[12] 岳增輝, 何新群, 常小榮, 等. 隔藥餅灸對動脈粥樣硬化兔血清載脂蛋白A及載脂蛋白B水平的影響[J]. 中國中醫藥信息雜志, 2011, 18(9): 33-34.
[13] 岳增輝, 嚴 潔, 常小榮, 等. 隔藥餅灸對兔高脂血癥合并動脈粥樣硬化血管內皮細胞粘附因子E選擇素mRNA表達的影響[J]. 中國中醫藥信息雜志, 2006, 13(7): 37-39.
[14] 章海鳳, 劉 密, 常小榮, 等. 隔藥餅灸對動脈粥樣硬化兔主動脈內皮細胞NF-κB及ICAM-1mRNA表達的影響[J]. 中華中醫藥雜志, 2013, 28(4): 914-917.
[15] 王園園, 龍民慧, 周磊磊, 等. 兔動脈粥樣硬化動物模型的建立和評價[J]. 實驗動物科學, 2008, 25(3): 18-21.
[16] 楊 靜, 任 星, 楊巧寧, 等. 基于中國知網動脈粥樣硬化動物實驗的文獻計量學分析[J]. 世界中醫藥, 2021, 16(23): 3539-3544.
[17] FERENCE B A, KASTELEIN J J P, GINSBERG H N, et al. Association of genetic variants related to CETP inhibitors and statins with lipoprotein levels and cardiovascular risk[J]. JAMA, 2017, 318(10): 947-956.
[18] PETHE?魻 G L, KEREKES A, MIH?魣LFFY M, et al. Disruption of the NOX5 gene aggravates atherosclerosis in rabbits[J]. Circulation Research, 2021, 128(9): 1320-1322.
[19] 張夢云, 嚴 光, 方文祥, 等. 高脂飼養兔和豚鼠建立動脈粥樣硬化模型比較[J]. 中國臨床保健雜志, 2015, 18(5): 503-506.
[20] 閆朝勃, 伍先明, 張 寧, 等. 艾灸對ApoE-/-動脈粥樣硬化小鼠SIRT1/FOXO3a信號通路的影響[J]. 針刺研究, 2024, 49(4): 376-383.
[21] 周 莉, 史丹蕾. 神闕穴透刺結合中藥治療肥胖病伴高脂血癥脾虛濕阻型的臨床研究[J]. 上海醫藥, 2018, 39(8): 20-23.
[22] 楊海艷. 溫針灸治療老年冠狀動脈粥樣硬化性心臟病并高同型半胱氨酸的探討[J]. 中國實用醫藥, 2020, 15(17): 153-155.
[23] 徐 驲, 李毅然, 黃浪浪, 等. 健脾化濁調脂顆粒調節腸道菌群紊亂治療動脈粥樣硬化的臨床研究[J]. 中國中醫藥現代遠程教育, 2023, 21(18): 47-49.
[24] 岳增輝, 何新群, 常小榮, 等. 隔藥餅灸對動脈粥樣硬化兔血脂的調節作用[J]. 中國中醫藥現代遠程教育, 2011, 9(5): 47-48.
[25] 和曉瑩, 秦智琦, 段 琦, 等. 氧化低密度脂蛋白激活PYHIN1/Caspase1炎癥復合體信號通路增強主動脈內皮細胞黏附的機制研究[J]. 中國分子心臟病學雜志, 2021, 21(5): 4248-4252.
[26] WANG Z W, CHEN J, ZENG Z L, et al. The LOX-1 receptor ectopically expressed in the liver alleviates atherosclerosis by clearing Ox-LDL from the circulation[J]. Molecular Medicine, 2022, 28(1): 26.
[27] 張 強. Ox-LDL在動脈粥樣硬化中的致病機制及檢測方法研究進展[J]. 國際檢驗醫學雜志, 2018, 39(19): 2432-2436.
[28] PLOTKIN J D, ELIAS M G, DELLINGER A L, et al. NF-κB inhibitors that prevent foam cell formation and atherosclerotic plaque accumulation[J]. Nanomedicine: Nanotechnology, Biology, and Medicine, 2017, 13(6): 2037-2048.
[29] FU Z W, ZHOU E C, WANG X, et al. Oxidized low-density lipoprotein-induced microparticles promote endothelial monocyte adhesion via intercellular adhesion molecule 1[J]. American Journal of Physiology Cell Physiology, 2017, 313(5): C567-C574.
[30] 劉慶艷. Interleukin-34對巨噬細胞源性泡沫細胞形成的調控研究[D]. 北京: 中國人民解放軍醫學院, 2017.
[31] RANJBARAN H, SOKOL S I, GALLO A, et al. An inflammatory pathway of IFN-gamma production in coronary atherosclerosis[J]. Journal of Immunology, 2007, 178(1): 592-604.
[32] WUTTGE D M, ZHOU X H, SHEIKINE Y, et al. CXCL16/SR-PSOX is an interferon-gamma-regulated chemokine and scavenger receptor expressed in atherosclerotic lesions[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2004, 24(4): 750-755.
[33] PANOUSIS C G, ZUCKERMAN S H. Interferon-gamma induces downregulation of Tangier disease gene (ATP-binding-cassette transporter 1) in macrophage-derived foam cells[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2000, 20(6): 1565-1571.
[34] BRAND K, MACKMAN N, CURTISS L K. Interferon-gamma inhibits macrophage apolipoprotein E production by posttranslational mechanisms[J]. The Journal of Clinical Investigation, 1993, 91(5): 2031-2039.
[35] DONG M Y, ZHANG Y, XU C B, et al. Interferon-γ decreases ATP-binding cassette subfamily G member 1-mediated cholesterol efflux through small ubiquitin-like modifier/ubiquitin-dependent liver X receptor-α degradation in macrophages[J]. Biotechnology and Applied Biochemistry, 2021, 68(6): 1412-1420.
本文引用: 易洪芬, 陳昕羽, 彭 涵, 肖孟霞, 歐陽里知, 劉紅華, 劉邁蘭. 隔藥餅灸對動脈粥樣硬化兔血清Ox-LDL、IFN-γ表達的影響[J]. 湖南中醫藥大學學報, 2024, 44(9): 1614-1619.
〔收稿日期〕2024-05-16
〔基金項目〕國家自然科學基金面上項目(82074559);湖南省青年科技創新人才項目(2022RC1222);湖南省中醫藥管理局一般課題(202206);長沙市杰出創新青年培養計劃項目(kq1905036);湖南省教育廳優秀青年項目(22B0377)。
〔通信作者〕*劉邁蘭,女,博士,教授,博士研究生導師,E-mail:445007305@qq.com;劉紅華,女,博士,副教授,E-mail:735291123@qq.com。

