注重基礎、體現能力、開拓思維、融合創新

物質結構與元素周期律是高中化學學習的重點內容,對化學學習起著關鍵性的指導作用,是物質世界的重要規律.?普通高中化學課程標準(2017年版2020年修訂)?中明確了該內容的學業要求:認識原子結構、元素性質與元素在元素周期表中位置的關系,結合有關數據和實驗事實認識原子結構、元素性質呈周期性變化的規律,建構元素周期律,能利用元素在元素周期表中的位置和原子結構,分析、預測、比較元素及其化合物的性質.在新高考試題中,元素“位、構、性”推斷題是必考題型,該類試題以物質結構與性質為背景,情境載體新穎,呈現形式多樣,具有一定的創新性,對于新高考考生具有一定的難度.本文以元素“位、構、性”推斷類典型高考真題為例,闡述試題的考查方向及解題策略,以期對2025年高考備考有所幫助.
1 近幾年元素“位、構、性”推斷題情境載體的變化
不同類型推斷題情境載體的變化情況如表1所示.
元素“位、構、性”推斷題通過合理創設情境,設置新穎的試題呈現方式和設問方式,促使學生主動思考,綜合考查學生運用所學知識分析問題、解決問題的能力.在歷年元素“位、構、性”推斷題中,情境載體變化多樣.自新教材、新高考后,由于物質結構與性質為選擇性必修內容,也是必考內容,故將其融入元素“位、構、性”推斷題中,試題的呈現形式也逐漸回歸到了文字敘述型,但涉及知識面更廣,思維容量更大,也使試題難度有所提升.
2 元素“位、構、性”推斷題考點考向分析
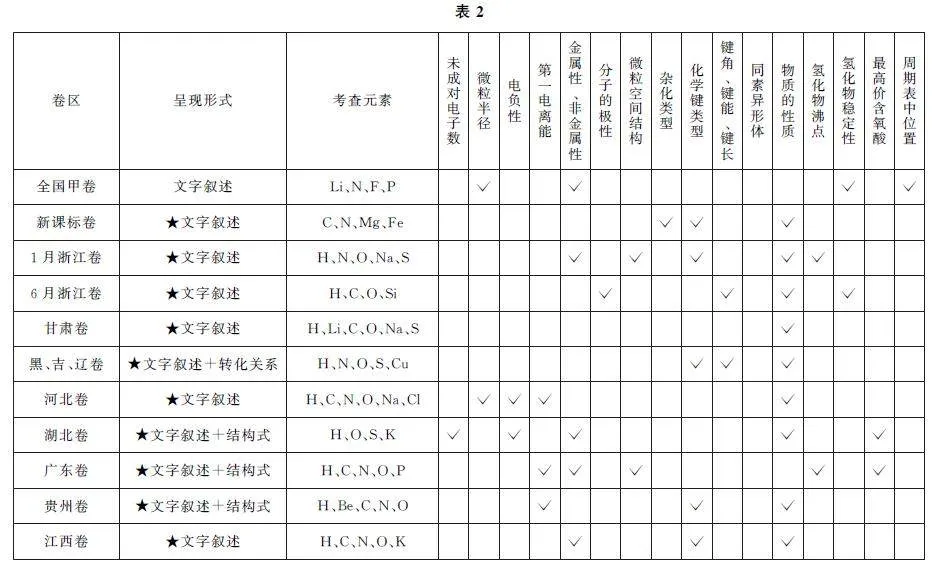
2024年部分試卷元素“位、構、性”推斷題考點考向分析如表2所示.
從2024年試題呈現形式看,多數試題都是文字敘述型,僅有3道試題含有物質的結構式,1道試題含有物質的轉化關系,呈現形式相對單一.全國甲卷是老教材老高考模式,試題中沒有滲透物質結構的相關知識;新課標卷及新高考省份均滲透了物質結構的相關知識,多數試題需要以原子結構進行元素的推斷.從原子結構與性質的角度看,第一電離能、元素金屬性與非金屬性知識考查的頻次較高;從分子結構與性質角度看,化學鍵類型(含鍵能、鍵角、鍵長)及物質的性質一直是高頻考點.
3 典型試題分析
3.1 熱重曲線圖像型
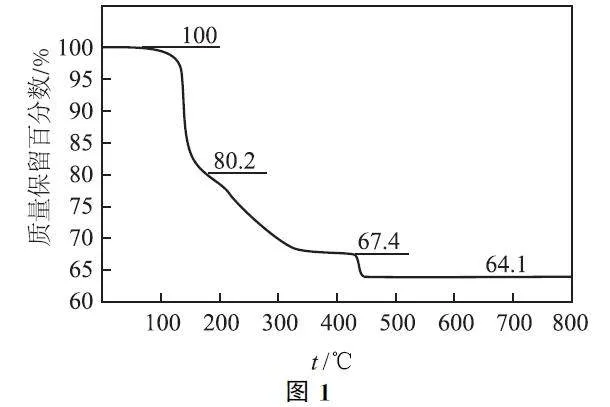
例1 (2022 年全國乙卷)化合物(YW4X5Z8·4W2Z)可用于電訊器材、高級玻璃的制造.W、X、Y、Z為短周期元素,原子序數依次增加,且加和為21.YZ2分子的總電子數為奇數,常溫下為氣體.該化合物的熱重曲線如圖1所示,在200℃以下熱分解時無刺激性氣體逸出.下列敘述正確的是( ).
A.W、X、Y、Z的單質常溫下均為氣體
B.最高價氧化物的水化物的酸性:Y<X
C.100~200℃階段熱分解失去4個W2Z
D.500℃熱分解后生成固體化合物X2Z3
試題分析 對試題進行整體分析如圖2所示.
綜合推斷 根據化合物的分子式及4種元素的原子序數之和為21可知,4種元素的原子序數平均值約為5,即4種元素為第一周期與第二周期元素,根據氣體YZ2 分子的總電子數為奇數可知Y 的原子序數一定為奇數,可推出Y為N元素,Z為O元素,W 與X元素的原子序數均小于7且加和為6,可能有2種情況(H 與B、He與Be),根據物質的化學式可知,只能是H與B,且與選項D固體化合物X2Z3(B2O3)相吻合.
選項分析 B元素的單質在常溫下為固體,選項A 錯誤.元素非金屬性越強,最高價氧化物的水化物的酸性越強:HNO3>H3BO3,選項B錯誤.
數據處理 設有1molNH4B5O8.4H2O 受熱分解,起始質量為273g,當其失去4個結晶水,質量保留百分數應為273g-72g/273g ×100%≈73.6%,選項C錯誤;若500℃熱分解后生成固體化合物B2O3,根據B元素守恒,則有2.5 molB2O3 生成,其質量為175g,質量保留百分數為175g/273g×100%≈64.1%,選項D正確.本題答案為D.
3.2 物質結構與性質融合型
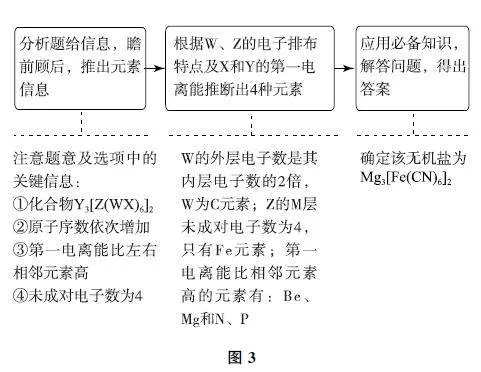
例2 (2024年新課標卷)我國科學家最近研究的一種無機鹽Y3[Z(WX)6]2 納米藥物,具有高效的細胞內亞鐵離子捕獲和抗氧化能力.W、X、Y、Z的原子序數依次增加,且W、X、Y 屬于不同族的短周期元素.W 的外層電子數是其內層電子數的2倍,X 和Y的第一電離能都比左右相鄰元素的高.Z的M 層未成對電子數為4.下列敘述錯誤的是( ).
A.W、X、Y、Z4種元素的單質中,Z的熔點最高
B.在X 的簡單氫化物中,X 原子軌道雜化類型為sp3
C.Y 的氫氧化物難溶于NaCl溶液,可以溶于NH4Cl溶液
D.Y3[Z(WX)6]2 中WX- 提供電子對與Z3+ 形成配位鍵
試題分析 對試題進行整體分析如圖3所示.
綜合推斷 根據W 的外層電子數是其內層電子數的2倍,可知W 為C元素;根據X 和Y(位于不同主族)的第一電離能都比左右相鄰元素的高,且原子序數應大于6,可知X為N 元素,Y 為Mg元素;Z的M 層未成對電子數為4,即M 層電子排布為3s23p63d6,其價電子排布式為3s23p63d64s2,可知Z為Fe元素.
選項分析 4種元素的單質中,單質Fe(金屬晶體)的熔點較高,C元素有多種同素異形體,其中金剛石(原子晶體)的熔點高于單質Fe,選項A 敘述錯誤.X的簡單氫化物為NH3,N 原子的雜化類型為sp3 雜化,選項B 敘述正確.Mg(OH)2 難溶于NaCl溶液,NH4Cl溶液顯酸性,能溶解Mg(OH)2 固體,選項C敘述正確.在化合物Mg3[Fe(CN)6]2 中,CN- 提供孤電子對,Fe3+ 提供空軌道,形成配位鍵,選項D敘述正確,答案為A.
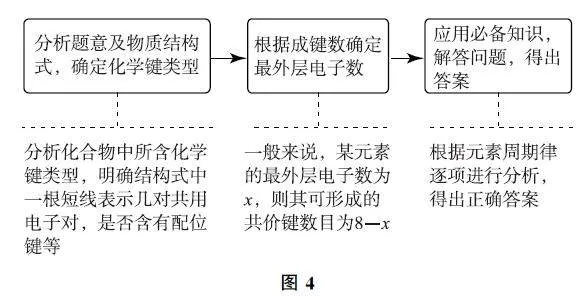
3.3 給出物質的結構式型
突破該類題型的關鍵在于對各種元素的成鍵情況了如指掌.一般來說,H 原子與鹵素原子只能形成1對共用電子對,且應注意一些特殊的成鍵形式,如B原子、S原子.對于不同的化合物,尤其是離子化合物,需要關注陰、陽離子所帶的電荷數,在計算成鍵情況時,需要相應地增加或減少電子.在某些化合物中,還需要考慮配位鍵存在的情況.解決該類試題的模型如圖4所示.
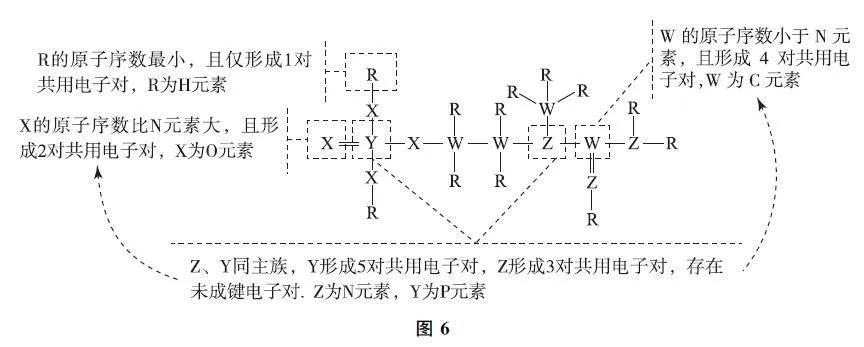
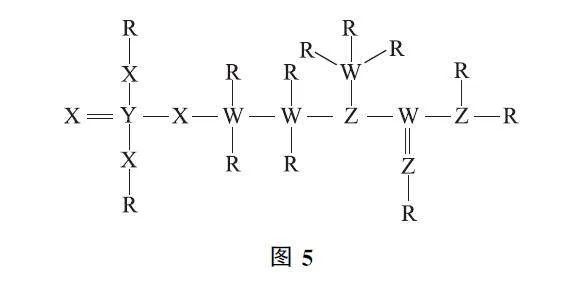
例3 (2024年廣東卷)一種可為運動員補充能量的物質,其分子結構式如圖5所示.已知R、W、Z、X、Y為原子序數依次增大的短周期主族元素,Z和Y同族,則( ).
A.沸點:ZR3<YR3
B.最高價氧化物的水化物的酸性:Z<W
C.第一電離能:Z<X<W
D.ZX3- 和 WX23- 空間結構均為平面三角形
綜合推斷 對試題進行綜合推斷如圖6所示.
lProbjq7TO84lttXFUcQ+x8wch74HOBszvwvgh1Mvk0=選項分析 NH3 分子間存在氫鍵,故其沸點高于PH3,選項A 錯誤.由圖6可知,Z為N 元素,W 為C元素,元素非金屬性越強,其最高價氧化物對應水化物的酸性越強,即HNO3>H2CO3,選項B錯誤.N 原子的價層電子排布式為2s22p3,為半充滿狀態,第一電離能高于O 元素,故第一電離能:N>O>C,選項C錯誤.NO3- 和CO23- 中心原子的雜化類型均為sp2 雜化,其空間結構為平面三角形,選項D正確.答案為D.
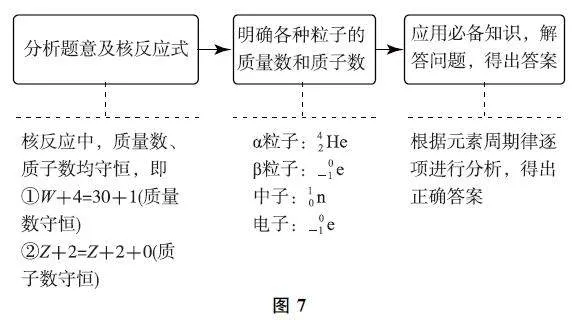
3.4 核反應式型
例4 (2020年全國Ⅰ卷)1934年約里奧·居里夫婦在核反應中用α粒子(即氦核42He)轟擊金屬原子WZX,得到核素Z +320Y,開創了人造放射性核素的先河:WZX+4 2He→ 30 Z+2Y+10n,其中元素X、Y 的最外層電子數之和為8.下列敘述正確的是( ).
A.WZ X的相對原子質量為26
B.X、Y均可形成三氯化物
C.X的原子半徑小于Y的
D.Y僅有一種含氧酸
試題分析 對試題進行整體分析如圖7所示.
綜合推斷 X為金屬元素,X、Y 的最外層電子數之和為8,最外層電子數(質子數)之差為2,可得X為Al元素,Y為P元素.
選項分析 由核反應中質量數守恒得W +4=30+1,則W =27,核素2173X的相對原子質量為27,選項A 錯誤.Al 可形成AlCl3,P可形成PCl3,選項B正確.同周期元素原子半徑逐漸減小:r (Al)>r(P),選項C 錯誤.Y 為P元素,含有多種含氧酸:H3PO4、H3PO3、H3PO2等,選項D錯誤.答案為B.
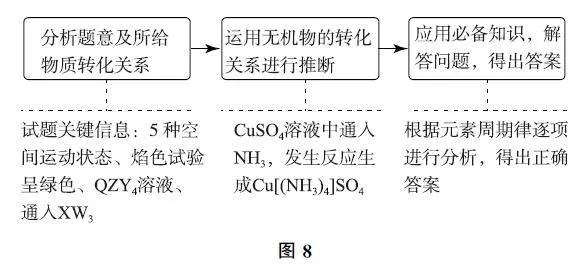
3.5 物質轉化關系型
例5 (2024年遼、吉、黑卷)反應:QZY4 溶液逐漸通入XW3 至過量→QZX4Y4W12 溶液,相關元素中,W、X、Y、Z為原子序數依次增大的短周期元素,基態X原子的核外電子有5種空間運動狀態,基態Y、Z原子有2個未成對電子;Q 是ds區元素,焰色試驗呈綠色.下列說法錯誤的是( ).
A.單質沸點:Z>Y>W
B.簡單氫化物鍵角:X>Y
C.反應過程中有藍色沉淀產生
D.QZX4Y4W12是配合物,配位原子是Y
試題分析 對試題進行整體分析如圖8所示.
綜合推斷 由X 原子的核外電子有5種空間運動狀態可知,X為N 元素,則W 為H 元素;基態Y、Z有2個未成對電子,則Y 為O 元素,Z為S元素;Q 元素的焰色試驗呈綠色,則Q 為Cu元素;這些元素構成的化合物也能發生相應的轉化關系.
選項分析 S單質常溫下為固態,H2 和O2 為氣態,O2 的沸點高于H2,選項A 說法正確.NH3 與H2O 中心原子的雜化類型均為sp3 雜化,NH3 分子中有1對孤電子對,H2O 分子中有2對孤電子對,鍵角更小,選項B說法正確.CuSO4 溶液中通入NH3,先生成藍色沉淀Cu(OH)2,隨著NH3 的通入,沉淀逐漸溶解,生成Cu[(NH3)4]SO4 溶液, 選項C 說法正確.Cu[(NH3)4]SO4是配合物,配位原子是N,選項D說法錯誤.答案為D.
4 題型預測及備考策略
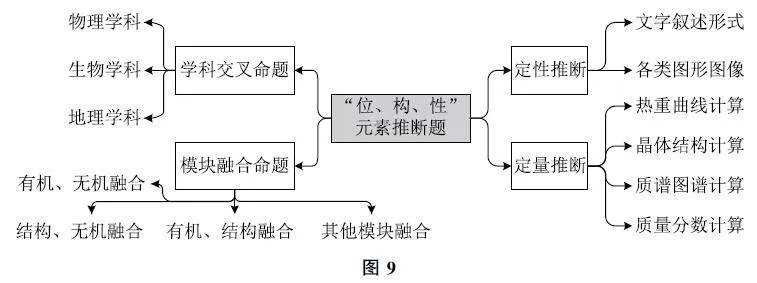
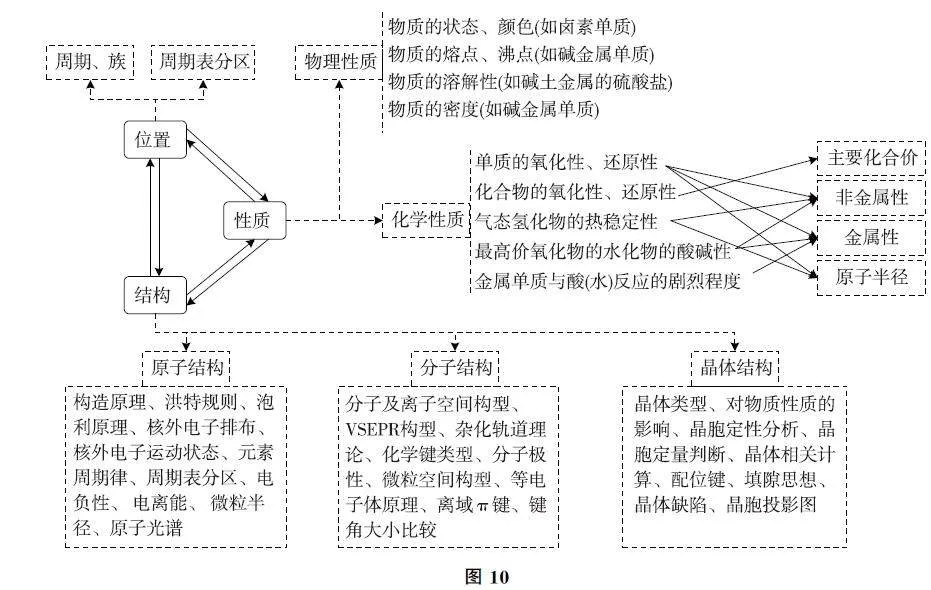
在新高考背景下,元素“位、構、性”推斷依然是必考題型,該題型可融合學科及不同模塊進行命題(如圖9),涉及知識點多,思維容量大,體現考生思維過程.結合數據推理,更能考查考生的邏輯推理、數據演繹能力.在備考過程中,必須掌握元素周期律及物質結構的相關知識,注重建構知識體系,尤其是選擇性必修2物質結構與性質的知識,如圖10所示.
(完)

