問“題”哪得清如許 唯有“教材”活水來




教材是對課程標準的具體化,是教學的依據,體現了新課程理念,突出了對化學學科核心素養的要求,是命題的依據.近幾年,化學試題逐漸朝著緊扣教材、強化學生核心素養的方向發展.教材不僅是高考命題的資源依據,同時滲透著命題改革方向的信息.筆者選取近幾年的高考試題,以人教版(2020年版)選擇性必修1教材(以下簡稱教材)為例,闡釋與電化學有關的高考試題與教材的密切關系,以期引起大家的關注與深思.
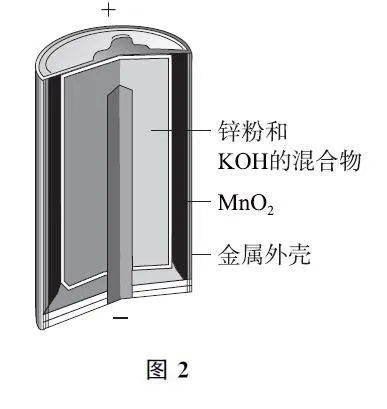
1 鋅錳電池與教材主干知識的關聯
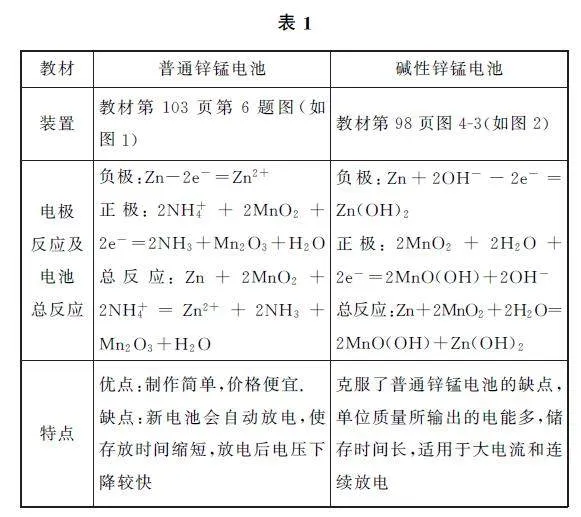
相關裝置及電極反應如表1所示.
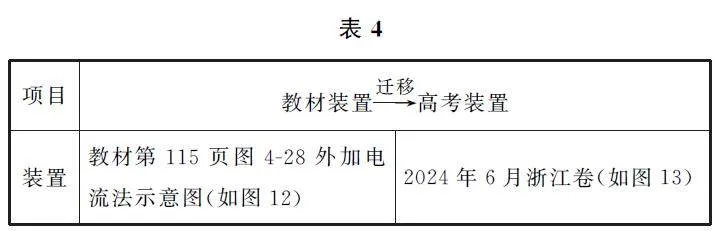
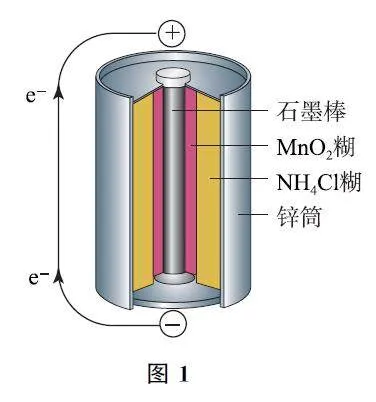
例1 (2024年北京卷)酸性鋅錳干電池的構造示意圖如圖3所示.關于該電池及其工作原理,下列說法正確的是( )
A.石墨作電池的負極材料
B.電池工作時,NH4+向負極方向移動
C.MnO2 發生氧化反應
D.鋅筒發生的電極反應為Zn-2e- =Zn2+
答案 D.
【考題溯源】本題與教材知識高度吻合,只要了解表1的兩極反應原理和方程式的書寫,本題可解.
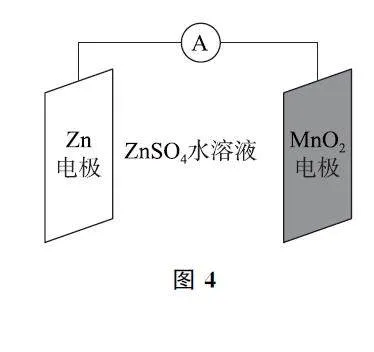
例2 (2024年全國甲卷) 科學家使用δGMnO2 研制了一種MnO2GZn 可充電電池(如圖4).電池工作一段時間后,MnO2 電極上檢測到MnOOH 和少量ZnMn2O4.下列敘述正確的是( ).
A.充電時,Zn2+ 向陽極方向遷移
B.充電時,會發生反應Zn+2MnO2=ZnMn2O4
C.放電時,正極反應有MnO2 + H2O+e- =MnOOH+OH-
D.放電時,Zn電極質量減少0.65g,MnO2 電極生成了0.020molMnOOH
答案 C.
【考題溯源】本題在教材一次電池的基礎上深化成二次電池進行考查,體現了思維的進階和高考命題超越教材的命題理念.充電時該裝置為電解池,電解池中陽離子向陰極遷移,選項A 不正確.放電時,負極的電極反應為Zn-2e- =Zn2+ ,則充電時陰極反應為Zn2+ +2e- =Zn,選項B 不正確.放電時MnO2 電極為正極,正極上檢測到MnOOH 和少量ZnMn2O4,則正極上主要發生的電極反應是MnO2+H2O+e- =MnOOH+OH- ,選項C 正確.放電時,Zn電極質量減少0.65g(物質的量為0.010 mol),電路中轉移0.020mol電子,由正極反應可知,若正極上只有MnOOH 生成,則MnOOH 的物質的量為0.020mol,但是正極上還有ZnMn2O4 生成,因此,MnOOH 的物質的量小于0.020mol,選項D不正確.答案為C.
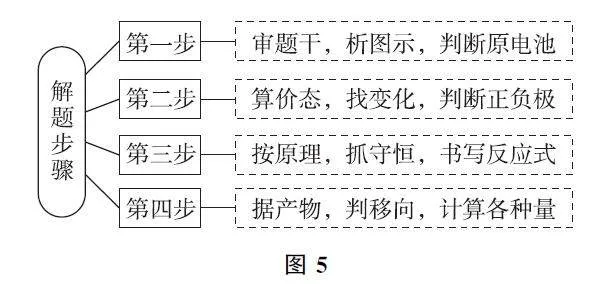
【思維模型】解答有關化學電源PEmqvKkTOKKWdrgWbrzBOJc8HsQMOLhSPlE/xJDag+8=電極反應式書寫試題的思維流程,如圖5所示.
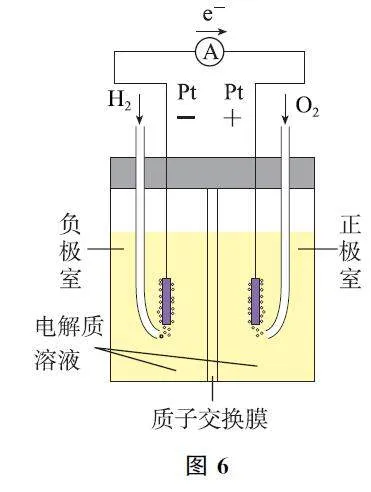
2 燃料電池與電解池的互逆原理
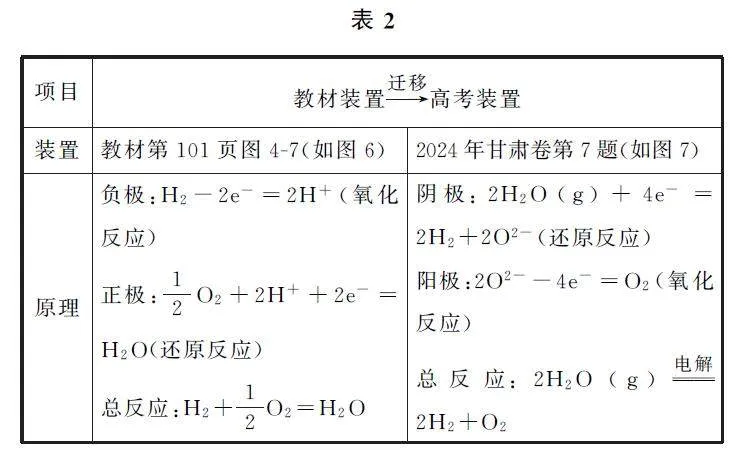
教材及高考試題的裝置和反應原理如表2所示.
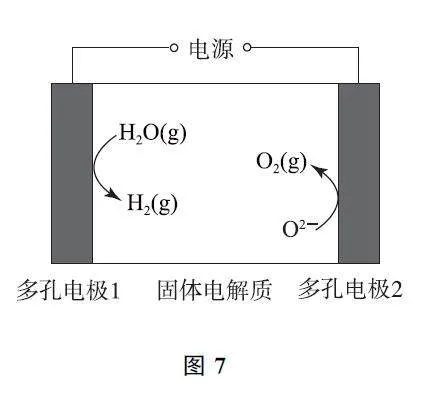
例3 (2024年甘肅卷)某固體電解池工作原理如圖7所示,下列說法錯誤的是( ).
A.電極1的多孔結構能增大與水蒸氣的接觸面積
B.電極2是陰極,發生還原反應:O2+4e- =2O2-
C.工作時O2- 從多孔電極1遷移到多孔電極2
D.理論上電源提供2mole- 能分解1molH2O
答案 B.
【考題溯源】由圖7可知多孔電極1上H2O(g)發生得電子的還原反應轉化成H2(g),多孔電極1為陰極,電極反應為2H2O+4e- =2H2+2O2- ,多孔電極2為陽極,發生氧化反應:2O2- -4e- =O2,選項B錯誤.根據電解總反應為2H2O(g)電解=2H2+O2 和電子守恒可知,選項D正確.
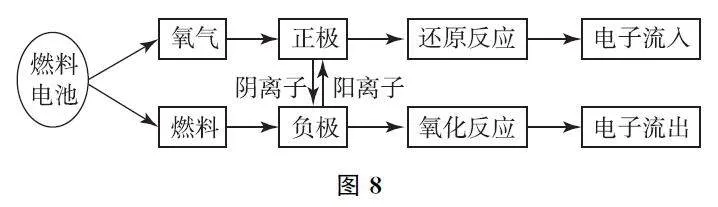
【思維模型】如圖8所示.
1)注意介質是電解質溶液還是熔融鹽或氧化物.
2)通入負極的物質為燃料,通入正極的物質為氧氣(或其他氧化劑).
3)通過介質中離子的移動方向,可判斷電池的正負極,同時考慮該離子是否參與靠近一極的電極反應.
3 電解飽和食鹽水裝置的遷移應用
電解飽和食鹽水裝置的遷移應用如表3所示.
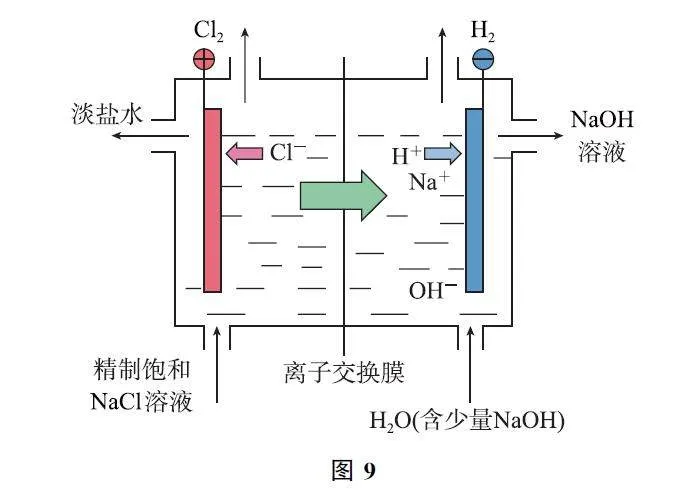
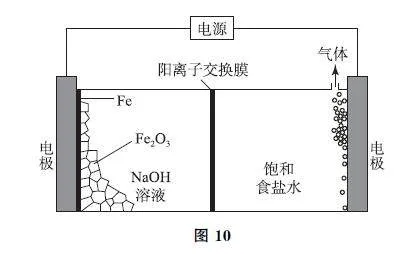
例4 (2024年廣東卷)一種基于氯堿工藝的新型電解池(如圖10),可用于濕法冶鐵的研究.電解過程中,下列說法不正確的是( ).
A.陽極反應:2Cl- -2e- =Cl2↑
B.陰極區溶液中OH- 濃度逐漸升高
C.理論上每消耗1molFe2O3,陽極室溶液減少213g
D.理論上每消耗1molFe2O3,陰極室物質最多增加138g
答案 C.
【考題溯源】由圖10可知,右側電極Cl- 放電產生Cl2,為陽極,選項A 說法正確.左側電極為陰極,發生還原反應,Fe2O3 在堿性條件下轉化為Fe,電極反應為Fe2O3+6e- +3H2O=2Fe+6OH- ,選項B說法正確(該選項知識可根據電解池裝置中的標識物判斷).中間為陽離子交換膜,Na+ 由陽極向陰極移動.理論上每消耗1 molFe2O3,轉移6 mol電子,產生3molCl2,同時有6molNa+ 由陽極轉移至陰極,則陽極室溶液減少3×71g+6×23g=351g,陰極室物質最多增加6×23g=138g,選項C說法錯誤,選項D說法正確.答案為C.
【思維模型】電化學計算常用方法如圖11所示.
4 電化學防護的遷移應用
電化學防護的遷移應用如表4所示.
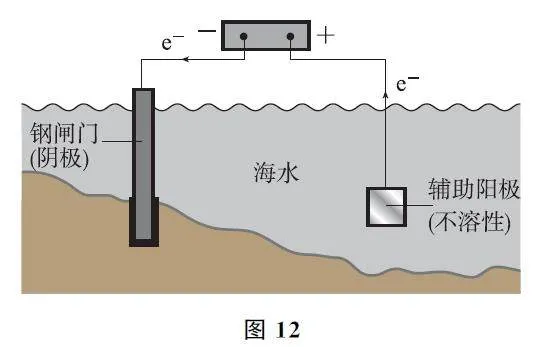
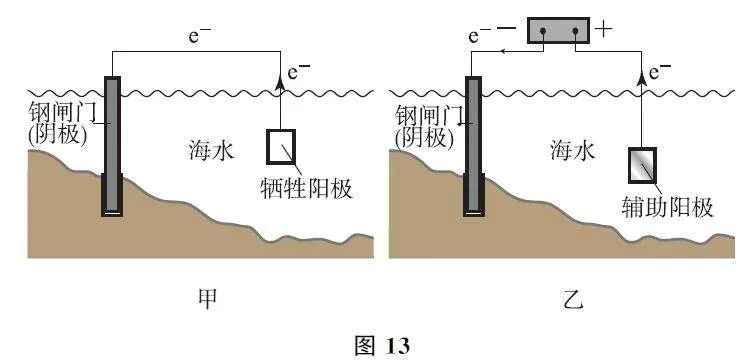
例5 (2024年6月浙江卷)金屬腐蝕會對設備產生嚴重危害,腐蝕快慢與材料種類、所處環境有關.圖13為2種對海水中鋼閘門的防腐措施示意圖,下列說法正確的是( ).
A.兩圖中,陽極材料本身均失去電子
B.圖13G乙中,外加電壓偏高時,鋼閘門表面可發生反應:O2+4e- +2H2O=4OH-
C.圖13G乙中,外加電壓保持恒定不變,有利于提高對鋼閘門的防護效果
D.兩圖中,當鋼閘門表面的腐蝕電流為零時,鋼閘門、陽極均不發生化學反應
答案 B.
【考題溯源】圖13G甲為犧牲陽極的陰極保護法,犧牲陽極一般為較活潑的金屬,作為原電池的負極,失去電子被氧化;圖13G乙為外加電流的陰極保護法,陽極材料為輔助陽極,其通常是惰性電極,本身不失去電子,選項A、D均不正確.圖13G乙中,外加電壓偏高時,鋼閘門表面積累的電子很多,除了海水中的H+放電外,海水中溶解的O2也會競爭放電,故可發生反應:O2+4e- +2H2O=4OH- ,選項B正確.圖13G乙為外加電流的陰極保護法,理論上只要能對抗鋼閘門表面的腐蝕電流即可,當鋼閘門表面的腐蝕電流為零時保護效果最好;腐蝕電流會隨著環境的變化而變化,若外加電壓保持恒定不變,則不能保證抵消腐蝕電流,不利于提高對鋼閘門的防護效果,選項C不正確.
【思維模型】金屬防護分析的思維模型如下.
1)2種防護方法.
2)解題模型.首先,判斷防護類型;其次,根據原電池原理和電解池原理分析防護原理,結合生活實際對選項做出合理判斷.
5 教材習題與高考試題的關聯
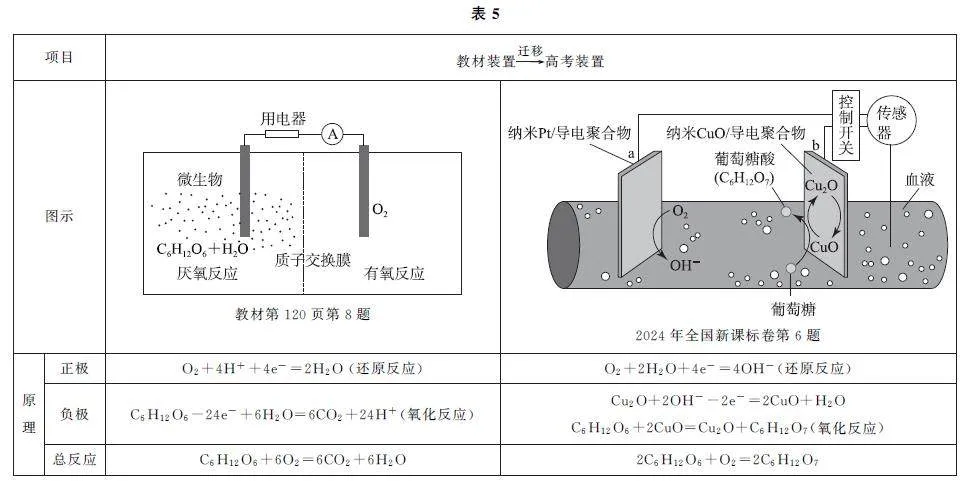
教材及高考試題的裝置和反應原理如表5所示.
例6 (2024年全國新課標卷)一種可植入體內的微型電池工作原理如圖(表5中)所示,通過CuO催化消耗血糖發電,從而控制血糖濃度.當傳感器檢測到血糖濃度高于標準,電池啟動.血糖濃度下降至標準,電池停止工作.(血糖濃度以葡萄糖濃度計)電池工作時,下列敘述錯誤的是( ).
A.電池總反應為2C6H12O6+O2=2C6H12O7
B.b電極上CuO 通過Cu(Ⅱ)和Cu(Ⅰ)相互轉變起催化作用
C.消耗18 mg 葡萄糖,理論上a 電極有0.4mmol電子流入
D.兩電極間血液中的Na+ 在電場驅動下的遷移方向為b→a
答案 C.
【考題溯源】對比教材習題和高考題可以看出,教材題中采用了質子交換膜即H+ 可以移動向正極,故正極方程式需要兼顧真實的離子環境進行書寫.教材習題的負極反應是葡萄糖的完全氧化,生成CO2,而高考題是控制氧化,生成葡萄糖酸,要求考生建立有機物的氧化反應理念,即加氧去氫為氧化.根據反應2C6H12O6+O2=2C6H12O7 可知,1molC6H12O6參加反應時轉移2mol電子,18mgC6H12O6 的物質的量為0.1mmol,則消耗18mg葡萄糖時,理論上a電極有0.2mmol電子流入,選項C錯誤.
【思維模型】零價法書寫有機物負極反應的規則:若負極有機物燃料為CxHyOz ,產物中C元素為+4價的CO23- 或 HCO3-,則轉移電子數為 C原子數×4+H 原子數×1+O 原子數×(-2),若有機陰離子在負極反應(如CH3COO- ),轉移電子數則為C原子數×4+H 原子數×1+O 原子數×(-2)+電荷數.
由此可以看出,高考試題的核心知識點均源于教材,但又不拘泥于教材,而是將教材知識進行深加工后再進行考查.學生在平日的學習過程中一定要緊扣教材,分析教材知識原型,進行知識的橫向與縱深挖掘,將知識的內涵與外延爛熟于心,這樣才能熟練應用知識解決問題.
(完)

