熱化學(xué)方程式的解題思路探究


反應(yīng)熱、熱化學(xué)方程式和利用蓋斯定律計(jì)算反應(yīng)熱是每年高考必考知識(shí)點(diǎn).其中,熱化學(xué)方程式的正確書寫是解決問(wèn)題的關(guān)鍵.本文從高考真題出發(fā),總結(jié)解題方法,提煉答題技巧,幫助考生更好地掌握這一知識(shí)點(diǎn),提高解題能力.
1 熱化學(xué)方程式和化學(xué)方程式的區(qū)別
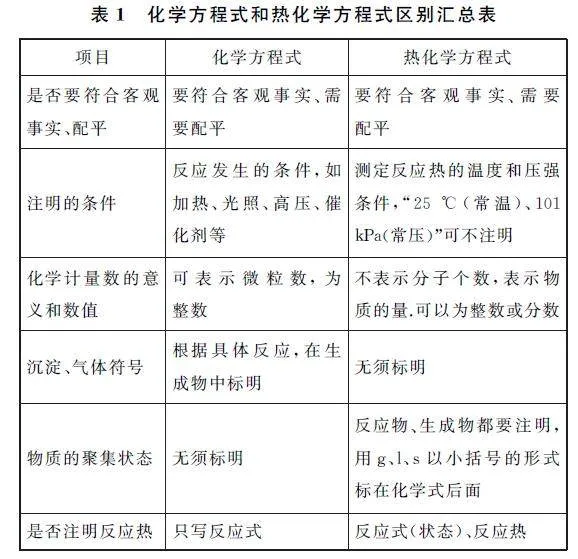
熱化學(xué)方程式是表示參加反應(yīng)的物質(zhì)的量和反應(yīng)熱的關(guān)系的化學(xué)方程式,盡管熱化學(xué)方程式來(lái)源于化學(xué)方程式,但是兩者在書寫和具備的意義上均有所不同.如果不進(jìn)行區(qū)分,則很容易將兩者相混,導(dǎo)致在書寫熱化學(xué)方程式時(shí),出現(xiàn)“反應(yīng)條件標(biāo)錯(cuò)”“反應(yīng)熱漏寫”“未標(biāo)明物質(zhì)狀態(tài)”等錯(cuò)誤出現(xiàn).兩者的區(qū)別如表1所示.
2 命題剖析
2.1 根據(jù)文字描述書寫熱化學(xué)方程式
該類題目通過(guò)文字描述,對(duì)化學(xué)反應(yīng)過(guò)程進(jìn)行詳細(xì)描述,包括參與反應(yīng)的物質(zhì)、狀態(tài)、條件等信息,要求考生具有良好的對(duì)知識(shí)的理解和應(yīng)用能力,要能準(zhǔn)確把握題目中的關(guān)鍵信息.在書寫熱化學(xué)方程式時(shí),需要注意反應(yīng)物和生成物的配平、反應(yīng)熱量的表示方式、反應(yīng)條件的標(biāo)注等規(guī)范要求.此外,學(xué)生還需要注意熱化學(xué)方程式中反應(yīng)熱的符號(hào),以準(zhǔn)確反映反應(yīng)的放熱或吸熱情況.
例1 硅粉與HCl在300 ℃時(shí)反應(yīng)生成1molSiHCl3 氣體和H2,放出225kJ熱量,該反應(yīng)的熱化學(xué)方程式為______.
解析 反應(yīng)涉及的各物質(zhì)中,硅粉為固體,HCl、SiHCl3 和H2 均為氣體.反應(yīng)的條件為300℃,壓強(qiáng)未強(qiáng)調(diào),默認(rèn)為常壓,不進(jìn)行標(biāo)注.結(jié)合題干信息,該反應(yīng)的熱化學(xué)方程式為Si(s)+3HCl(g)=300℃=SiHCl3(g)+H2(g)ΔH =-225kJ·mol-1.
點(diǎn)評(píng) 根據(jù)文字描述書寫熱化學(xué)方程式,屬于簡(jiǎn)單題型,難度并不大,需要學(xué)生從題給信息中提取關(guān)鍵信息.提取信息時(shí),可以遵循如下流程:1)提取反應(yīng)物和生成物,寫出化學(xué)方程式.2)提取各物質(zhì)狀態(tài),用“s、l、g、aq”表示在方程式中.3)提取反應(yīng)的溫度和壓強(qiáng)信息進(jìn)行標(biāo)注.4)提取反應(yīng)的熱量信息,放出熱量對(duì)應(yīng)“-”,吸收熱量對(duì)應(yīng)“+”.注意:ΔH 的正號(hào)不能省略.ΔH 的單位為kJmol-1或J·mol-1.5)提取反應(yīng)熱量信息對(duì)應(yīng)的“量”,如在該題中,對(duì)應(yīng)1 molSiHCl3 氣體和H2,與方程式中對(duì)應(yīng)的化學(xué)計(jì)量數(shù)相等,因此,該反應(yīng)的熱化學(xué)方程式為Si(s)+3HCl(g)=300℃=SiHCl3(g)+H2(g)ΔH =-225kJ·mol-1.
2.2 根據(jù)圖像描述書寫熱化學(xué)方程式
根據(jù)圖像描述書寫熱化學(xué)方程式的題型特征主要體現(xiàn)在題干提供反應(yīng)物質(zhì)的能量變化圖,要求考生解讀圖像中的信息,如反應(yīng)前后能量的變化、反應(yīng)物與生成物的能量狀態(tài)等.這類題目考查考生將圖像信息轉(zhuǎn)化為熱化學(xué)方程式的能力.學(xué)生需要根據(jù)圖像中展示的能量變化情況,判斷反應(yīng)的放熱或吸熱性質(zhì),并據(jù)此準(zhǔn)確寫出熱化學(xué)方程式,同時(shí)正確標(biāo)注出熱量變化和反應(yīng)條件.
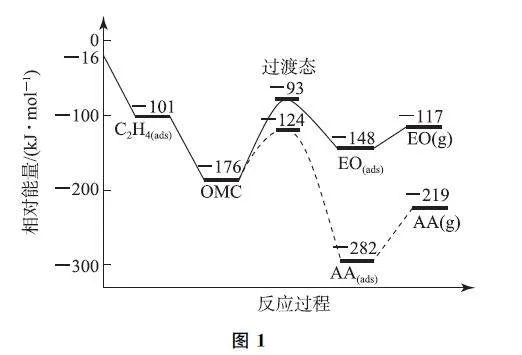
例2 (2023年重慶卷,節(jié)選)在銀催化下,乙烯與氧氣反應(yīng)生成環(huán)氧乙烷(EO)和乙醛(AA).根據(jù)圖1寫出由EO (g)生成AA (g)的熱化學(xué)方程式: ______.
解析 由圖可知,EO(g)生成AA(g)放出熱量,(-219kJ·mol-1)- (-117kJ·mol-1)=-102kJ·mol-1,熱化學(xué)方程式為EO(g)=AA(g) ΔH =-102kJ·mol-1.
點(diǎn)評(píng) 1)根據(jù)圖像,書寫反應(yīng)方程式.2)根據(jù)圖像,標(biāo)記各物質(zhì)狀態(tài).3)定條件,若沒(méi)有明確給出,默認(rèn)為2Kf3uizLL8z1XTx2PNnAVpQ==5℃、101kPa,無(wú)須標(biāo)記.4)計(jì)算反應(yīng)的焓變.在化學(xué)反應(yīng)中,反應(yīng)的焓變?yōu)樯晌锼哂械目偰芰颗c反應(yīng)物所具有的總能量之差.考查的關(guān)鍵在于學(xué)生對(duì)圖像信息的有效提取.
2.3 運(yùn)用蓋斯定律書寫熱化學(xué)方程式
蓋斯定律指出,無(wú)論化學(xué)反應(yīng)是一步完成還是多步完成,其總的焓變(ΔH )與反應(yīng)物和生成物的性質(zhì)以及狀態(tài)有關(guān),與反應(yīng)的具體途徑無(wú)關(guān).這類題目要求考生通過(guò)多個(gè)已知的熱化學(xué)方程式,利用蓋斯定律來(lái)確定一個(gè)未知反應(yīng)的熱化學(xué)方程式.題目一般會(huì)給出若干個(gè)相關(guān)的熱化學(xué)方程式,并提供這些方程式的熱量變化值,然后要求考生通過(guò)代數(shù)運(yùn)算得出目標(biāo)反應(yīng)的熱化學(xué)方程式及其熱量變化.有時(shí)也會(huì)以圖像或者表格的形式,讓學(xué)生自己書寫已知的熱化學(xué)方程式,然后再進(jìn)行相關(guān)推理和計(jì)算.
前兩類題型側(cè)重于直接從描述中獲取信息并應(yīng)用化學(xué)知識(shí),而“運(yùn)用蓋斯定律書寫熱化學(xué)方程式”題型則側(cè)重于通過(guò)已知信息進(jìn)行邏輯推理和數(shù)學(xué)運(yùn)算來(lái)解決問(wèn)題.
例3 (2020年全國(guó)Ⅰ卷,節(jié)選)釩催化劑參與反應(yīng)的能量變化如圖2所示,V2O5(s)和SO2(g)反應(yīng)生成VOSO4(s)和V2O4(s)的熱化學(xué)方程式為______.
解析 根據(jù)題圖有V2O4(s)+SO3(g)=V2O5(s)+SO2(g)ΔH2=-24kJ·mol-1, ①V2O4(s)+2SO3(g)=2VOSO4(s)ΔH1=-399kJ·mol-1, ②根據(jù)蓋斯定律,由②-①×2得2V2O5(s)+2SO2(g)=V2O4(s)+2VOSO4(s),則ΔH =-399kJ·mol-1-2×(-24kJ·mol-1)=-351kJ·mol-1.因此熱化學(xué)方程式為2V2O5(s)+2SO2(g)=V2O4(s)+2VOSO4(s)ΔH =-351kJ·mol-1.
點(diǎn)評(píng) 第1步:寫出目標(biāo)反應(yīng)方程式.第2步:根據(jù)題意標(biāo)出各物質(zhì)狀態(tài).第3步:根據(jù)圖像,書寫已知的熱化學(xué)反應(yīng)方程式.第4步:運(yùn)用蓋斯定律書寫熱化學(xué)方程式.具體求解思路如圖3所示.
本文從3個(gè)角度對(duì)熱化學(xué)方程式的書寫進(jìn)行詳細(xì)分析.該類試題雖然不復(fù)雜,但要求考生要在多個(gè)方面具備扎實(shí)的知識(shí)和技能.在平時(shí)的學(xué)習(xí)過(guò)程中,學(xué)生不僅要加強(qiáng)對(duì)化學(xué)反應(yīng)本質(zhì)的理解和熱化學(xué)方程式的規(guī)范書寫訓(xùn)練,還要培養(yǎng)圖像解析能力和邏輯推理能力,以有效提升解題效率和準(zhǔn)確性.
(完)

