二次電池電極名稱的判斷

電化學試題是高考必考題型,其中結合原電池和電解池考查的二次電池是考試的熱點,解決此類試題的關鍵是要明確電池的電極名稱,理解電極發生的電極反應.
1 根據電極材料判斷
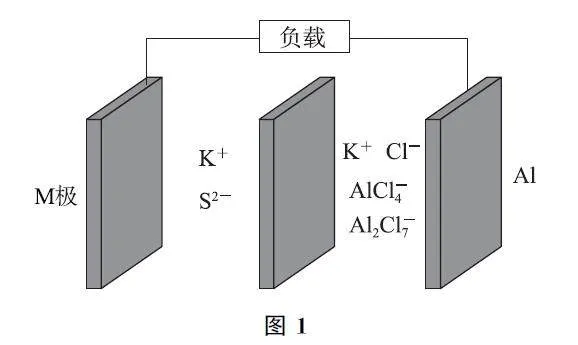
例1 鋁硫二次電池是一種具有高能量密度、廉價原材料、有前途的替代儲能裝置.一種鋁硫電池如圖1所示,M 極為表面吸附了硫的活性電極,電解質為 K2S,KClGAlCl3(AlCl4-、Al2Cl7-).下列說法錯誤的是( ).
A.放電時,鋁電極的電極反應式為Al-3e-+7AlCl4-=4Al2Cl7-
B.離子交換膜為陽離子交換膜
C.充電時,M 極為陽極,Al2Cl7-被氧化
D.充電時,每轉移1mol電子,理論上陰極區的電解質質量增加30g
分析 題給裝置為可充電的二次電池,該電池放電時Al失去電子發生氧化反應,為負極,電極反應式為Al+7AlCl4--3e-=4Al2Cl-7 ;M 為正極,硫得到電子發生還原反應,電極反應式為S+2e- =S2- ,選項A 說法正確.充放電過程中K+ 通過離子交換膜移動,故離子交換膜為陽離子交換膜,選項B說法正確.放電時M 極為正極,故充電時,M 極為陽極,電極反應為S2- -2e- =S,即S2- 被氧化,選項C說法錯誤.充電時,陰極電極反應為4Al2Cl7-+3e-=Al+7AlCl4-,則每轉移1mol電子析出9gAl,同時有1molK+ 經過陽離子交換膜由陽極區進入陰極區,故理論上陰極區的電解質質量增加1 mol×39g·mol-1 -9g=30g,選項D說法正確.答案為C.
2 根據電池總反應判斷
放電時,發生氧化反應的是原電池的負極,發生還原反應的是原電池的正極;充電時,發生氧化還原反應的是電解池的陽極,發生還原反應的是電解池的陰極.
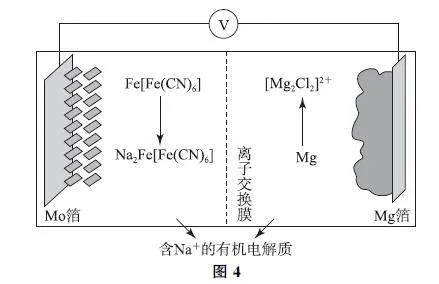
例2 科研人員新研發了一種CaGLiFePO4 可充電電池,工作原理如圖2所示,電池總反應為xCa2+ +2LiFePO4←充電放電→xCa+2Li1-xFePO4+2xLi+ (0<x<1).下列說法不正確的是( ).
A.當x=0.6時,Li1-xFePO4 中的Fe2+ 和Fe3+個數之比為2∶3
B.放電時,正極反應為Li1-xFePO4 +xLi+ +xe- =LiFePO4
C.充電時,Li1-xFePO4/LiFePO4 電極發生Li+脫嵌,Li+ 從右室移向左室
D.充電時,理論上左室電解質的質量減輕4g,電路中有0.2mol電子轉移
分析 當x =0.6時,設Li0.4FePO4 中有a 個Fe2+ 、1-a 個Fe3+ ,根據化合物中正、負化合價的代數和為0,有0.4×1+2a+3×(1-a)=3,可得a=0.4,則Fe2+ 和Fe3+ 個數之比為2∶3,選項A 說法正確.放電時,負極反應為Ca-2e- =Ca2+ ,使左室中正電荷數目增多,鋰離子導體膜只允許Li+ 通過,因此LiPF6GLiAsF6 電解質中的Li+ 通過導體膜移入右室,正極反應為Li1-xFePO4+xLi+ +xe- =LiFePO4,選項B 說法正確.充電時,陽極發生反應:LiFePO4 -xe- =xLi+ +Li1-xFePO4,電極發生Li+ 脫嵌,Li+ 從右室移向左室,選項C說法正確.充電時左室陰極發生反應:Ca2+ +2e- =Ca,左室電解質中有0.1molCa2+ 得電子生成Ca沉積在鈣電極上,電解質的質量減輕,轉移0.2mol電子同時有0.2molLi+ 從右室移入左室,故左室中電解質的質量減輕4.0g-1.4g=2.6g,選項D說法錯誤.答案為D.
3 根據題給示意圖中的信息判斷
電化學試題中,示意圖包含了很多信息,如充放電時電解質溶液中離子的移動方向、充放電時電極上物質的轉化、連接電源或負載和對應電極上物質的轉化等都可以判斷電極名稱.
例3 某種新型可充電電池具有較高的循環使用壽命,工作原理如圖3所示.下列說法錯誤的是( ).
A.放電時,A 極為正極
B.放電過程中轉移1mole- ,正極質量增加14g
C.充電時B極電極反應式為Pb3C2O7+H2O+6e-=3Pb+2CO23-+2OH-
D.充電過程中轉移0.5 mole- ,理論上有0.5molKOH被消耗
分析 當連接電源時,該裝置為電解池,A 極從MnCO3 轉化為MnO2,錳化合價升高,發生氧化反應,作陽極;B極從Pb3C2O7 轉化為Pb,Pb化合價降低,發生還原反應,作陰極.當與負載相連時,該裝置為原電池,A 極從MnO2 轉化為MnCO3,錳化合價降低,發生還原反應,作正極,選項A 說法正確.放電時正極MnO2 轉化為MnCO3,1molMnO2 轉移2mol電子,相當于增加1molCO,轉移1mole- ,正極質量增加14g,選項B說法正確.充電時B極為陰極,得到電子,電極反應式為Pb3C2O7+H2O+6e- =3Pb+2CO23-+2OH-,選項 C說法正確.總反應方程式為Pb3C2O7 +3MnCO3 +10KOH =3Pb+3MnO2+5K2CO3+5H2O,整個反應轉移6 mol電子,消耗10molKOH,故充電過程中轉移0.5mole- ,理論上有5/6molKOH 被消耗,選項D說法錯誤.答案為D.
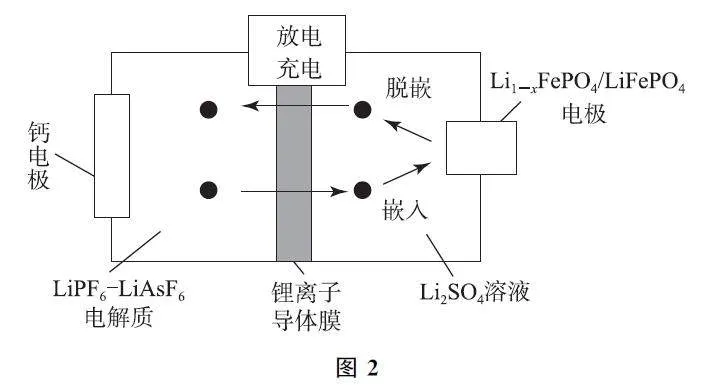
例4 以柏林綠Fe[Fe(CN)6]為代表的新型可充電鈉離子電池的放電工作原理如圖4所示,下列說法正確的是( ).
A.放電時,Mg箔為電池的正極
B.充電時,陽極反應為Fe[Fe(CN)6]+2e- +2Na+ =Na2Fe[Fe(CN)6]
C.充電時,Mo箔連接電源的正極,通過離子交換膜從右室移向左室
D.放電時,Mg箔溶解2.4g,則有機電解質中有0.2molNa+ 遷移
分析 由圖可知,放電時右側鎂失去電子發生氧化反應,為原電池的負極,左側Mo箔為原電池的正極,選項A 錯誤.放電時,左側為正極,則充電時該極為陽極,失去電子發生氧化反應:Na2Fe[Fe(CN)6]-2e- =Fe[Fe(CN)6]+2Na+ ,選項B錯誤.充電時,Mo箔為陽極,接電源正極,Na+ 通過離子交換膜從左室移向右室,選項C 錯誤.放電時,Mg 箔溶解2.4g(0.1mol),則轉移電子0.2mol,故有機電解質中有0.2molNa+ 遷移,選項D正確.答案為D.
總之,突破二次電池的關鍵是判斷電池的電極名稱,學生應扎實掌握相關判斷方法,以提高解題效率.
本文系河北省教育科學研究“十四五”規劃重點資助課題“教育數字化背景下高中化學學生學習水平評價研究”(課題編號:2302027)的階段性成果.
(完)

