原電池中正負極的判斷
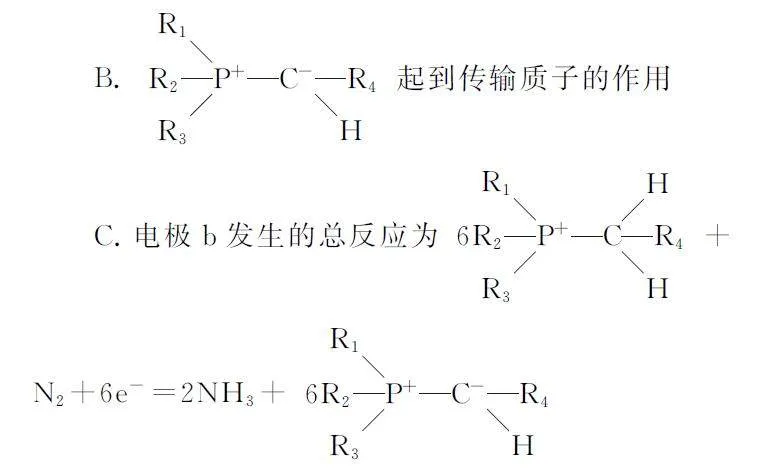
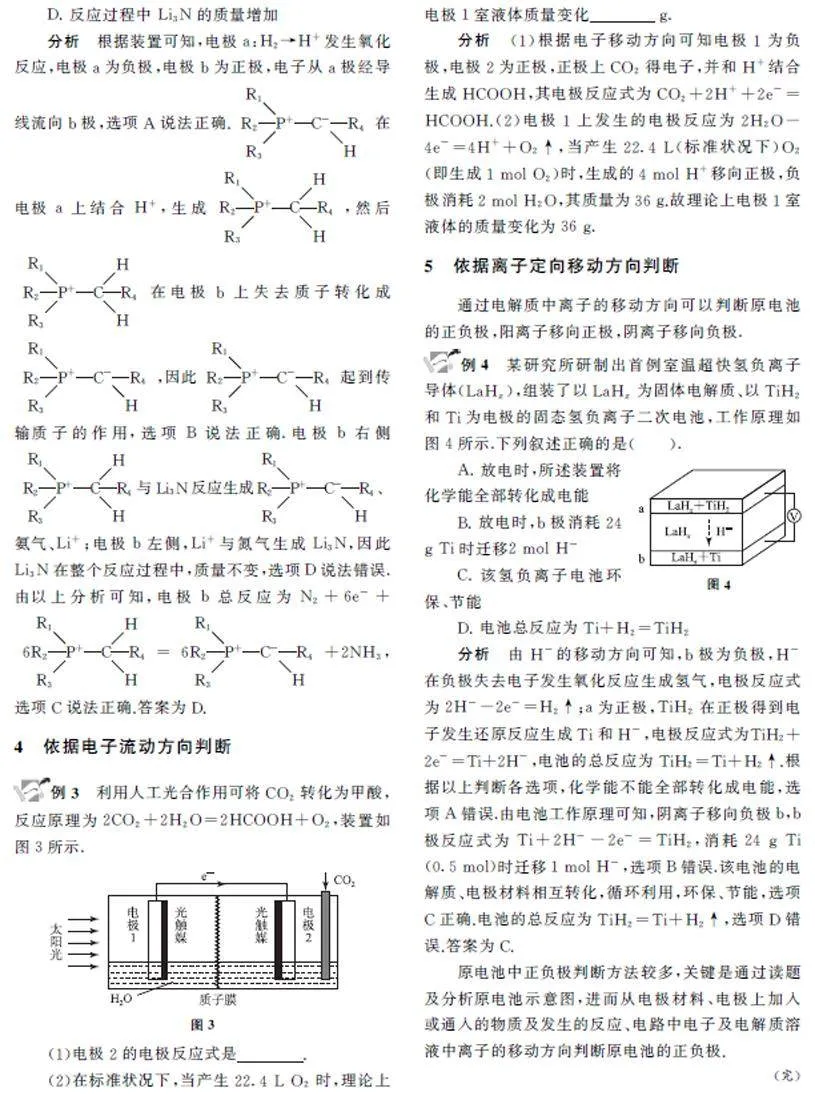
電化學知識是必考知識點,而其中原電池的正負極判斷是解題的突破口.明確了原電池中的正負極,就可以判斷電解質溶液中離子的移動方向、書寫電極反應式等.本文從以下幾個方面判斷原電池正負極.
1 根據電極材料判斷
以2種不同的金屬作電極時,往往活潑金屬作負極,相對不活潑的金屬作正極.但特殊情況下,活潑金屬也可作正極,如鎂棒和鋁棒用導線連接放入H2SO4溶液中,鎂比鋁活潑發生反應作負極;放入NaOH 溶液,鋁反應而鎂不反應,鋁作負極而鎂作正極.同樣銅和鐵(鋁)用導線連接放入稀H2SO4 溶液中,鐵(鋁)作負極,銅作正極,如果銅和鐵(鋁)用導線連接放入濃HNO3 中,鐵(鋁)遇濃HNO3 發生鈍化,而銅劇烈反應,因此銅作負極,鐵(鋁)作正極.
2 根據兩電極加入或通入物質的性質判斷
原電池的正負極可以通過電極通入物質的性質進行判斷,通入的物質具有氧化性,能夠發生還原反應,則該電極作原電池的正極,通入的物質具有還原性,能夠發生氧化反應,則該電極作原電池的負極.
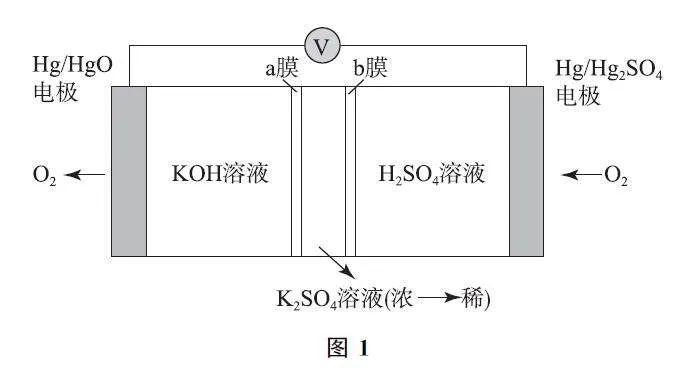
例1 下列電池模型實現了由自發反應向外輸出能量,原理如圖1所示.下列說法錯誤的是( ).
A.右側為正極,外電路電勢右側較高
B.K+、SO24-分別通過a膜、b膜向中間移動
C.負極發生氧化反應:4OH- -4e- =O2↑+2H2O
D.該電池利用中和反應將化學能轉變為電能
分析 右側氧氣得電子被還原,右側電極為正極,反應為O2+4e- +4H+ =2H2O;左側氧元素被氧化生成氧氣,左側電極為負極,反應為4OH- -4e- =O2↑+2H2O,選項C 說法正確.正極的電勢比負極高,選項A 說法正確.a膜與b膜間的K+ 向右邊移動、SO24- 向左邊移動,因此中間的 K2SO4 溶液濃度變小,選項B說法錯誤.該裝置為原電池,是將化學能直接轉化為電能的裝置,選項D說法正確.答案為B.
3 依據電極上物質的轉化判斷
電化學試題中大多會給出原電池原理示意圖,分析原電池原理示意圖,特別是電極上物質的轉化情況,是解題的重要突破口.發生氧化反應的是原電池的負極,發生還原反應的是原電池的正極.
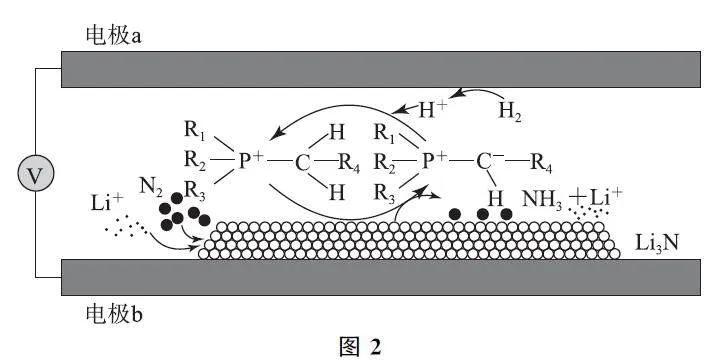
例2 圖2所示為一種合成氨的方法,下列說法錯誤的是( ).
A.電子由電極a經導線移向電極b

