蟬蟲生真菌的分離純化及鑒定
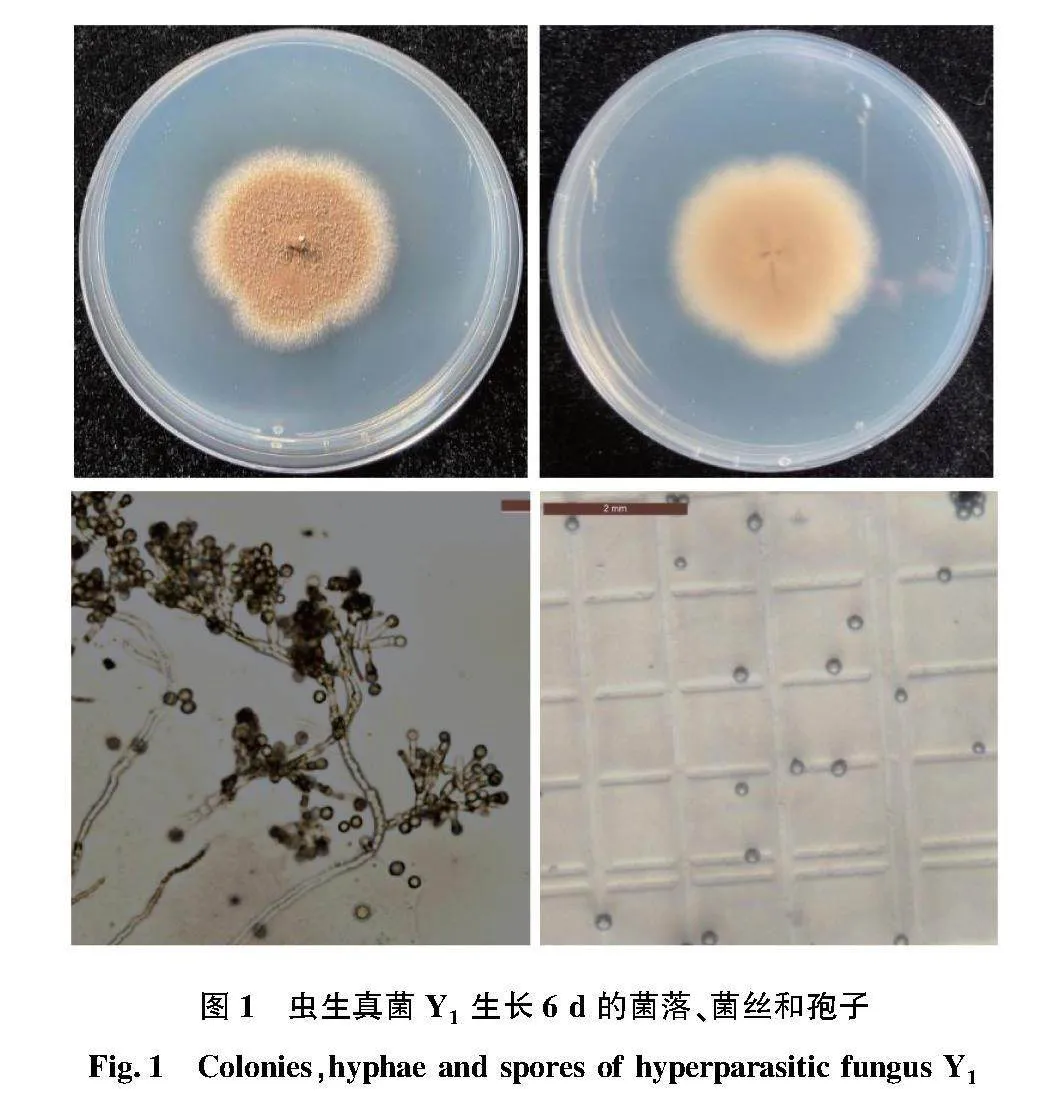
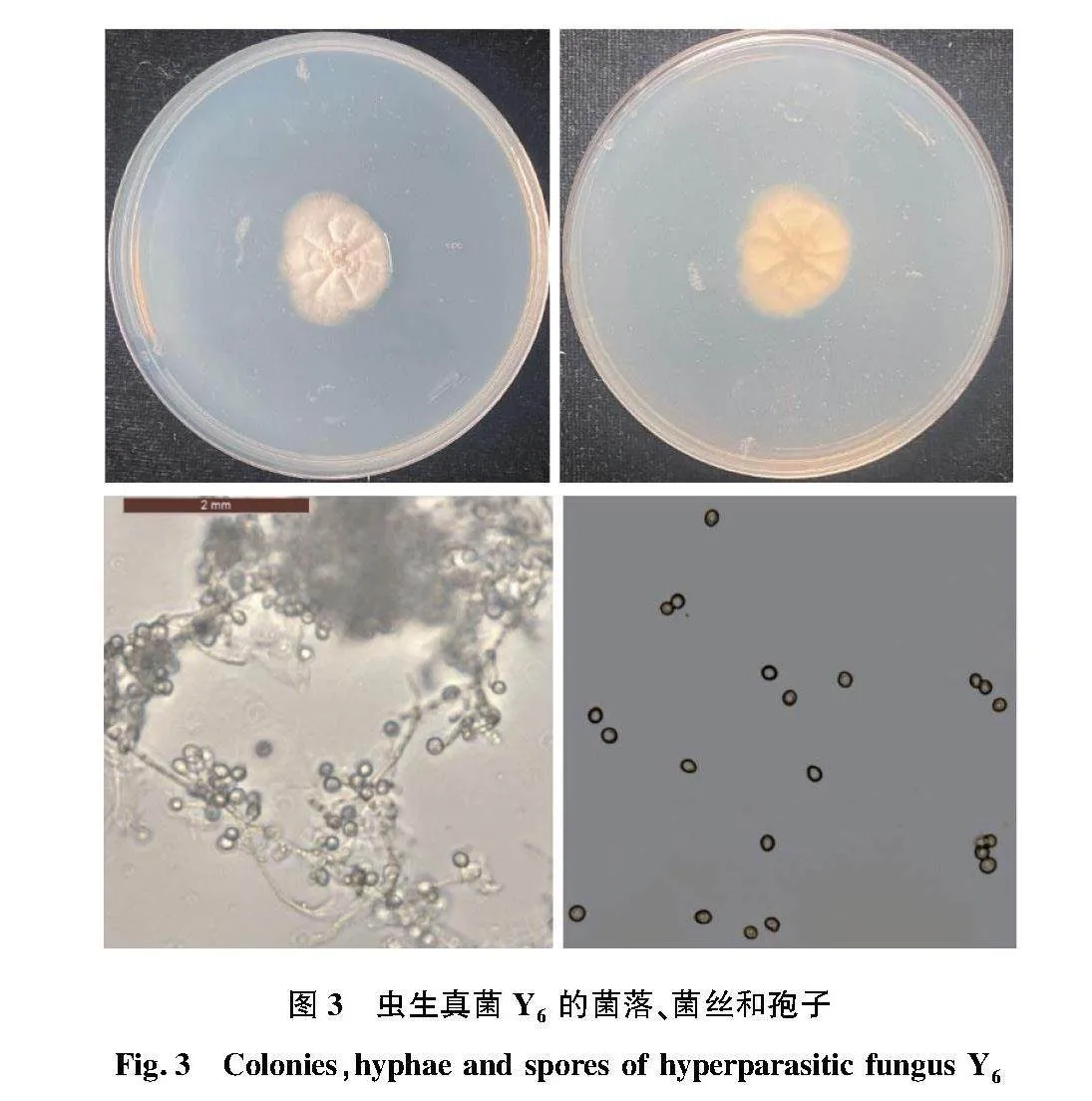
摘要 為了解蟬的寄生真菌種類,通過分離和鑒定蟬體內蟲生真菌,觀察其主要特征并對其進行分子生物學鑒定,為蟬的綠色生物學防治提供一定的理論依據。從感染真菌的蟬體內分離純化出幾株病原真菌,命名為Y1、 Y3和Y6,并對其進行形態學觀察及核糖體DNA序列測序及分析,對其進行鑒定和分析。由形態學可知,真菌Y1和Y3菌落顏色為黃棕色,菌絲白色,孢子黃棕色,圓形,大小均勻,經過ITS序列比對,結合形態特征,其為Scopulariopsis alboflavescen屬真菌。Y6菌落顏色為白色,PDA培養基上菌絲短而致密,生長緩慢,顯微鏡下觀察其菌絲為無色,孢子圓形或橢圓形,大小均勻,經過ITS序列比對,結合形態學特征,確定為Scopulariopsis屬真菌。
關鍵詞 蟬;寄生真菌;鑒定;Scopulariopsis alboflavescen;Scopulariopsis
中圖分類號 S476 文獻標識碼 A 文章編號 0517-6611(2024)21-0078-04
doi:10.3969/j.issn.0517-6611.2024.21.016
開放科學(資源服務)標識碼(OSID):
Isolation,Purification and Identification of Parasitic Fungi in Cicada (Hemiptera: Cicadidae)
PENG Hu1,3,CHEN Jin-hua1,2,3,WEI Yun1
(1.College of Environmental Science and Engineering,China West Normal University,Nanchong,Sichuan 637000; 2.State Key Laboratory of Crop Gene Exploration and Utilization in Southwest China,Sichuan Agricultural University,Chengdu,Sichuan 611130;3.Triticeae Research Institute,Sichuan Agricultral University,Chengdu,Sichuan 611130)
Abstract In order to understand the types of parasitic fungi in cicadas,we isolated and identified entomophytic fungi in cicadas,then observed their main characteristics,sequenced and analyzed ITS sequences of the strains.Several pathogenic fungi were isolated and purified from the cicada infected with fungi,named Y1,Y3,and Y6,and their morphology was observed,ribosomal DNA sequencing and analysis were performed to identify and analyze them.Morphologically,it can be inferred that the colonies of fungi Y1 and Y3 are yellow brown in color,with white hyphae and yellow brown spores.They are round and uniform in size.After ITS sequence alignment and combined with morphological characteristics,they belong to the Scopulariopsis alboflavescen genus of fungi.The color of Y6 colony is white,and the hyphae on PDA medium are short and dense,growing slowly.When observed under a microscope,the hyphae aokZ1l3eWr7CzfYztOLGyisykZ35xGDI3ErKI5CV5S/M=re colorless,and the spores are round or elliptical,with uniform sizes.After ITS sequence alignment and combined with morphological characteristics,it is classified as a Scoporariopsis fungus.
Key words Cicada;Parasitic fungi;Identification;Scopulariopsis alboflavescen;Scopulariopsis
基金項目 國家自然科學基金項目(32100163);校科研基金項目(11A022);博士啟動基金項目(20E043)。
作者簡介 彭湖(1998—),男,四川遂寧人,碩士研究生,研究方向:病原微生物學。*通信作者,講師,博士,從事病原微生物學研究。
收稿日期 2024-02-23
蟬(Cicadidae)是昆蟲綱,半翅目,蟬科(Hemiptera: Cicadidae)的昆蟲。其活動范圍廣泛,全球均有分布,全世界有180個屬,2 000余個種類[1]。在我國,蟬科昆蟲從南到北均有分布,其危害宿主種類很多,包括蘋果樹、梨樹、櫻桃、杏、棗、柑橘等多種果樹,楊樹、柳樹、榆樹、茶樹等觀賞樹木或經濟作物[2-3]。蟬是吸汁性害蟲,主要以幼蟲蟲態危害植物根部及幼嫩部分,成蟲蟲態在樹枝產卵繁殖,嚴重影響林木的生長,危害其產物的數量和品質[2-3]。對蟬科害蟲的防治方法很多,第一類是不同化學藥劑,如吡蟲啉和苦參堿、撲虱靈和氟氯氰菊酯乳油、阿維菌素乳等[4-6]。第二類是生物防治策略,生物防治包括天敵防治,比如使用寄生蜂、蜘蛛、螳螂等[7-9],以及微生物的防治方法,比如使用大孢巴科霉(Batkoa major)和球孢白僵菌(Beauveria bassiana )[10]。化學防治方法,雖然效率較高,但容易對環境造成污染,影響非靶標的生物,包括其他昆蟲和人類健康,也可能影響天敵種群而導致害蟲二次爆發。因此使用生物學的方法來防治害蟲,專一性強,不易產生抗藥性,對人類和生態環境綠色無毒。蟲生真菌寄生在特定昆蟲的幼蟲或成蟲體內[11],通常對人類、非靶標生物安全無害,而且能夠在害蟲中,自然條件下廣泛流行,因此在農業和林業害蟲生物防治過程中發揮著重要作用[12-13]。筆者分離自然界中蟬的蟲生真菌,通過形態學和分子生物學進行種類鑒定,對進一步利用蟲生真菌綠色防治蟬等害蟲提供菌種資源。
1 材料與方法
1.1 樣品采集
蟬的僵蟲采自四川省射洪市鄉村自然生長的柏樹。僵蟲體表布滿乳黃色或白色菌絲,使用無菌袋帶回實驗室。采集的僵蟲在室內陰干30 d后置于無菌紙盒中,室溫條件下存放。
1.2 蟬蟲生真菌寄生現象觀察
用針灸針挑取蟬體表的分生孢子,切取1小塊馬鈴薯葡萄糖瓊脂培養基(PDA),置于滅菌的載玻片上,置于超凈工作臺的顯微鏡下觀察。鏡檢發現圓形的分生孢子。
1.3 蟬蟲生真菌分離
配置PDA培養基(potato dextrose agar medium),加氨芐青霉素至終濃度為100 μg/mL。超凈工作臺上,使用無菌剪刀剪一小塊蟬僵蟲組織,使用75%乙醇浸泡5 s,再用無菌水沖洗3次,使用無菌接種環挑取孢子,在PDA培養基上劃線分離純化,在25 ℃的培養箱中培養,通過多次劃線分離單菌落,從而獲得純培養。
1.4 菌落及菌絲、孢子形態觀察
純培養真菌在培養基上生長6 d后,觀察菌落形態。切取菌落邊緣小塊菌絲,在載玻片上壓片,使用徠卡光學顯微鏡(Leica DMi8,美國)觀察菌絲和孢子發育情況。使用滅菌的無紡布將孢子過濾,置于血球計數板或普通載玻片上,利用光學顯微鏡進行觀察。
1.5 PCR擴增蟲生真菌ITS序列及分析
將滅菌玻璃紙鋪在PDA培養基上,接種純化的真菌,于25 ℃培養箱中培養5~7 d,揭開玻璃紙,收獲菌體,使用CTAB法提取真菌基因組DNA。使用通用引物擴增真菌rDNA基因ITS序列,引物由生工生物工程(上海)股份有限公司合成,引物序列為ITS1(5′-TCCGTAGGTGAACCTGCGG-3′),ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[14],PCR擴增體系為50 μL,包含真菌基因組DNA模板1 μL,上、下游引物各1 μL(10 μmol/L),10×Taq Plus Buffer 5 μL,dNTP Mixture(2.5 mmol/L) 4 μL(天根生化科技(北京)有限公司,中國北京),Taq Plus DNA Polymerase (2.5 U/μL) 0.5 μL,ddH2O補足為50 μL。使用PCR熱循環儀(賽默飛,美國)進行擴增,反應程序為94 ℃預變性3 min,94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸45 s, 30個循環,最后 72 ℃延伸 5 min。使用1%瓊脂糖凝膠電泳檢測 PCR 產物,獲得清晰的單一預期條帶后直接送至生工生物工程(上海)股份有限公司測序。將所獲序列在 NCBI 的 GenBank 數據庫中與已知序列進行 Blast 比對。選擇與該試驗得到的菌株相似性較高的其他真菌ITS序列,利用 Mega 11.0 軟件進行系統分析,用鄰接法(Neighbor-joining method,N-J 法)構建 ITS 序列的系統進化樹[15]。
2 結果與分析
2.1 蟲生真菌形態觀察
分離純化得到了3個蟲生真菌菌株,分別命名為Y1、Y3和Y6。其中,菌株Y1 在 PDA 培養基上絲狀菌絲呈放射性生長,菌絲最初為白色,短而致密,生長緩慢,有分支和分隔,待菌落開始產孢后,逐漸變為黃棕色,孢子為黃棕色,菌落背面和正面顏色相同,都是黃棕色。具有3級分生孢子梗,孢子圓形,如圖1所示。
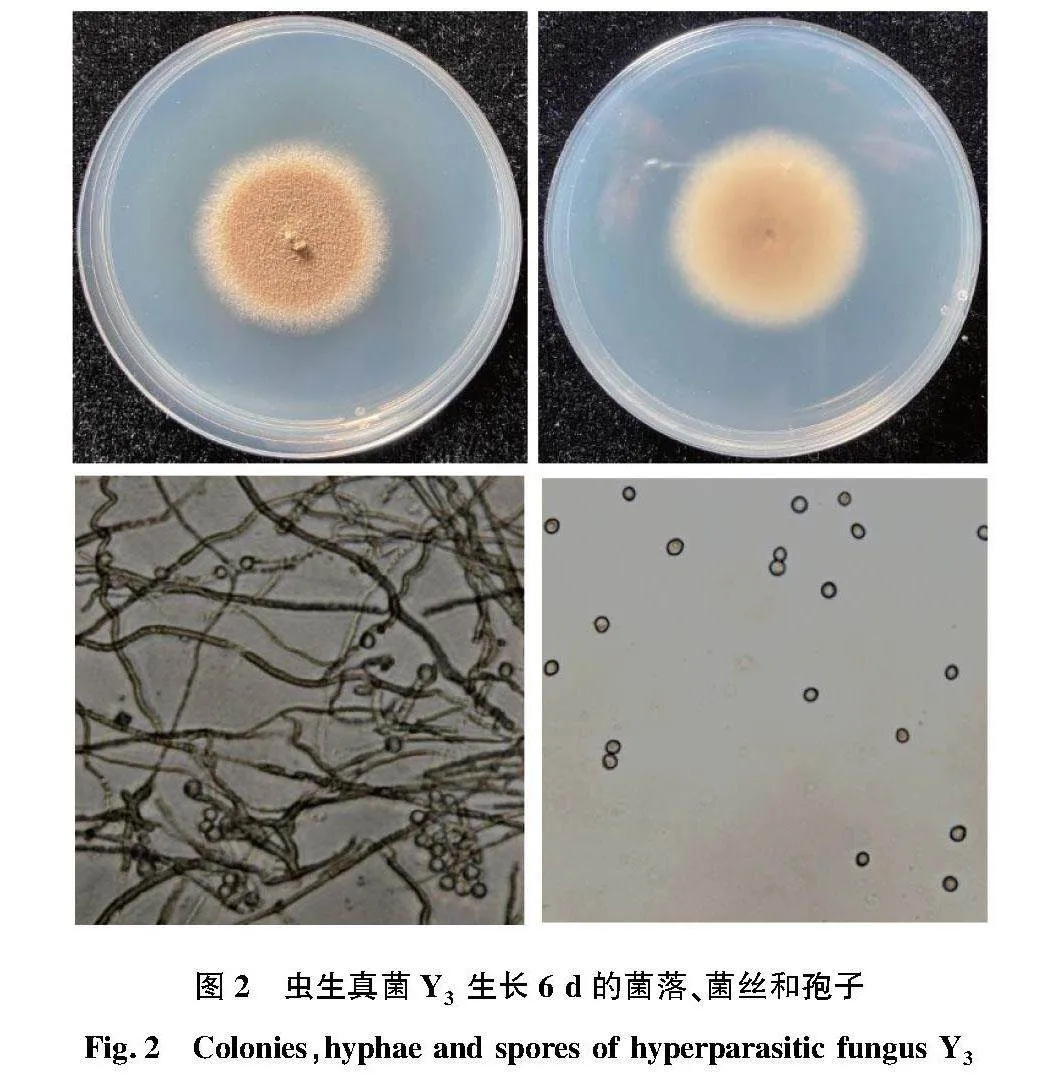
真菌菌株Y3形態與Y1相似,在 PDA 培養基上菌絲放射性生長,最初為白色,短而致密,生長緩慢,菌絲有分支分隔,孢子為黃棕色,菌落背面也為黃棕色。具有3級分生孢子梗,孢子圓形,如圖2所示。
真菌菌株Y6在 PDA 培養基上菌絲為白色,短而致密,生長緩慢,菌絲有分支分隔,孢子為白色,菌落正面背面都是白色。分生孢子發育時,分生孢子梗末端膨大,孢子圓形或橢圓形,如圖3所示。
2.2 蟬蟲生真菌的ITS序列
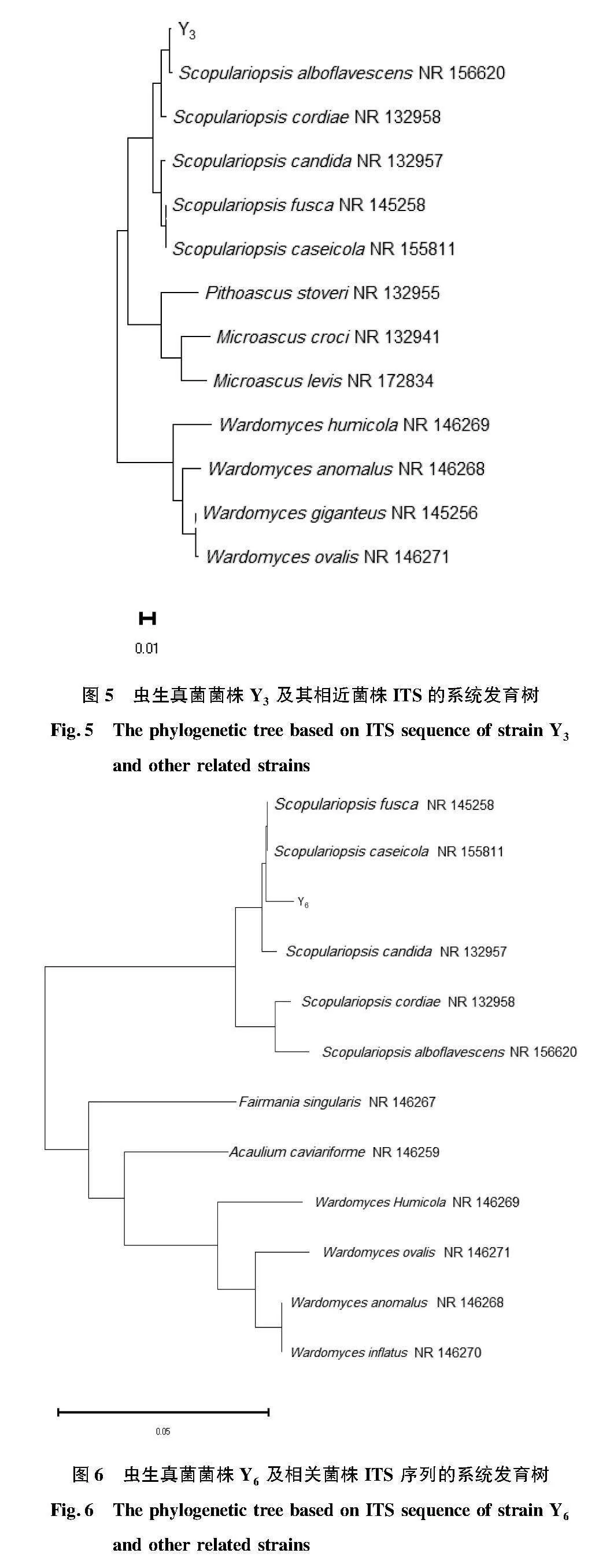
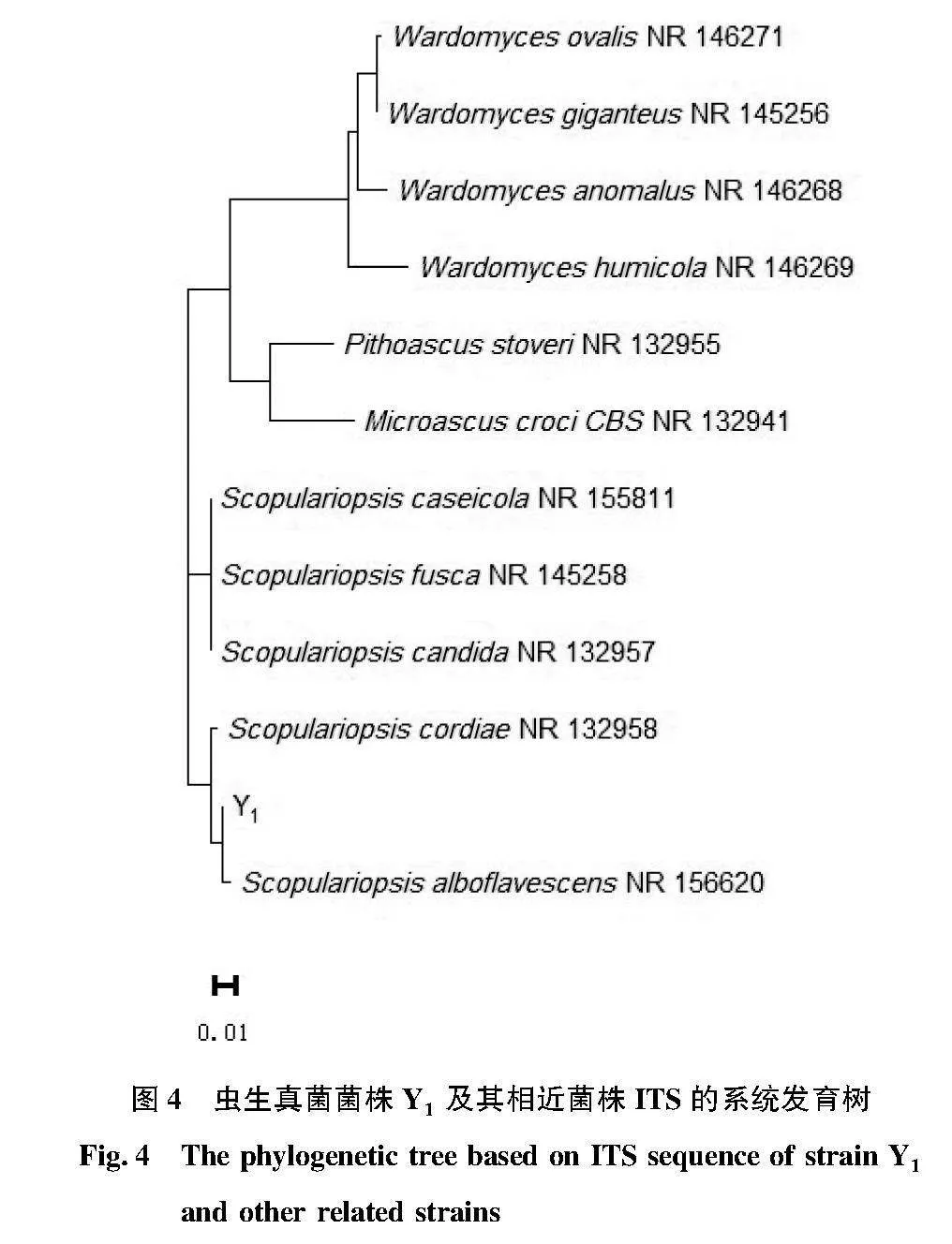
使用真菌通用引物ITS1/ITS4對菌株Y1、Y3和Y6的基因組DNA進行PCR擴增,均獲得了大小約600 bp的單帶,將PCR產物送至生工生物工程(上海)股份有限公司測序。蟲生真菌Y1的ITS序列為609 bp,測序結果表明,與帚霉屬真菌(Scopulariopsis alboflavescens)的相似度為98.29%,系統進化樹將真菌菌株Y1與S.alboflavescens(ACCESSION NR_15620)聚類到一支(圖4),初步鑒定蟲生真菌Y1為S.alboflavescens屬真菌。
蟲生真菌菌株Y3的ITS序列為612 bp,在NCBI數據庫中與帚霉屬真菌Scopulariopsis alboflavescens相似度為98.45%,系統進化樹將真菌菌株Y3與S.alboflavescens(ACCESSION NR_15620)聚類到一起(圖5),初步鑒定菌株Y3為S.alboflavescens屬真菌。
蟲生真菌菌株Y6的ITS序列為642 bp,與福斯卡帚霉Scopulariopsis fusca相似度98.66%,與Scopulariopsis caseicola的相似性為98.75%,系統進化樹將菌株Y6與S.caseicola
(ACCESSION NR_155811)、福斯卡帚霉S.fusca(ACCESSION NR_145258)聚類到一起(圖6),初步認定其是一種S.caseicola屬的真菌。
3 討論
該研究所獲得的3種蟬的蟲生真菌,均為帚霉屬Scopulariopsis屬真菌,包括2株S.alboflavescens菌株和1株S.caseicola菌株。帚霉屬有性期隸屬于子囊菌門Ascomycota,真子囊菌綱Euascomycetes,小囊菌目Microascales,小囊菌科Microascacea。無性期隸屬于半知菌亞門Deuteromycontina,絲孢綱Hyphomycetes,叢梗孢目Hyphomycetales,叢梗孢科Moniliaceae。
Scopulariopsis屬真菌是一種自然界中廣泛分布的真菌,多數不具有致病性,短帚霉(S.brevicaulis)可能在免疫力低下的情況下導致人類疾病[16]。有研究發現, S. alboflavescens可導致急性白血病患者的感染[17]。邵長倫等[18-19]使用柳珊瑚內生Scopulariopsis屬真菌制作喹唑啉(quinazoline)類生物堿化合物,具有抑制腫瘤細胞的功能。Scopulariopsis屬真菌感染昆蟲,有關其用于有害昆蟲防治的研究目前鮮見報道。
蟲生真菌作為生防菌株,用于害蟲防治,也越來越受到重視,并且已廣泛應用于生產。白僵菌(Beauveria bassiana)是一種子囊菌類的蟲生真菌,是最為廣泛使用的昆蟲生物防治劑之一,已廣泛應用于夜蛾、馬鈴薯塊莖蛾、鞘翅目昆蟲等多種害蟲的防治[19-21]。子囊菌科的綠僵菌(Metarhizium)被稱為排名第二的昆蟲病原真菌,僅次于白僵菌,寄主范圍廣,包括蛛形綱和大多數其他昆蟲目[22-23],已廣泛用于生物農藥開發應用[24-26]。林儼等[27]從蟬科昆蟲中分離到病原菌81株,并對多樣性進行了研究,發現寄生蟬科的真菌主要是球孢白僵菌、蟬花蟲草和綠色綠僵菌等。王軍等[28]研究了秦巴山區農林作物害蟲生防菌種資源,分離得到蟲生真菌187株,為該地區蟲生真菌資源的多樣性研究和開發利用奠定了基礎。
蟬是一種世界范圍內嚴重的樹木吸汁性害蟲,需要在綜合害蟲管理中使用不同的方法來防控。在我國農林業發展過程中,單一樹種密集種植,常常導致蟲害逐年嚴重[28]。該研究純化和鑒定到的Scopulariopsis屬3個真菌菌株均導致蟬的成蟲形成僵蟲,體表和體內長滿菌絲和孢子,在防治蟬方面具有一定潛力。該研究豐富了生防真菌菌種資源庫,將為蟬的生物防治提供新的參考依據,在農業和林業害蟲防治領域具有應用前景。在今后的研究中,將從這3種蟲生病原真菌與宿主蟬的相互作用、致病機理和實踐應用等方面展開研究。
參考文獻
[1]
王旭.中國蟬亞科系統分類研究(半翅目:蟬科)[D].楊凌:西北農林科技大學,2018:1-6.
[2] 畢守東,張書平,余燕,等.八點廣翅蠟蟬與其天敵空間關系的聚塊樣方方差分析[J].應用昆蟲學報,2019,56(1): 62-71.
[3] BERGH J C,NITA M,DYER J E,et al.Spatial distribution of 17-year periodical cicada (Hemiptera: Cicadidae) exuviae and oviposition injury in Mid-Atlantic,USA Apple orchards and implications for management[J].Crop Prot,2022,162:1-7.
[4] 樓君,滕瑩,蔡曉郡,等.柿廣翅蠟蟬生物學特性及防治技術[J].浙江農業科學,2021,62(7):1378-1381.
[5] 高宇,張睿,遇文婧.不同藥劑對樟子松松沫蟬防治效果[J].東北林業大學學報,2018,46(9):93-97.
[6] 謝中平.栗巢沫蟬防治效果試驗[J].現代農村科技,2020(7):75.
[7] 辛蓓,MANZOOR A,曹亮明,等.斑衣蠟蟬若蟲寄生蜂地理種群遺傳差異及早期快速檢測[J].昆蟲學報,2020,63(2): 218-228.
[8] LIU H P,MOTTERN J.An old remedy for a new problem?Identification of Ooencyrtus kuvanae (Hymenoptera:Encyrtidae),an egg parasitoid of NOxHwPZPsaLeOsQU188KLQ==Lycorma delicatula (Hemiptera:Fulgoridae) in north America[J].J Insect Sci,2017,17(1): 1-6.
[9] KIM I K,KOH S H,LEE J S,et al.Discovery of an egg parasitoid of Lycorma delicatula (Hemiptera: Fulgoridae) an invasive species in South Korea[J].J Asia Pac Entomol,2011,14(2):213-215.
[10] CLIFTON E H,CASTRILLO L A,GRYGANSKYI A,et al.A pair of native fungal pathogens drives decline of a new invasive herbivore[J].Proc Natl Acad Sci USA,2019,116(19): 9178-9180.
[11] CHARNLEY A K,COLLINSS A.Entomopathogenic fungi and their role in pest control[J].Environmental and microbial relationships,2007,4:185-201.
[12] 蒲蟄龍,李增智.昆蟲真菌學[M].合肥:安徽科學技術出版社,1996:297-304.
[13] 李增智.我國利用真菌防治害蟲的歷史、進展及現狀[J].中國生物防治學報,2015,31(5):699-711.
[14] WHITE T J,BRUNS T,LEE S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M].New York: Academic Press,1990:315-322.
[15] NEWMAN L,DUFFUS A L J,LEE C.Using the free program MEGA to build phylogenetic trees from molecular data[J].Am Biol Teach,2016,78(7): 608-612.
[16] SUTTON D A,RINALDI M G,SANCHE S E.Dematiaceous fungi[M]//ANAISSIE E J,MCGINNIS M R,PFALLER M A.Clinical mycology.2nd ed.Philadelphia,PA:Elsevier,2009:329-354.
[17] KURATA K,NISHIMURA S,ICHIKAWA H,et al.Invasive Scopulariopsis alboflavescens infection in patient with acute myeloid leukemia [J].Int J Hematol,2018,108(6):658-664.
[18] 邵長倫,王長云,胥汝芳.一種生物堿類化合物及其制備方法與作為腫瘤細胞生長抑制劑的應用:CN201310130315.3[P].2014-02-12.
[19] SHAO C L,XU R F,WEI M Y,et al.Structure and absolute configuration of fumiquinazoline L,an alkaloid from a gorgonian-derived Scopulariopsis sp.fungus [J].Nat Prod,2013,76(4):779-782.
[20] AAK A,HAGE M,RUKKE B A.Biological control of Cimex lectularius with Beauveria bassiana:Effects of substrate,dosage,application strategy,and bed bug physiology [J].Pest Manag Sci,2023,79(11): 4599-4606.
[21] ZHANG M D,WU S Y,YAN J J,et al.Establishment of Beauveria bassiana as a fungal endophyte in potato plants and its virulence against potato tuber moth,Phthorimaea operculella (Lepidoptera: Gelechiidae) [J].Insect Sci,2023,30(1):197-207.
[22] SAIF I,SUFYAN M,BABOO I,et al.Efficacy of Beauveria bassiana and Metarhizium anisopliae against wheat aphid[J].Euro Biotech J,2024,8(1): 23-31.
[23] MASCARIN G M,KOBORI N N,DE JESUS VITAL R C,et al.Production of microsclerotia by Brazilian strains of Metarhizium spp.using submerged liquid culture fermentation[J].World J Microbiol Biotechnol,2014,30(5):1583-1590.
[24] AMARESAN N A K.Beneficial microbes in agro-ecology:Bacteria and fungi[M].Amsterdam:Academic Press,2020:593-610.
[25] RIAO L J G,BARRERA G P,HERNNDEZ L C,et al.Microsclerotia from Metarhizium robertsii:Production,ultrastructural analysis,robustness,and insecticidal activity[J].Fungal Biol,2024,128(2):1643-1656.
[26] SARKER S,CHOI H W,LIM U T.Evaluation of new strain (AAD16) of Beauveria bassiana recovered from Japanese rhinoceros beetle: Effects on three coleopteran insects[J].PLoS One,2024,19(1):1-13.
[27] 林儼,汪婷,張勝利,等.蟬科昆蟲病原真菌物種多樣性[J].菌物學報,2023,42(3):663-676.
[28] 王軍,張琨,張緒,等.秦巴山區蟲生真菌的分離鑒定與多樣性分析[J].西北農林科技大學學報(自然科學版),2021,49(6):122-129.

