兩種方法在乳粉中金黃色葡萄球菌(定量)能力驗證中的應用
摘 要:目的:驗證本實驗室定量檢測金黃色葡萄球菌能力,提升檢測技術和服務水平。方法:應用國標方法與3M PetrifilmTM金黃色葡萄球菌測試片計數法兩種方法進行金黃色葡萄球菌定量檢測。結果:國標方法測得乳粉樣品(TF04900003)金黃色葡萄球菌的含量為7 900 CFU·g-1,乳粉樣品(TF04900004)金黃色葡萄球菌的含量為8 400 CFU·g-1,驗證結果為滿意。結論:本實驗室具備金黃色葡萄球菌定量檢測能力。
關鍵詞:金黃色葡萄球菌;能力驗證;3M PetrifilmTM金黃色葡萄球菌測試片
Application of Two Methods in Quantitative AbilityVerification of Staphylococcus aureus in Milk Powder
YANG Shengmei, XIN Cuixia, GAO Pinglin, TIAN Xiaoqin, WU Qiqi, DUAN Aili*
(Wuwei City Food Inspection Testing Center, Wuwei 733000, China)
Abstract:Objective: To verify the quantitative detection capability of Staphylococcus aureus in our laboratory and improve the detection technology and service level. Method: Two methods, namely the national standard method and the 3M PetrifilmTM Staphylococcus aureus test strip counting method, were used for quantitative detection of Staphylococcus aureus. Result: The content of Staphylococcus aureus in the milk powder sample (TF04900003) was determined to be 7 900 CFU·g-1 by the national standard method, and the content of Staphylococcus aureus in the milk powder sample (TF04900004) was 8 400 CFU·g-1. The verification results are satisfactory. Conclusion: This laboratory has the ability to quantitatively detect Staphylococcus aureus.
Keywords: Staphylococcus aureus; capability verification; 3M PetrifilmTM Staphylococcus aureus test strip
能力驗證是評價實驗室技術能力的有效手段,也是實驗室進行質量控制的重要環節[1]。金黃色葡萄球菌是革蘭氏陽性菌,在自然界廣泛分布,能引起嚴重的化膿性感染和疾病,對人類呼吸道、皮膚、血液及腸道等組織均具有一定的攻擊性[2]。金黃色葡萄球菌繁殖過程產生的腸毒素,是引發食物中毒的主要致病因子[3]。國家對食品、藥品及化妝品等產品中的金黃色葡萄球菌限量進行明確規定,其中,《化妝品安全技術規范》《中華人民共和國藥典》中規定金黃色葡萄球菌不得檢出,《食品安全國家標準 預包裝食品中致病菌限量》(GB 29921—2021)[4]中規定巴氏殺菌乳、調制乳、發酵乳、加糖煉乳(甜煉乳)和調制加糖煉乳中金黃色葡萄球菌不得檢出,乳制品中干酪、再制干酪和干酪制品,肉制品,糧食制品,即食豆制品,即食果蔬制品,冷凍飲品,即食調味品的殘留限量允許為采樣量5,最多允許有2個值在100~1 000 CFU·g-1(mL-1)。《食品安全國家標準 散裝即食食品中致病菌限量》(GB 31607—2021)[5]要求散裝即食食品金黃色葡萄球菌≤1 000 CFU·g-1(mL-1)。金黃色葡萄球菌常見的檢測方法為國標方法,該方法要先進行傳統生物學培養,再進行生化鑒定,其中生化鑒定步驟復雜,檢測時間長且易出現假陰性,本文采用國標方法進行檢驗的同時應用3M PetrifilmTM金黃色葡萄球菌測試片計數輔助判斷試驗結果,有效確保了實驗結果準確性。
1 材料與方法
1.1 材料與儀器
1.1.1 樣品來源
NIFDC-PT-490乳粉中金黃色葡萄球菌(定量)檢驗能力驗證共發放2份待測樣品,樣品編號為TF04900003、TF04900004(實驗室內部編號為1、2),每份樣品包含1個菌球與1袋奶粉基質,均由中國食品藥品檢定研究院提供。
1.1.2 標準菌株
陰性對照菌株:大腸埃希氏菌ATCC25922-1;陽性對照菌株:金黃色葡萄球菌ATCC6538-1,兩種菌株均為本實驗室的儲備菌株。
1.1.3 培養基及試劑
無菌生理鹽水、Baird-Parker平板(BP平板)、血瓊脂平板(血平板)、凍干血漿、腦心浸出液肉湯(BHI肉湯)、營養瓊脂小斜面(NA斜面)以及革蘭氏染色液,均購自北京陸橋生物技術有限公司;3MPetrifilmTM金黃色葡萄球菌測試片,購自3M公司。
1.1.4 儀器與設備
立式壓力蒸汽滅菌器,冰山松洋生物科技(大連)有限公司;無菌均質器,上海比郎儀器制造有限公司;立式智能生化培養箱,上海一恒科學儀器有限公司;生物安全柜,蘇州市華宇凈化設備有限公司;移液槍,艾本德中國有限公司;生物顯微鏡,麥克奧迪實業集團有限公司。
1.2 試驗方法
1.2.1 樣品前處理
在生物安全柜內,取225.0 mL滅菌生理鹽水加入無菌均質袋內,將西林瓶內編碼為TF04900003小球加入生理鹽水中,充分溶解,再將與小球相同編碼的奶粉樣品25 g加入滅菌生理鹽水中,用無菌均質器均質2 min,制成10-1的樣品勻液,用移液槍吸取1 mL樣品勻液,加入9 mL生理鹽水中,制成10-2的樣品稀釋液,按以上步驟依次制成10-3、10-4、10-5的樣品稀釋液,TF04900004樣品重復上述操作。
1.2.2 樣品涂布及培養
將1.2.1中5個稀釋度的樣品勻液以0.30 mL、0.30 mL、0.40 mL的量分別接種于BP平板上,并用L棒均勻涂布平板,注意樣品盡量不要涂布到平板邊緣,涂布結束后,正置平板于36 ℃培養箱中,吸收1 h后倒置平板,繼續培養48 h。
1.2.3 典型菌落計數與確認
篩選符合金黃色葡萄球菌典型特征的平板,選擇同一濃度3個平板典型菌落數之和在20~200 CFU的平板計數,同時進行生化驗證。從所選擇的平板上挑取至少5個可疑菌落,分別做革蘭氏染色鏡檢、血漿凝固酶試驗并接種血平板觀察菌落形態,同時以金黃色葡萄球菌ATCC6538-1菌種作為陽性對照,以大腸埃希氏菌ATCC25922-1作為陰性對照。①革蘭氏染色鏡檢。根據試劑盒說明書從每份樣品中選取5個可疑菌落進行染色鏡檢,并在顯微鏡下觀察。②血漿凝固酶試驗。將挑取的5個可疑性菌落接種到5 mL腦心浸出液肉湯中,同時接種營養瓊脂小斜面,放置于36 ℃培養箱中培養24 h后,取培養物0.3 mL加入0.5 mL凍干血漿中,振蕩搖勻后,放置于36 ℃培養箱中培養,6 h內定時觀察血漿凝固情況。③血平板。在接種腦心浸出液肉湯和營養瓊脂小斜面的同時劃線接種血平板,36 ℃培養24 h后觀察菌落形態。
1.2.4 3MPetrifilmTM金黃色葡萄球菌測試片計數
將3MPetrifilmTM金黃色葡萄球菌測試片平鋪在無菌臺面上,揭開表面的膜,分別取5個濃度的稀釋液1 mL加入測試片中心,再將表面膜緩緩蓋上,用無菌鑷子輕輕按壓,使樣液盡可能均勻分布于圓形培養面,靜置,待培養基凝固后將測試片透明面向上放回原自封袋中進行培養,培養條件為36 ℃,24 h左右,每個濃度做2個平行實驗,接種無菌生理鹽水1 mL作為陰性對照。
2 結果與分析
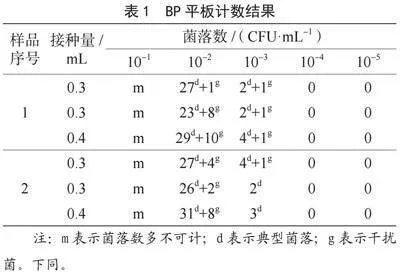
2.1 BP平板計數
樣品1和2在BP平板上有3種形態,一種呈圓形、黑色菌落,表面光滑、凸起、濕潤,菌落直徑為2~3 mm,有淺色邊緣,周圍繞以不透明圈,其形態和金黃色葡萄球菌典型菌落形態相符合,標記為典型菌落;一種與典型菌落大小、顏色相似,無淺色邊緣,也無不透明圈,與金黃色葡萄球菌典型形態不符合,為干擾菌,排除;另一種有淺色邊緣及不透明圈,但較前兩種菌直徑較小,約為1 mm,不符合金黃色葡萄球菌直徑范圍,也是干擾菌,排除。經過對有典型菌落的平板進行計數,篩選出適宜計數菌落濃度為10-2,分別計數樣品1和2在各個濃度上的菌落數,結果見表1。
2.2 生化鑒定結果
樣品1和2各5個可疑菌落經過革蘭氏染色后,在100倍鏡下均為藍紫色,呈葡萄球狀排列,無莢膜,無芽孢,鏡檢結果與陽性標準菌株ATCC6538-1一致,為革蘭氏陽性菌。將樣品1、2各5個可疑菌落腦心浸出液肉湯培養物接種于凍干血漿后每30 min觀察1次,均于3 h后開始凝固,4 h后基本凝固,陽性標準菌株ATCC6538-1于2 h后開始,3 h后完全凝固,陰性對照ATCC25922-1觀察至6 h結束時,未出現凝固。樣品1、2各5個可疑菌落經血平板培養后均表現為菌落形態較大、圓形、濕潤、周圍可見較大透明溶血圈,與陽性標準菌株ATCC6538-1在血平板上的形態一致,陰性對照ATCC25922-1在血平板上無菌落生長,經生化鑒定,樣品1、2各5個可疑菌落均為金黃色葡萄球菌,鑒定后計算結果為7 900 CFU·g-1、8 400 CFU·g-1。
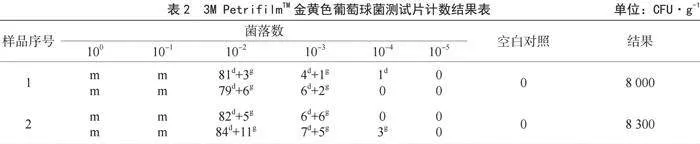
2.3 3M PetrifilmTM金黃色葡萄球菌測試片結果
經培養后,測試片中出現紫紅色和藍綠色兩種形態的菌落,對照3M PetrifilmTM金黃色葡萄球菌測試片說明書,紫紅色的菌落是金黃色葡萄球菌,而除紫紅色外的其他顏色菌落為干擾菌,排除,對兩種菌落進行計數,確定10-2為最適宜計數濃度,將該濃度金黃色葡萄球菌計數結果乘以相應濃度得樣品1菌落結果為8 000 CFU·g-1,樣品2菌落結果為8 300 CFU·g-1,計數片結果如表2所示。
3 結論與討論
本次能力驗證,國標方法與3M PetrifilmTM金黃色葡萄球菌測試片計數法測得乳粉樣品中金黃色葡萄球菌含量十分相近,進一步驗證了國標方法結果的準確性,填報時以作業指導書中規定的國標方法結果為準,最終組織能力考核單位根據所有參加能力考核單位的結果計算的本次能力驗證結果為滿意。通過本次能力驗證總結出以下注意事項。①考核樣檢測一定要根據作業指導書操作,尤其是樣品前處理,要反復研讀作業指導書中的操作步驟,再進行操作。②BP平板接種樣品前,要先將平板上的水珠放在生物安全柜內出風口烘干,如果未烘干,接種平板后,平板吸收緩慢,易出現菌落連片生長現象,不易觀察計數。③血漿凝固酶試驗最適觀察時間為每30 min觀察1次,避免觀察太頻繁或觀察時晃動力度過大,將凝固塊搖碎,影響結果判斷。
參考文獻
[1]路桂芬,韓深.以新版《檢測和校準實驗室能力認可準則》(CNAS-CL01:2018)要求開展檢測方法驗證的問題及解決方法[J].食品安全質量檢測學報,2020,11(2):638-642.
[2]韓塔拉,王俊瑞.金黃色葡萄球菌異質性耐藥機制及實驗室檢測技術[J].中國感染控制雜志,2022,21(12):1249-1256.
[3]易小利,陳玟妃.食品中金黃色葡萄球菌檢測能力驗證結果分析與討論[J].現代食品雜志,2024,30(7):168-172.
[4]中華人民共和國國家衛生健康委員會,國家市場監督管理總局.食品安全國家標準 預包裝食品中致病菌限量:GB 29921—2021[S].北京:中國標準出版社,2021.
[5]中華人民共和國國家衛生健康委員會,國家市場監督管理總局.食品安全國家標準 散裝即食食品中致病菌限量:GB 31607—2021[S].北京:中國標準出版社,2021.
作者簡介:楊生梅(1992—),女,甘肅武威人,碩士,工程師。研究方向:食品微生物檢測。
通信作者:段愛莉(1986—),女,甘肅定西人,碩士,高級工程師。研究方向:食品安全檢測。E-mail: 404615320@qq.com。

