從“心主血脈”探討銅死亡在冠心病中的發病機制及中醫藥干預研究
〔摘要〕 冠心病(coronary heart disease,CHD)的患病率和死亡率逐年上升,而銅死亡與CHD的形成發展具有重要關系,可通過血管損傷、引發炎癥反應、增加總膽固醇水平等方式促進CHD發展。銅死亡是一種新型的、銅依賴的細胞程序化死亡方式,與氧化應激、抑制泛素-蛋白酶體系統、誘導脂酰化蛋白聚集等多種途徑有關,并參與多種疾病的病理過程。銅死亡可雙向致病,人體內銅缺乏或積累過多均會對健康造成影響,維持體內銅濃度平衡可能成為藥物干預銅死亡的重要靶點。心主血脈是中醫藏象學說的重要理論之一。從心主血脈理論出發,結合銅死亡在CHD中的發病機制,闡述中醫藥如何干預銅死亡進展和思路,為藏象學說現代應用及中醫藥治療CHD提供新依據和新靶點。
〔關鍵詞〕 銅代謝;銅死亡;冠心病;中醫藥;心主血脈
〔中圖分類號〕R256.2 〔文獻標志碼〕A 〔文章編號〕doi:10.3969/j.issn.1674-070X.2024.10.030
Pathogenesis of cuproptosis in coronary heart disease and Chinese
medicine intervention from the perspective of "the heart
governing the blood and vessels"
YANG Yi1,2, CHEN Lingli1,3, ZHANG Shumeng1,2, YU Zixuan1,2, LI Jie1,2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Key Laboratory of Chinese Medicine Diagnostics, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 3. Hunan Key Laboratory of Pathogeny Biology of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 The prevalence and mortality rates of coronary heart disease (CHD) have been increasing year by year. Cuproptosis plays a significant role in the formation and progression of CHD, promoting CHD development by inducing vascular injury, triggering inflammatory reaction, and elevating total cholesterol levels. Cuproptosis is a novel, copper-dependent form of programmed cell death associated with multiple pathways, including oxidative stress, inhibition of the ubiquitin proteasome system, and induction of lipid-acylated protein aggregation, and it is involved in the pathological processes of various diseases. Cuproptosis can lead to disease in both directions, and deficiency or excessive accumulation of copper in the human body can impact health. Thus, maintaining a balanced copper concentration in the body may become an important target for drug intervention in cuproptosis. "The heart governing the blood and vessels" is one of the important theories in the zang-xiang theory of Chinese medicine. Based on the theory and the pathogenesis of cuproptosis in CHD, this paper elucidates how Chinese medicine intervenes the progression of cuproptosis, offering new evidence and targets for the modern application of zang-xiang theory and the treatment of CHD with Chinese medicine.
〔Keywords〕 copper metabolism; cuproptosis; coronary heart disease; Chinese medicine; the heart governing the blood and vessels
心血管疾病是人類死亡的重要原因,給社會和個人帶來巨大壓力,而冠心病(coronary heart disease,CHD)是其最主要因素。CHD是由冠狀動脈粥樣硬化引起管腔狹窄或阻塞,造成心肌血、缺氧或壞死而導致的心臟病,是我國最常見的心血管系統疾病之一,其臨床發病率和死亡率逐年上升并呈現低齡化趨勢[1]。銅作為人體必需微量元素,參與了幾乎所有細胞類型的生理過程。最新研究發現,銅死亡是一種區別于其他程序性細胞死亡(如鐵死亡、細胞凋亡、壞死)的新型死亡方式[2]。銅質增生通過銅與三羧酸(tricarboxylic acid cycle, TCA)循環中的脂酰化酶結合而發生,這導致隨后的蛋白質聚集,蛋白毒性應激,并最終導致細胞死亡[3]。與其他已知的細胞死亡方式相比,銅死亡表現出獨特的生物學和形態學特征。既往研究發現,銅死亡在肝癌、類風濕關節炎、骨質疏松癥等多種疾病中發揮重要作用[4-6]。此外,有研究發現,銅死亡在通過破壞血管完整性和功能、促發炎癥反應、影響機體膽固醇水平等方面調控疾病進展[7]。而利用銅離子載體將銅輸送到細胞中、銅螯合劑及銅伴侶抑制劑降低胞內銅離子濃度是目前靶向銅誘導CHD中銅的潛在療法[8]。
藏象學說作為中醫理論體系之核心,對疾病的防治及康復具有重大指導意義[9],“心主血脈”作為其理論之一,高度概括了心臟的主要生理功能,即心主持全身的血液和脈管,推動血液循行于脈中,發揮濡養全身的功能,并強調血液正常運行的基本條件是心氣充沛、血液運行和脈道通利[10]。膽固醇水平升高、血管損傷、血管炎癥反應與中醫“心主血脈”功能失調類似,其實質為血流不暢及脈道不通,均能促發CHD[11]。推動血液流動及恢復脈道通利也可能成為藥物干預疾病的重要靶點。中醫藥具有價格低廉、 多靶點協同作用的優勢,銅死亡在CHD中的發病機制以及中醫藥對該機制的干預作用,值得進行深入探討與研究。因此,本文對銅死亡的代謝及在CHD的作用機制及中醫藥相關性作一總結。
1 銅死亡特征
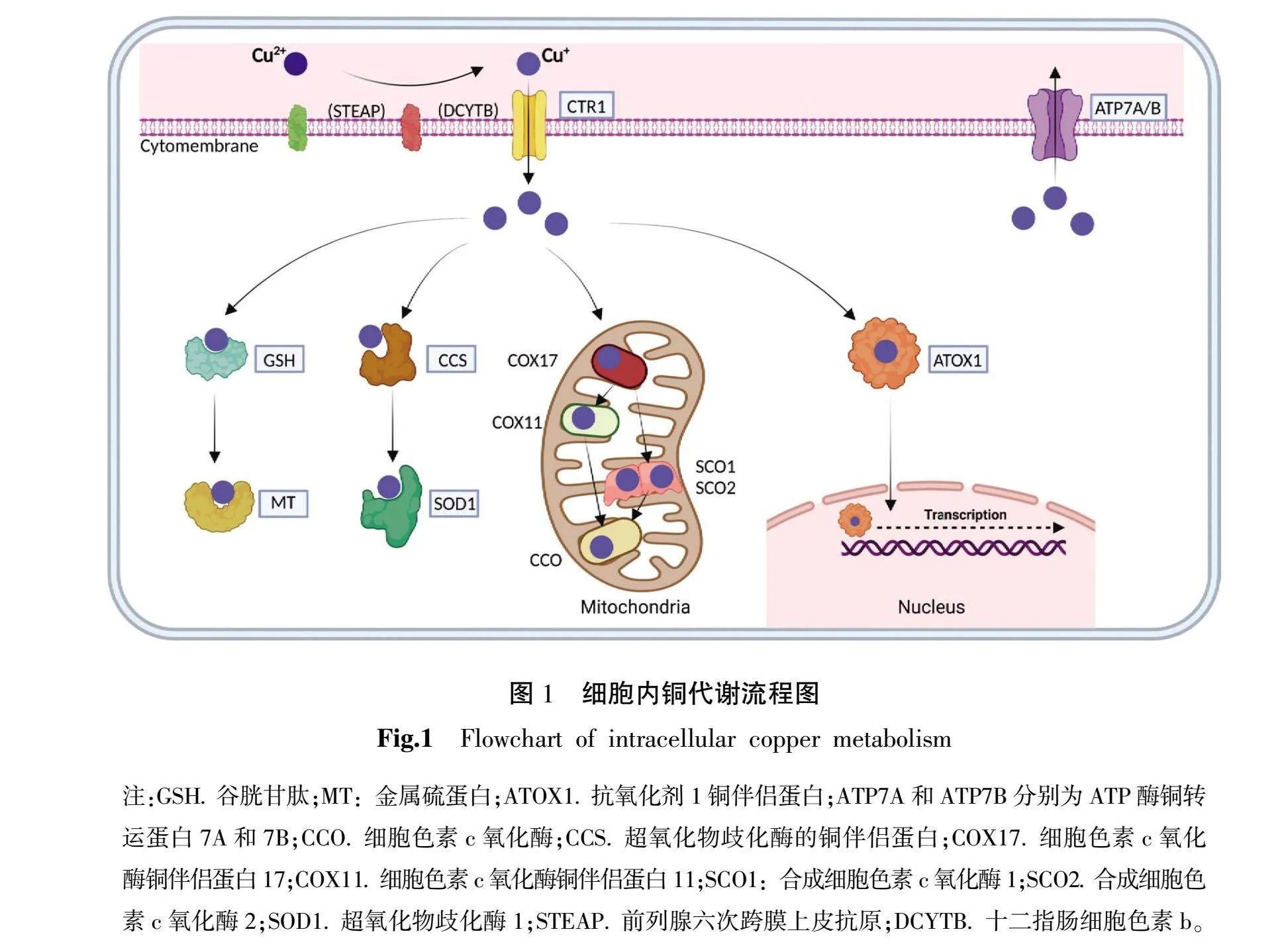
銅是人體各種生理過程中必需的微量元素,對生理功能起著重要的調控作用,如圖1。銅死亡是一種新近發現和定義的細胞死亡方式,由TSVETKO等[12]首次提出。從形態上看,銅死亡會表現出線粒體的收縮、細胞膜的破裂、內質網的損傷以及染色質的破裂等一系列主要形態學特征,這些特征與凋亡方式相似,但其內在機制又與其他細胞死亡方式不同[13-15]。從生化角度觀察銅以兩種形式存在于體內,亞銅離子(Cu+)和銅離子(Cu2+),并參與多種生理反應。人們主要從食物中獲取銅,銅在食物中以Cu2+形式存在,通過吸收和運輸進入肝細胞,并通過銅藍蛋白將銅輸送到身體各部位。銅的穩態失衡會導致細胞內銅濃度升高,可通過芬頓反應、抑制泛素-蛋白酶體系統、與脂酰化蛋白結合等方式從而引發細胞損傷和銅死亡[16]。
2 銅死亡發生機制
當人體內銅穩態失衡,如銅積累過多或運輸不當,使體內銅濃度超過閾值,從而引起細胞受損乃至死亡[17]。(1)銅離子通過芬頓反應催化H2O2產生大量的活性氧(reactive oxygen species,ROS)[18],對細胞產生多方面的損害,包括損傷DNA[19]、干擾線粒體功能[20]、破壞細胞膜完整性等[21],導致細胞死亡。(2)銅離子通過抑制泛素-蛋白酶體系統抑制細胞蛋白酶活性并抑制細胞增殖[22]。(3)銅離子通過與脂肪酰化蛋白(丙酮酸、α-酮戊二酸、支鏈酮酸脫氫酶和甘氨酸切割系統)結合,誘導脂肪酰化蛋白聚集并抑制線粒體代謝功能以促使細胞腐爛[23],鐵氧還蛋白1(recombinant ferredoxin 1,FDX1)和硫辛酸合酶(recombinant lipoic acid synthetase,LIAS)在這一過程中起著至關重要的調節作用[24],其中,FDX1[25]是銅死亡的上游調節因子,其敲除或與脂酰化相關的酶可以阻止銅死亡的發生。
3 銅死亡與CHD的相關研究
動脈粥樣硬化(atherosclerosis,AS)是CHD的主要原因和疾病基礎。盡管銅在生理上是不可或缺的,但當體內的銅離子失衡的時候就會導致各種炎癥性血管疾病的發生,例如AS。以下從兩個方面探討銅死亡與CHD的相關研究。
3.1 銅死亡與CHD相關性
流行病學證據表明,體內血清銅水平的變化與AS風險增加具有相關性,具體表現在:(1)AS病變中銅的減少與血清銅濃度的增加有關,而血清銅濃度與AS病變的嚴重程度呈正相關[26-27],KOKSAL等[28]發現,在AS等病理炎性條件下,細胞內銅水平更高。(2)人類AS組織中銅濃度的差異可反映AS病變的階段。研究表明,鄰絡氨酸(銅誘導蛋白氧化的標志物)僅在晚期AS病變中檢測到,而不是在AS早期[29]。因此,推測銅水平僅在晚期AS組織中升高。另有研究發現,增加銅攝入量可以降低人類AS的風險[30],這表明早期AS患者病變中的銅濃度可能較低。(3)銅與AS病變的一個關鍵因素膽固醇代謝密切相關。LAMB等[31]在動物模型的研究中對喂食高膽固醇的家兔進行膳食銅補充,發現可有效預防動物模型中的AS,提示銅參與了膽固醇代謝。WANG等[32]發現,AS患者血漿銅水平隨著高膽固醇血癥的嚴重程度增加而升高。(4)銅水平與AS發生發展也受其他合并癥的影響。DIAF等[33]發現糖尿病患者的膳食銅攝入量與AS風險之間沒有顯著關聯,但在非糖尿病患者中,銅的攝入量與AS風險顯著相關。
3.2 銅促進CHD的潛在機制
近期研究表明,關于銅死亡與CHD的研究多是多維度分析,而銅促該疾病的潛在機制目前尚不清楚,銅死亡可能通過誘導氧化應激、炎癥反應、細胞焦亡等方式在促發AS中發揮作用。(1)研究發現,血清銅水平過高誘導ROS過量從而激活的氧化應激已經成為AS的關鍵發病機制,該環節可激活多種炎癥因子,引發血管炎癥[34];并且將滯留在內皮下的低密度脂蛋白氧化為氧化低密度脂蛋白,進而誘發內皮功能障礙,最終導致AS病變的惡化[35]。因此,推測氧化應激可能是銅過載誘導AS的可能機制之一。(2)當體內銅缺乏時會降低黏附分子(如ICAM-1
和VCAM-1)的表達,這些分子介導白細胞與活化的內皮細胞的黏附[36],從而誘發血管炎癥反應,促進AS病變發展。而使用TTM(銅螯合劑)能夠使ApoE-/-小鼠中的血清ICAM-1和VCAM-1水平以及主動脈和心臟中黏附分子、單核細胞趨化蛋白-1(mono-cyte chemotactic protein-1,MCP-1)和促炎細胞因子的mRNA水平顯著降低[37]。與此同時,主動脈巨噬細胞標志物,尤其是M1型巨噬細胞減少。這表明TTM通過螯合銅,降低了血管細胞中炎癥介質的表達,從而阻止了血管炎癥和AS病變的發展[38]。(3)有學者研究發現,銅過載能夠誘導細胞焦亡[39]。焦亡與AS的發展密切相關,一方面,在AS的初始階段內皮細胞焦亡能夠吸引單核細胞和其他炎癥細胞跨內皮募集;另一方面,在晚期的AS病變中,巨噬細胞的焦亡可能促進壞死核心的形成和斑塊的不穩定性[40]。此外,血管平滑肌細胞(vascular smooth
muscle cell,VSMC)焦亡可能釋放促炎因子,導致持續的炎癥,惡化AS,并導致斑塊的不穩定性[41]。銅過載與焦亡發生的相關研究尚不多見,可以此切入,將焦亡作為銅過載引發AS的可能機制進行探索。與此同時,有團隊發現了5個銅死亡相關基因(F5、MT4、RNF7、S100A12和SORD)作為潛在的CHD診斷生物標志物[42]。然而,CHD中銅穩態和銅死亡的病因學仍缺乏直接證據。
除此之外,普通人群缺乏精確的診斷方法,銅在促冠狀AS中的具體濃度仍未確定,需要進一步研究;目前銅死亡干預CHD靶點及藥物仍處于預測階段,需通過實驗加強驗證。鑒于銅的積累和銅的缺乏都可能對血管的完整性和功能有害,故維持銅穩態對于預防AS和相關心血管疾病至關重要。
4 心主血脈理論與銅死亡的相關性
在中醫理論中,心為“君主之官”,主宰人的整個生命活動[43]。而“心主血脈”是其重要生理功能之一。該理論出自《素問·痿論篇》中的“心主身之血脈”。心氣推動血液運行于脈中,流注全身,循環不休,發揮營養和濡潤作用。心為五臟六腑之大主,主宰人的整個生命活動。脈是承載和輸送血液的道路,而血是心和脈的重要作用對象。
心氣可以推動和調控脈道的舒縮,使脈道通利,血流通暢。線粒體作為細胞能量場所,與中醫理論“氣”具有一定關聯性。氣的變化可推動能量代謝,產生維持機體功能活動的能量。線粒體電子傳遞鏈(mitochondria electron transfer chain,mtETC)可通過銅離子產生高效ATP,而線粒體基質中銅濃度增加可消耗大量ATP,導致ATP水平下[44]。心氣虛時機體表現為“下降的、靜止的、抑制的”[45],與血清中銅離子濃度升高導致線粒體能量缺損可類比。當血清中銅離子濃度升高,大量消耗ATP,心氣則不足,進而主血脈功能失調,血行不利,停于脈中,產生瘀血,日久加重CHD發展。
心主血的基本內涵是心氣推動和調控血液運行,輸送營養物質及全身各臟腑形體官竅的作用。《諸病源候論·血淋候》中提到:“心主血,血之行身,通遍經絡,循環臟腑。”氣行則血行,心之病變與血運失調直接相關。心以陽氣為用,心陽虛不能溫運心氣,運血無力同時脈道失于溫煦則虛寒內生,血凝為瘀使脈道堵塞,進一步加重血瘀。此與血栓形成在病理認識方面較為相似,其機制為氧化應激及血小板活化所致,而銅在其中發揮了重要作用。氧化應激是銅死亡重要機制之一,早期可通過刺激血小板活化,增加血小板聚集性。LOMINADZE等[46]通過體外研究發現,銅缺乏大鼠血小板對內皮細胞的黏附顯著低于銅充足大鼠。經二磷酸腺苷(adenosine diphosphate,ADP)誘導的銅缺乏大鼠血小板聚集性顯著高于銅充足大鼠。結果表明,飲食中銅缺乏可能導致血小板血管性血友病因子(von willebrand factor,vWF)減少和血小板纖維蛋白原增加,使得血小板與內皮細胞的黏附性減少,血小板聚集性增大,從而促進血栓形成,加速CHD進展。
心主脈,脈為血之府,是容納和運輸血液的通道。《素問·六節藏象論篇》提示:“心者,其充在血脈。”心陰與心陽協調,脈道通利,則血運流暢;脈道壅滯,則血液無法輸送至全身。此現象與血管病理變化在機制方面具有一定的相似性,而體內銅穩態失衡是促血管內皮損傷的重要因素。研究表明[47],當體內銅濃度升高時,銅可直接作用于血管內皮或通過脂蛋白代謝,將超氧化物和過氧化氫轉化為高度有害的羥自由基,從而損害內皮細胞,加速CHD進展。血管內皮激活的特征是細胞黏附分子和促炎趨化因子上調。銅通過附著在血漿蛋白(如銅藍蛋白、反式銅蛋白、白蛋白和其他血漿蛋白)上進入血液循環后被輸送至心臟[48]。Cu(Ⅱ)影響生長因子和細胞膜受體之間的相互作用。當Cu(Ⅱ)進入細胞膜后,金屬還原酶將其還原為Cu(Ⅰ),Cu(Ⅰ)控制細胞質中眾多細胞器的氧化還原平衡,并通過改變磷酸酶的結構直接調節激酶活性,從而改變質膜中生長因子受體的激活狀態,銅離子發生還原并生成羥基自由基引發與DNA和脂質的反應,相應地損害內皮細胞,并誘導心血管系統中的DNA損傷和脂質過氧化[49]。當體內銅濃度降低,可能通過降低SDO1水平導致NO水平下降[50],進而血管內皮功能受損,無法產生血管舒張所需的足夠量的生物活性物質,故血管舒張性減小,同時加重氧化應激。以上兩種情況均可促進CHD進展。
5 中醫藥干預銅死亡誘導CHD的研究進展
銅死亡是多種疾病的重要機制,可被單味藥及其活性成分等療法干預,提示調控銅死亡可能是防治CHD的潛在方式。CHD的西醫病理基礎為AS,其對應中醫基礎理論為心主血脈異常,而中醫藥對銅死亡誘導CHD具有干預作用,主要體現在養心血和通心脈兩個方面。
5.1 養心血
從中醫學角度看,陰虛為血虛之漸,陰虛則其滋潤、濡養功能減弱,使心臟缺血、缺氧而疼痛痙攣,誘發CHD加重。從西醫角度看,心肌缺血、缺氧誘發的能量障礙可與血栓栓塞互為因果關系。當心肌能量障礙收縮無力時,心房向心室排血受阻,導致左心房內壓升高,血流速度減慢,形成渦流,容易引起血栓形成;當血栓隨血液流動堵塞冠狀動脈時,又會影響心臟的血液灌注量,導致心臟的供氧減少,出現能量障礙。因此,可從活化血小板角度來觀察中藥干預情況。丹參注射液主要成分是從中藥材丹參的根莖中提取的棕色至棕紅色水溶性酚酸類物質,具有一定程度的抗凝和溶栓作用[51]。研究發現,酚酸類物質因其羥基和羧基,具備螯合銅的能力,產生谷胱甘肽、抗壞血酸、酚類、類黃酮、生育酚和類胡蘿卜素等抗氧化劑,阻止線粒體釋放細胞色素C氧化酶,保護植物免受ROS的影響,維持細胞氧化還原的狀態[52],減輕CHD發展。研究發現,三七提取物三七總皂苷(Panax notoginseng saponins, PNS)具有抑制血小板聚集的功能,其機制為PNS抑制NF-κB信號通路并抑制促炎因子的表達[53]。體內銅濃度過高時,可通過產生ROS和激活NF-κB通路導致炎癥反應;KOJOK等[54]發現血小板中的NF-κB具有非基因組誘導血小板活性,導致血小板聚集,血栓增多;故PNS可通過干預銅死亡引起的血小板NF-κB 信號通路降低促炎因子的表達,維持血管和血細胞的促生存狀態,減少AS血栓形成。
5.2 通心脈
CHD臨床上最常見的病理產物是冠狀動脈血管脂質沉積,當體內血脂過高形成AS后,冠狀動脈內血流量減少,管腔狹窄,可加重CHD。黃酮類化合物具有降脂作用,其主要從黃芩、葛根、銀杏葉等中草藥中提取[55]。黃酮類化合物可通過降低低密度脂蛋白上的銅結合位點,來阻止其氧化低密度脂蛋白,且其B環上的兩個相鄰羥基(鄰苯二酚)具有優越的抗氧化作用[56]。當體內銅離子濃度降低時,可將apoB中的特定氨基酸殘基(即apoB-100上的含組氨酸位點)結合,引發低密度脂蛋白分子核心中不飽和脂肪酰基鏈的氧化,產生丙二醛(malondialdehyde,MDA)等醛氧化物[57]。當氧化修飾后的低密度脂蛋白過量時,其攜帶的膽固醇便積存在動脈壁上,日久易引起動脈硬化。當膽固醇水平降低時,血脂隨之降低,冠脈管腔增大,血流相對增加,從而緩解CHD發展。MAJEWSKI等[58]學者通過對雄性Wistar大鼠長期補充銅及白藜蘆醇(resveratrol,RSA)發現,當大鼠體內銅濃度上升時,攝入RSA可減少血管收縮。RSA是從虎杖、葡萄等植物中分離提取出來的一種抗氧化劑,能抗組織纖維化,從而抑制和減輕CHD的發生與發展[59]。徐磊[60]通過網絡藥理學發現,RSA可以調節包括FDX1在內的15個銅死亡靶點,通過mRNA降低FDX1(銅死亡上游調節因子)表達,阻止銅死亡的發生,從而延緩CHD進程。
6 結論與展望
心主血脈功能失常本質是心之氣血陰陽失調從而致瘀血等實邪痹阻心脈,故治療可從血、脈兩方面入手,致力恢復心主血脈功能。結合目前已有的CHD防治基礎,銅死亡逐漸成為一種新興的治療方式,可通過分子伴侶、離子載體等方式抑制CHD發生發展。中醫治療具有簡、效、便、廉等特點,結合現代臨床藥理研究,中藥提取物可通過抑制血小板活化、降低血小板黏附能力、去除血管壁脂質沉積、擴張冠狀動脈兩方面干預銅死亡。目前,國內關于銅死亡研究處于發展階段,數據尚不充分。通過對近幾年國內外報道的具有調控銅死亡的中醫藥及其藥理作用進行觀察,發現仍存在一些問題:(1)目前中藥多為有效成分提取物,單味藥、復方、中藥制劑相關研究較少;(2)現銅死亡主要途徑和氧化應激相關,是否還存在其他途徑經銅導致細胞死亡有待進一步考證;(3)研究發現,中藥可干預疾病中的銅死亡機制,鮮有中藥直接干預銅死亡模型研究,而中藥干預銅死亡是否為疾病治療的中心環節還有待進一步研究;(4)目前機制研究主要停留在表層,導致中醫藥干預的靶點不夠明確,盡管已知銅死亡與某些關鍵蛋白及代謝途徑存在關聯,然而這些通路在中醫藥干預下的具體變化以及相互作用關系仍需進一步深入闡明;(5)關于中醫藥如何調節銅離子代謝以及相關酶活性的研究尚顯不足,目前并不清楚中醫藥是通過直接影響銅離子的攝取與排出,還是通過調節參與銅死亡的酶來發揮其作用。
在今后研究中,可以從基因、腸道菌群等方面探討銅死亡機制,進行進一步驗證,以期闡明中醫藥干預銅死亡的有效藥物、成分、作用靶點及相關信號通路。此外,銅死亡參與眾多疾病的病理生理過程,而臨床未見相關靶向藥物,提示銅死亡作為臨床新藥包括中藥研發的新思路前景廣闊,可為疾病防治提供新方法和新依據。
參考文獻
[1] TSAO C W, ADAY A W, ALMARZOOQ Z I, et al. Heart disease and stroke statistics-2022 update: A report from the American heart association[J]. Circulation, 2022, 145(8): e153-e639.
[2] KAHLSON M A, DIXON S J. Copper-induced cell death[J]. Science, 2022, 375(6586): 1231-1232.
[3] CHEN L Y, MIN J X, WANG F D. Copper homeostasis and cuproptosis in health and disease[J]. Signal Transduction and Targeted Therapy, 2022, 7: 378.
[4] WANG X X, WU L H, JI H C, et al. A novel cuproptosis-related prognostic signature and potential value in HCC immunotherapy[J]. Frontiers in Molecular Biosciences, 2022, 9: 1001788.
[5] ZHAO J N, GUO S C, SCHRODI S J, et al. Cuproptosis and cuproptosis-related genes in rheumatoid arthritis: Implication, prospects, and perspectives[J]. Frontiers in Immunology, 2022, 13: 930278.
[6] LI D L, GAO Z H, LI Q, et al. Cuproptosis-a potential target for the treatment of osteoporosis[J]. Frontiers in Endocrinology, 2023, 14: 1135181.
[7] WANG D, TIAN Z Y, ZHANG P, et al. The molecular mechanisms of cuproptosis and its relevance to cardiovascular disease[J]. Biomedecine & Pharmacotherapie, 2023, 163: 114830.
[8] CHEN X Y, CAI Q, LIANG R K, et al. Copper homeostasis and copper-induced cell death in the pathogenesis of cardiovascular disease and therapeutic strategies[J]. Cell Death & Disease, 2023, 14(2): 105.
[9] 畢偉博, 姜 旻. 論陰陽藏象學說的基本思想方法[J]. 中華中醫藥雜志, 2021, 36(10): 5777-5781.
[10] 王麗丹, 李文杰. 心主血脈理論考析[J]. 遼寧中醫雜志, 2018, 45(6): 1173-1176.
[11] 陳巖巖. 從“心主血脈”思想探討益氣通陽逐瘀生新法組方促心肌缺血再灌注大鼠血管新生機理[D]. 長沙: 湖南中醫藥大學, 2021.
[12] TSVETKOV P, COY S, PETROVA B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins[J]. Science, 2022, 375(6586): 1254-1261.
[13] ZHAO G, SUN H J, ZHANG T, et al. Copper induce zebrafish retinal developmental defects via triggering stresses and apoptosis[J]. Cell Communication and Signaling, 2020, 18(1): 45.
[14] LIAO J Z, YANG F, TANG Z X, et al. Inhibition of Caspase-1-dependent pyroptosis attenuates copper-induced apoptosis in chicken hepatocytes[J]. Ecotoxicology and Environmental Safety, 2019, 174: 110-119.
[15] TAO X Q, WAN X L, WU D, et al. A tandem activation of NLRP3 inflammasome induced by copper oxide nanoparticles and dissolved copper ion in J774A.1 macrophage[J]. Journal of Hazardous Materials, 2021, 411: 125134.
[16] 張雅瀏, 敖經盛, 張曉東. 銅死亡機制及其在動脈硬化中的研究進展[J/OL]. 中國動脈硬化雜志, 1-14[2024-09-30]. http://kns.cnki.net/kcms/detail/43.1262.R.20240902.1606.002.html.
[17] BOICVIJAN B, KORAJAIJ, BAJETIM. The impact of copper ions on the activity of antibiotic drugs[J]. Molecules, 2023, 28(13): 5133.
[18] JOMOVA K, MAKOVA M, ALOMAR S Y, et al. Essential metals in health and disease[J]. Chemico-Biological Interactions, 2022, 367: 110173.
[19] SRINIVAS U S, TAN B W Q, VELLAYAPPAN B A, et al. ROS and the DNA damage response in cancer[J]. Redox Biology, 2019, 25: 101084.
[20] ZOROV D B, JUHASZOVA M, SOLLOTT S J. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release[J]. Physiological Reviews, 2014, 94(3): 909-950.
[21] SU L J, ZHANG J H, GOMEZ H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 5080843.
[22] KONARIKOVA K, FRIVALDSKA J, GBELCOVA H, et al. Schiff base Cu(II) complexes as inhibitors of proteasome in human cancer cells[J]. Bratislavske Lekarske Listy, 2019, 120(9): 646-649.
[23] SHEN J L, WANG L H, BI J B. Bioinformatics analysis and experimental validation of cuproptosis-related lncRNA LINC02154 in clear cell renal cell carcinoma[J]. BMC Cancer, 2023, 23(1): 160.
[24] DREISHPOON M B, BICK N R, PETROVA B, et al. FDX1 regulates cellular protein lipoylation through direct binding to LIAS[J]. BioRxiv, 2023: 2023.02.03.526472.
[25] CHEN X, DOU Q P, LIU J B, et al. Targeting ubiquitin-proteasome system with copper complexes for cancer therapy[J]. Frontiers in Molecular Biosciences, 2021, 8: 649151.
[26] FORD E S. Serum copper concentration and coronary heart disease among US adults[J]. American Journal of Epidemiology, 2000, 151(12): 1182-1188.
[27] KOK F J, VAN DUIJN C M, HOFMAN A, et al. Serum copper and zinc and the risk of death from cancer and cardiovascular disease[J]. American Journal of Epidemiology, 1988, 128(2): 352-359.
[28] KOKSAL C, ERCAN M, BOZKURT A K, et al. Abdominal aortic aneurysm or aortic occlusive disease: Role of trace element imbalance[J]. Angiology, 2007, 58(2): 191-195.
[29] ESCOBAR-DIAZ M C, P?魪REZ-CRUZ M, ARRáEZ M, et al. Brain oxygen perfusion and oxidative stress biomarkers in fetuses with congenital heart disease-a retrospective, case-control pilot study[J]. Antioxidants, 2022, 11(2): 299.
[30] B?譈GEL S, HARPER A, ROCK E, et al. Effect of copper supplementation on indices of copper status and certain CVD risk markers in young healthy women[J]. The British Journal of Nutrition, 2005, 94(2): 231-236.
[31] LAMB D J, AVADES T Y, FERNS G A. Biphasic modulation of atherosclerosis induced by graded dietary copper supplementation in the cholesterol-fed rabbit[J]. International Journal of Experimental Pathology, 2001, 82(5): 287-294.
[32] WANG N, XU X W, LI H L, et al. Atherosclerotic lesion-specific copper delivery suppresses atherosclerosis in high-cholesterol-fed rabbits[J]. Experimental Biology and Medicine, 2021, 246(24): 2671-2678.
[33] DIAF M, KHALED M B. Associations between dietary antioxidant intake and markers of atherosclerosis in middle-aged women from north-western Algeria[J]. Frontiers in Nutrition, 2018, 5: 29.
[34] LIU H, GUO H R, JIAN Z J, et al. Copper induces oxidative stress and apoptosis in the mouse liver[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 1359164.
[35] BATTY M, BENNETT M R, YU E. The role of oxidative stress in atherosclerosis[J]. Cells, 2022, 11(23): 3843.
[36] SCHUSCHKE D A, SAARI J T, MILLER F N. Leukocyte-endothelial adhesion is impaired in the cremaster muscle microcirculation of the copper-deficient rat[J]. Immunology Letters, 2001, 76(2): 139-144.
[37] WEI H, ZHANG W J, MCMILLEN T S, et al. Copper chelation by tetrathiomolybdate inhibits vascular inflammation and atherosclerotic lesion development in apolipoprotein E-deficient mice[J]. Atherosclerosis, 2012, 223(2): 306-313.
[38] GUPTA G, CAPPELLINI F, FARCAL L, et al. Copper oxide nanoparticles trigger macrophage cell death with misfolding of Cu/Zn superoxide dismutase 1 (SOD1)[J]. Particle and Fibre Toxicology, 2022, 19(1): 33.
[39] LIAO J Z, HU Z Y, LI Q W, et al. Endoplasmic reticulum stress contributes to copper-induced pyroptosis via regulating the IRE1α-XBP1 pathway in pig jejunal epithelial cells[J]. Journal of Agricultural and Food Chemistry, 2022, 70(4): 1293-1303.
[40] XU Y J, ZHENG L, HU Y W, et al. Pyroptosis and its relationship to atherosclerosis[J]. Clinica Chimica Acta, 2018, 476: 28-37.
[41] XU X D, CHEN J X, ZHU L, et al. The emerging role of pyroptosis-related inflammasome pathway in atherosclerosis[J]. Molecular Medicine, 2022, 28(1): 160.
[42] WANG W C, LU Z C, WANG M Y, et al. The cuproptosis-related signature associated with the tumor environment and prognosis of patients with glioma[J]. Frontiers in Immunology, 2022, 13: 998236.
[43] 高 雅, 安 宏, 徐世杰. “君主之官”與“中正之官”新解[J]. 中國醫藥導報, 2018, 15(36): 129-131, 143.
[44] 周曼麗, 周霞輝, 張宜帆, 等. 基于“心主血脈”理論探討冠心病血瘀證形成機制[J]. 實用心腦肺血管病雜志, 2023, 31(2): 105-107.
[45] 王 臻.益氣活血法改善心源性營養不良大鼠心肌能量代謝及中醫證候研究[D]. 北京: 北京中醫藥大學, 2019.
[46] LOMINADZE D G, SAARI J T, MILLER F N, et al. Platelet aggregation and adhesion during dietary copper deficiency in rats[J]. Thrombosis and Haemostasis, 1996, 75(4): 630-634.
[47] XIAO Y, SONG X, WANG T, et al. Copper preserves vasculature structure and function by protecting endothelial cells from apoptosis in ischemic myocardium[J]. Journal of Cardiovascular Translational Research, 2021, 14(6): 1146-1155.
[48] RAMOS D, MAR D, ISHIDA M, et al. Mechanism of copper uptake from blood plasma ceruloplasmin by mammalian cells[J]. PLoS One, 2016, 11(3): e0149516.
[49] CHEN X Y, CAI Q, LIANG R K, et al. Copper homeostasis and copper-induced cell death in the pathogenesis of cardiovascular disease and therapeutic strategies[J]. Cell Death & Disease, 2023, 14(2): 105.
[50] FUKAI T, USHIO-FUKAI M. Superoxide dismutases: Role in redox signaling, vascular function, and diseases[J]. Antioxidants & Redox Signaling, 2011, 15(6): 1583-1606.
[51] 胡蕊蕊, 付 慧, 韓曉燕, 等. 丹參“藥對”及制劑對心血管保護的藥理作用與臨床研究進展[J]. 中醫藥學報, 2023, 51(5): 106-110.
[52] STREJCKOVA A, DVORAK M, KLEJDUS B, et al. The strong reaction of simple phenolic acids during oxidative stress caused by nickel, cadmium and copper in the microalga Scenedesmus quadricauda[J]. New Biotechnology, 2019, 48: 66-75.
[53] ZHAO Y, ZHENG J L, YU Y M, et al. Panax notoginseng saponins regulate macrophage polarization under hyperglycemic condition via NF- κ B signaling pathway[J]. BioMed Research International, 2018, 2018: 9239354.
[54] KOJOK K, EL-KADIRY A E H, MERHI Y. Role of NF-κB in platelet function[J]. International Journal of Molecular Sciences, 2019, 20(17): 4185.
[55] 陳少影, 李晶晶, 蘭 衛. 常用中藥有效成分降脂作用研究進展[J]. 中國實驗方劑學雜志, 2023, 29(13): 241-253.
[56] WANG W, ZHANG X L, LIU Q L, et al. Study on extraction and antioxidant activity of flavonoids from Hemerocallis fulva (daylily) leaves[J]. Molecules, 2022, 27(9): 2916.
[57] DIANITA R, JANTAN I. Inhibition of human platelet aggregation and low-density lipoprotein oxidation by Premna foetida extract and its major compounds[J]. Molecules, 2019, 24(8): 1469.
[58] MAJEWSKI M, OGNIK K, JU?KIEWICZ J. The interaction between resveratrol and two forms of copper as carbonate and nanoparticles on antioxidant mechanisms and vascular function in Wistar rats[J]. Pharmacological Reports, 2019, 71(5): 862-869.
[59] YANG H, LIU Z D, HU X K, et al. Protective effect of Panax notoginseng saponins on apolipoprotein-E-deficient atherosclerosis-prone mice[J]. Current Pharmaceutical Design, 2022, 28(8): 671-677.
[60] 徐 磊. 白藜蘆醇抗動脈粥樣硬化機制研究[J]. 中風與神經疾病雜志, 2018, 35(6): 566-568.

