基于防御酶與代謝組學分析貝萊斯芽孢桿菌JTB8-2誘導番茄拮抗瓜列當機制
摘 要:【目的】瓜列當是全寄生惡性雜草,貝萊斯芽孢桿菌JTB8-2能夠有效防除瓜列當,探明其作用機制可以為該菌株的田間應用提供理論依據。【方法】采用盆栽、酶活測定及超高效液相色譜-質譜聯合(UHPLC-MRM-MS/MS)技術,分析貝萊斯芽孢桿菌JTB8-2誘導番茄抗瓜列當機制。【結果】貝萊斯芽孢桿菌JTB8-2發酵液處理在番茄移栽后20、30和40 d時,寄生的瓜列當結節數量分別為0.33、0.17和0.33個/株,較NB培養基處理分別減少了50.75%、79.52%和50.75%,較清水對照分別減少了81.67%、96.96%和95.54%。菌株發酵液澆灌番茄植株3、20和30 d后,番茄根部過氧化氫酶(CAT)活性均高于NB培養基處理和清水對照;番茄根系中28種植物激素類代謝物中 11種代謝物含量具有差異,菌株JTB8-2處理的番茄根系中細胞分裂素類與生長素類化合物含量高于清水對照。【結論】菌株JTB8-2處理的番茄根系中過氧化氫酶活性、細胞分裂素與生長素相關激素的增加誘導了番茄系統抗性,減少了瓜列當寄生量。
關鍵詞:瓜列當;貝萊斯芽孢桿菌;防御酶;代謝組學;誘導抗性
中圖分類號:S641.2;S188 文獻標志碼:A 文章編號:1001-4330(2024)10-2396-12
收稿日期(Received):2024-04-10
基金項目:新疆維吾爾自治區自然科學基金項目(2022D01A91);農業科技創新穩定支持項目(xjnkywdzc-2022004);新疆現代農業產業技術體系(XJARS-07)
作者簡介:朱夏芬(1999-),女,山西晉城人,碩士研究生,研究方向為列當生物防治,(E-mail)1845724579@qq.com
通訊作者:李克梅(1972-),女,江蘇如皋人,教授,博士,碩士生導師,研究方向為蔬菜病害及防治,(E-mail)likemei@xjau.edu.cn
許建軍(1972-),男,河南孟津人,研究員,研究方向為蔬菜病蟲害防治,(E-mail)xjj72@163.com
0 引 言
【研究意義】列當是列當科(Orobanchaceae)列當屬(Orobanche L.)的全寄生植物,其寄主范圍廣泛,可為害茄科(Solanaceae)、葫蘆科(Cucurbitaceae)、豆科(Leguminosae)、傘形科(Umbelliferae)和菊科(Compositae)等作物。列當靠吸收寄主植物養分、生長激素和水分維持自身生長[1,2],造成寄主作物產量和品質下降。近年來,瓜列當已經成為嚴重影響新疆加工番茄產業健康發展的惡性雜草[3]。探明貝萊斯芽孢桿菌JTB8-2作用機制,對田間防除瓜列當有實際意義。【前人研究進展】目前列當防治措施主要包括化學除草劑防治、培育抗性品種、種植誘捕作物、人工拔除等,這些方法均防治效果不佳,費工費時等問題。近年來利用微生物防治列當的研究日益增多,何偉等[4, 5]報道貝萊斯芽孢桿菌(B. velezensis)JTB8-2發酵液可有效抑制瓜列當種子萌發;Iasur等[6, 7]發現銅綠假單胞菌(Pseudomonas aeruginosa)PhelS10在植物組織的間隙中形成生物膜,降低列當的寄生效應;王亞嬌等[8, 9]報道尖孢鐮刀菌(Fusarium oxysporum)Br-2可顯著降低分支列當寄生率和寄生數量;陳杰等[10]報道灰黃青霉(Penicillium griseofulvum)CF3發酵液能有效抑制瓜列當種子萌發與芽管伸長。研究者通過開展室內和田間試驗,探明了部分生防菌對列當防治效果,然而對其作用機制鮮有報道。貝萊斯芽孢桿菌廣泛應用于植物病害防治,申云鑫等[11]發現貝萊斯芽孢桿菌SH-1471具有srfA、fenB、ituA、ituD、bymA等抗生素合成基因,能夠有效降低番茄枯萎病的發病率;馬爽[12]研究表明,貝萊斯芽孢桿菌K-9增加了馬鈴薯根的保護酶活性,誘導了植株對瘡痂病的抗性,減少馬鈴薯瘡痂病發生;蘭成忠[13]報道菌株FJ17-4通過增加根際土壤有益微生物種類、誘導植株抗性對黃瓜枯萎病菌起到防治作用。【本研究切入點】利用貝萊斯芽孢桿菌對植物病害進行防治已取得較好應用效果,但在防治瓜列當方面研究較少。貝萊斯芽孢桿菌JTB8-2在盆栽和田間試驗中能夠減少瓜列當寄生量,但是其作用機制尚不明確。需探明其作用機制可以為該菌株的田間應用提供理論依據。【擬解決的關鍵問題】采用盆栽、酶活測定及超高效液相色譜-質譜聯合(UHPLC-MRM-MS/MS)技術,分析貝萊斯芽孢桿菌JTB8-2誘導番茄抗瓜列當機制,在前期研究基礎上探明貝萊斯芽孢桿菌JTB8-2誘導番茄對瓜列當抗性機制,為貝萊斯芽孢桿菌JTB8-2的開發應用提供科學依據。
新疆農業科學第61卷 第10期朱夏芬等:基于防御酶與代謝組學分析貝萊斯芽孢桿菌JTB8-2誘導番茄拮抗瓜列當機制
1 材料與方法
1.1 材 料
貝萊斯芽孢桿菌(B. velezensis)JTB8-2分離自新疆吉木薩爾縣工業番茄田瓜列當根際土壤;供試番茄品種為屯河1902;瓜列當種子采集自新疆昌吉州吉木薩爾縣加工番茄田;GR24(北京酷來搏科有限公司);酶活試劑盒(蘇州格銳思生物科技有限公司)。
1.2 方 法
1.2.1 盆栽試驗
將保存的菌株轉接于 NA(牛肉膏3 g,蛋白胨7 g,NaCl 5 g,瓊脂粉18 g,蒸餾水1 000 mL)平板中,28℃培養 48 h,使用滅菌槍頭將單菌落轉接于100 mL NB(牛肉膏 3 g,蛋白胨 7 g,NaCl 5 g,蒸餾水 1 000 mL)培養基中,28℃,180 r/min振蕩培養 48 h 后即為種子發酵液。將種子發酵液轉接于裝有 3 L NB 培養基中,28 °C、180 r/min 振蕩培養72 h,稀釋濃度至 108 CFU/mL。
番茄采用穴盤基質育苗,番茄苗4~6片真葉時移至直徑為12 cm的塑料盆。盆栽試驗設3個處理,分別是菌株JTB8-2處理、NB培養基處理和清水對照組,每處理24次重復。分別在番茄苗移栽0、7和14 d時澆灌菌液、NB液體培養基和清水。菌株JTB8-2和NB培養基處理每盆分別澆灌100 mL菌液(濃度為1×108CFU/mL)和NB液體培養基,對照組加入等量清水。分別在澆灌菌液處理后3、20、30和40 d 時每處理拔出6株番茄植株,沖洗根部,調查瓜列當寄生數量,同時收集番茄根系,沖洗干凈后75%酒精消毒30s,液氮冷凍后保存至-80℃,備用。
1.2.2 番茄根系酶活性
將收集保存的番茄根系,按照蘇州格銳思生物科技有限公司試劑盒說明,測量番茄根部的苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,PAL)、過氧化物酶(Peroxidase, POD)、超氧化物歧化酶(Superoxide Dismutase,SOD)、多酚氧化酶(polyphenol oxidase,PPO)和過氧化氫酶(Catalase,CAT)酶活。
1.2.3 代謝組學
采用超高效液相色譜-質譜聯合分析(UHPLC-MRM-MS/MS)方法,測定收集保存的番茄根系中的28種植物激素類目標代謝物含量,樣品由北京百邁客生物科技有限公司檢測。
1.3 數據處理
試驗數據采用Excel 2010統計整理數據和圖表制作,采用SPSS 23.0進行差異顯著性分析。
2 結果與分析
2.1 不同處理下番茄鮮重、株高和瓜列當寄生量的變化
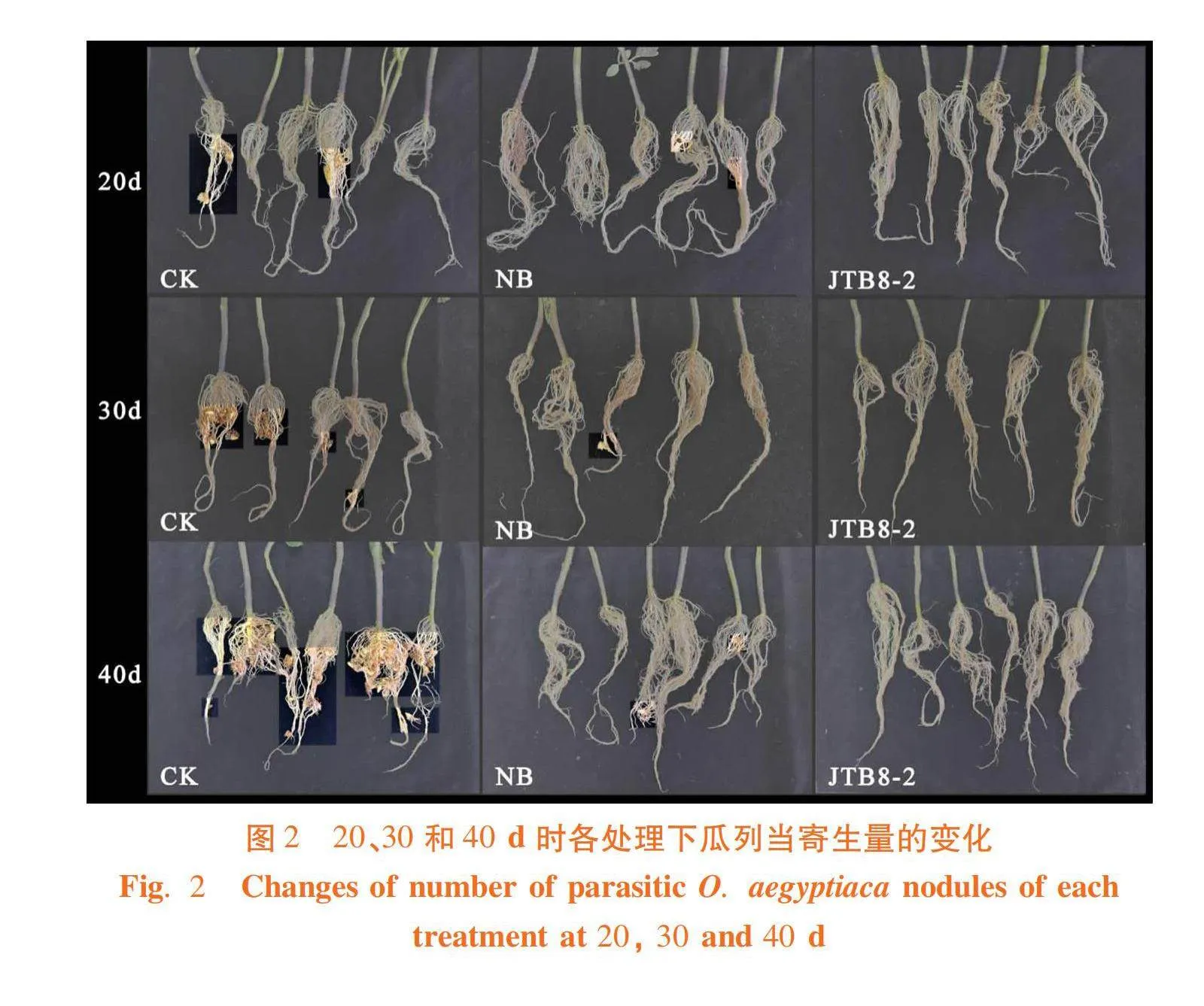
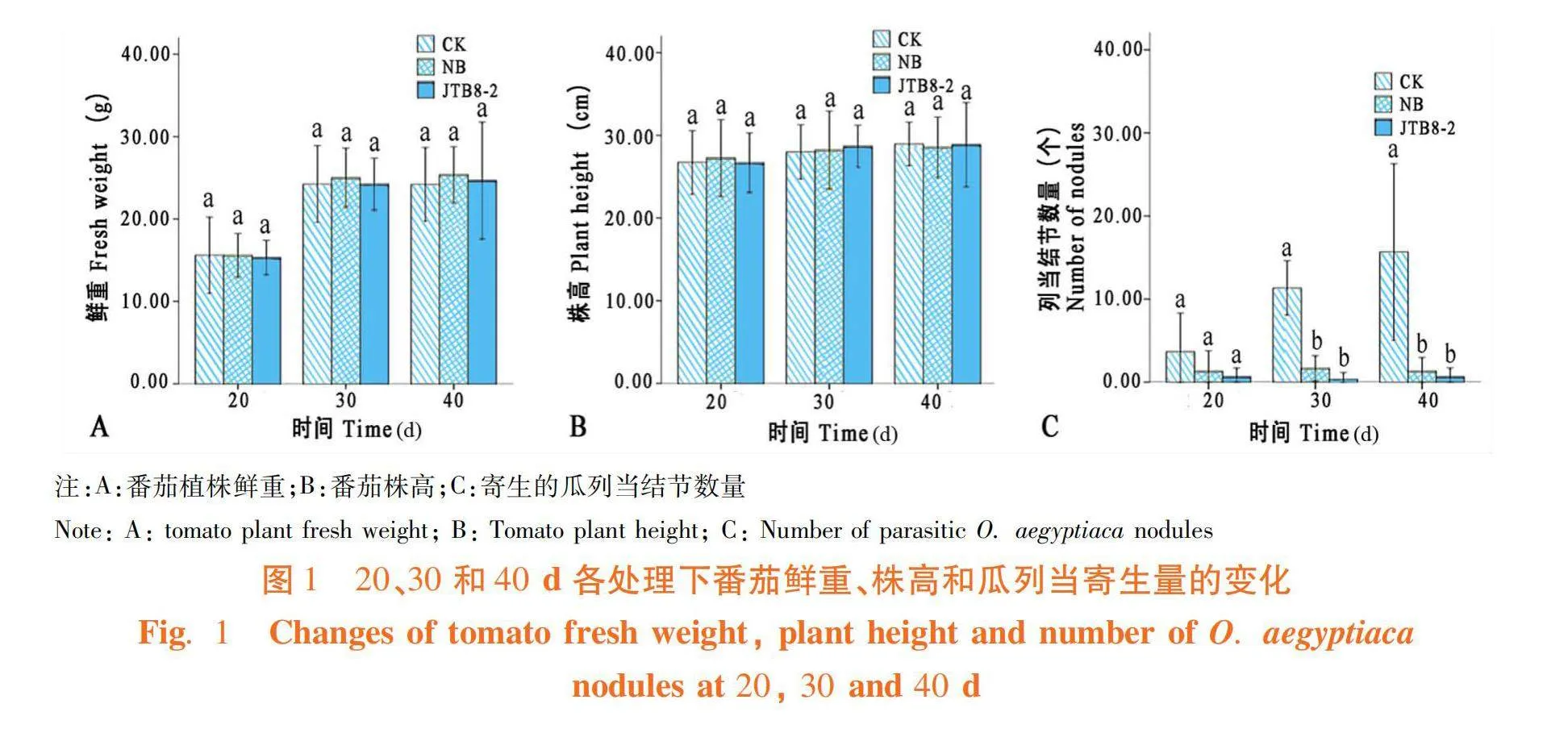
研究表明,在番茄苗移栽20、30和40 d時,菌株JTB8-2處理、NB處理和清水對照的番茄株高和鮮重均無顯著差異,但菌株JTB8-2處理的番茄植株瓜列當結節數量最少。番茄苗移栽20 d時,清水對照番茄植株寄生的瓜列當結節數量為1.8個/株,NB處理為0.67個/株,菌株JTB8-2處理為0.33個/株,菌株JTB8-2處理番茄植株瓜列當寄生結節數量較NB處理減少了50.75%,較清水對照減少了81.67%;30d時清水對照處理寄生的瓜列當結節數量為5.6個/株,NB處理為0.83個/株,菌株JTB8-2處理為0.17個/株,菌株JTB8-2處理番茄植株瓜列當寄生結節數量較NB處理減少了79.52%,相比清水對照降低了96.96%;40 d時清水對照處理寄生的瓜列當結節數量為7.4個/株,NB處理為0.67個/株,菌株JTB8-2處理為0.33個/株,菌株JTB8-2處理番茄植株瓜列當寄生結節數量較NB處理減少了50.75%,較清水對照降低了95.54%。圖1,圖2
2.2 番茄植株不同時期防御酶活性變化
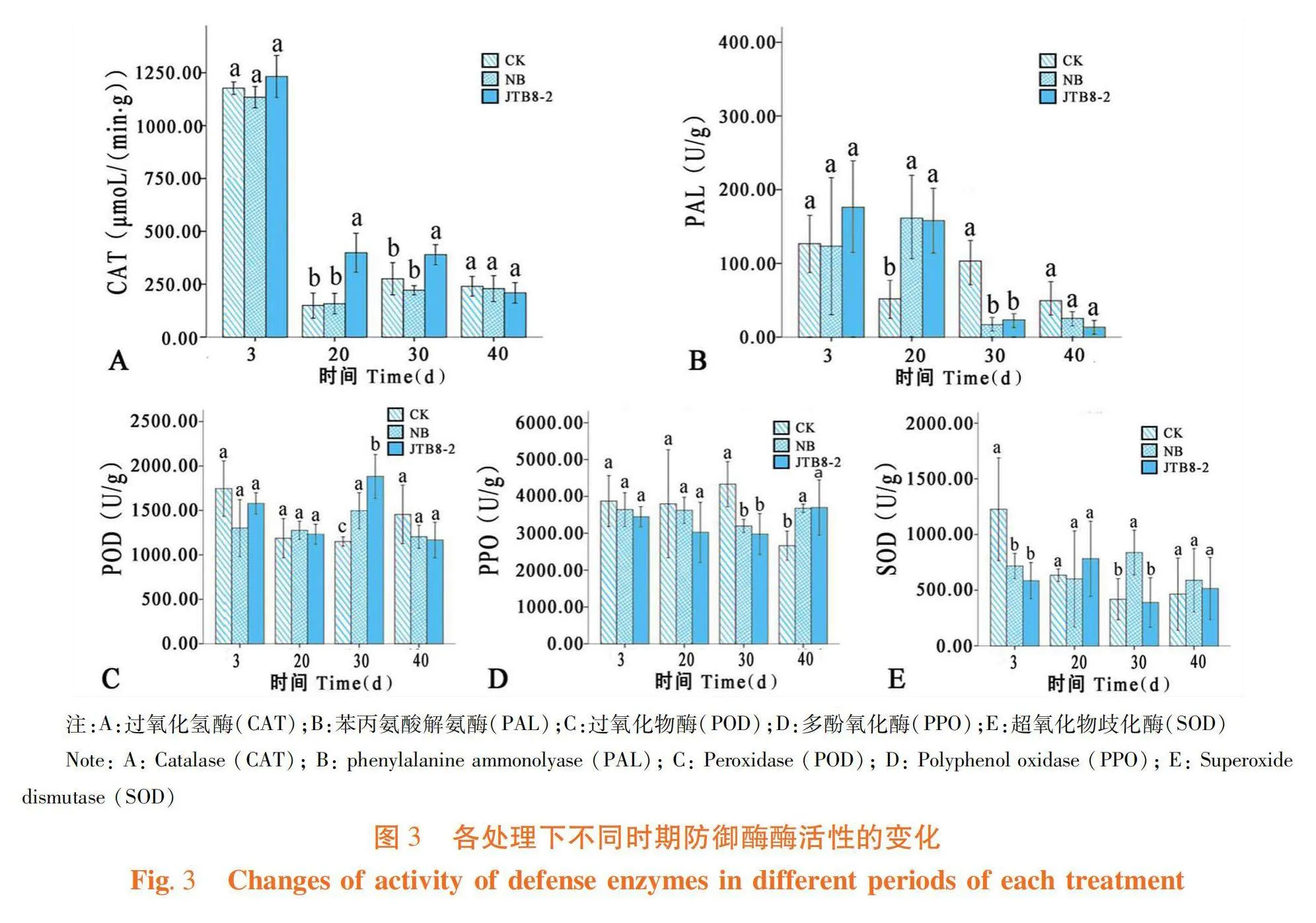
研究表明,在第3、20和30 d時菌株JTB8-2處理的番茄根系內過氧化氫酶(CAT)活性高于NB培養基處理和清水對照,在 40 d時低于其他兩個處理(圖3A);菌株JTB8-2處理的番茄根系內苯丙氨酸解氨酶(PAL)在第3和20 d時,活性高于清水對照,但在30 d時較清水對照降低了77.42%,40 d時較清水對照降低了72.98%(圖3B);菌株JTB8-2處理的過氧化物酶(POD)活性在3和40 d時低于對照處理,在20和30 d時高于對照處理(圖3C);菌株JTB8-2處理的番茄根系內多酚氧化酶(PPO)活性在3、20和30 d時均低于NB培養基與清水對照處理,在40 d時顯著高于清水對照,與NB培養基處理無顯著差異(圖3D);菌株JTB8-2處理的超氧化物歧化酶(SOD)活性在3 d時顯著低于清水對照,在20 d時活性高于清水對照,30和40 d時與對照差異不顯著,但顯著低于NB培養基處理(圖3E)。圖3
2.3 番茄根系代謝組學
2.3.1 儀器穩定性
研究表明,所有目標化合物均呈對稱色譜峰,各個目標化合物的色譜分離,目標化合物在生物樣品與標準品溶液中的保留時間及色譜峰形均無明顯差異。質譜對同一樣品不同時間檢測時,信號穩定性較好,獲得的數據可靠。試驗基于UHPLC-MRM-MS/MS檢測的代謝組學方法具有良好的重現性。圖4,圖5
2.3.2 番茄根部植物激素類代謝差異物
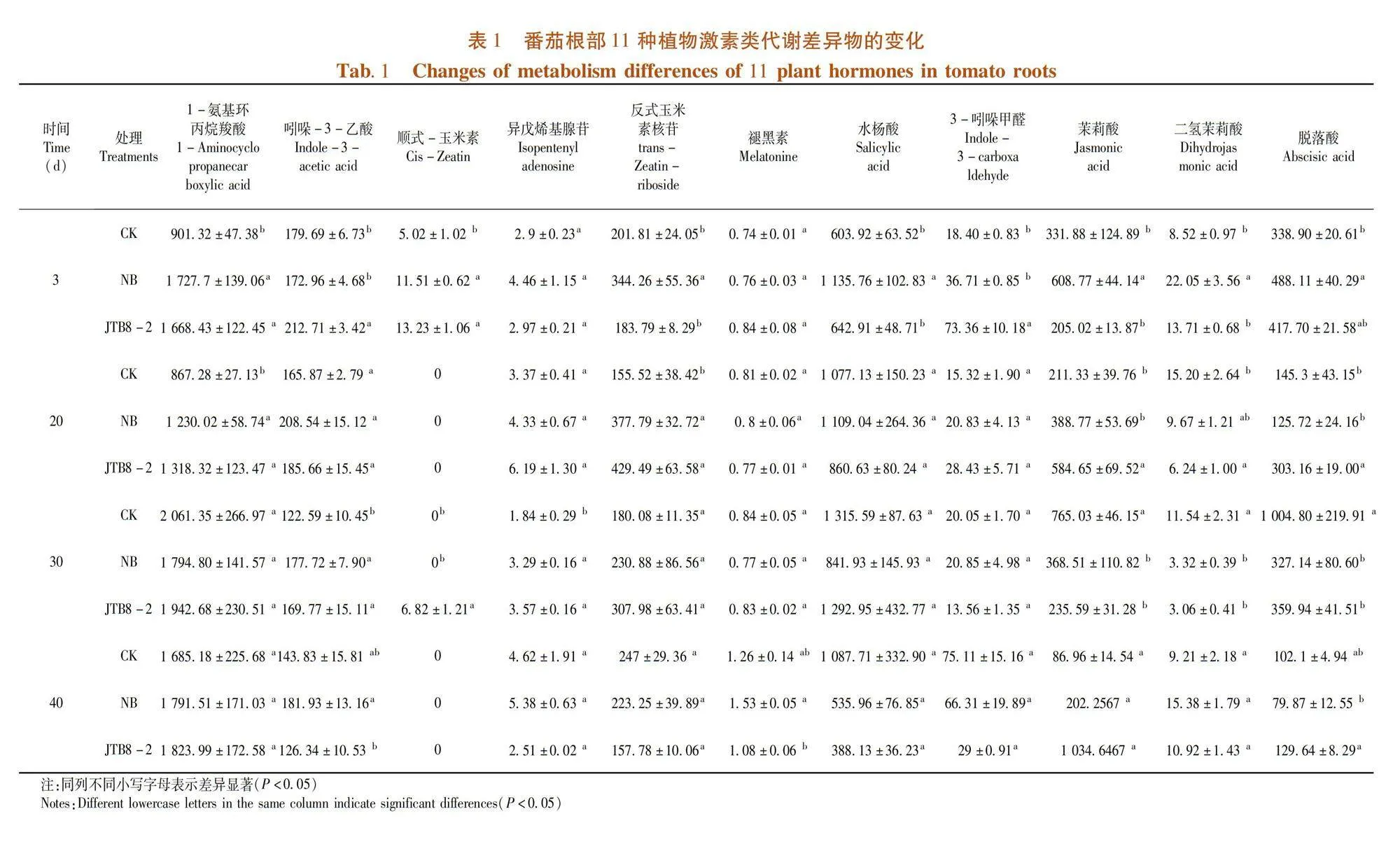
研究表明,從不同時期各處理的番茄根系中共檢測到1-氨基環丙烷羧酸、吲哚-3-乙酸、順式-玉米素、異戊烯基腺苷、反式玉米素核苷、褪黑素、水楊酸、3-吲哚甲醛、茉莉酸、二氫茉莉酸和脫落酸等11種植物激素類目標代謝物,其中細胞分裂素類化合物有3種,生長素類化合物有2種,茉莉酸類化合物有2種,其他植物激素有4種。表1
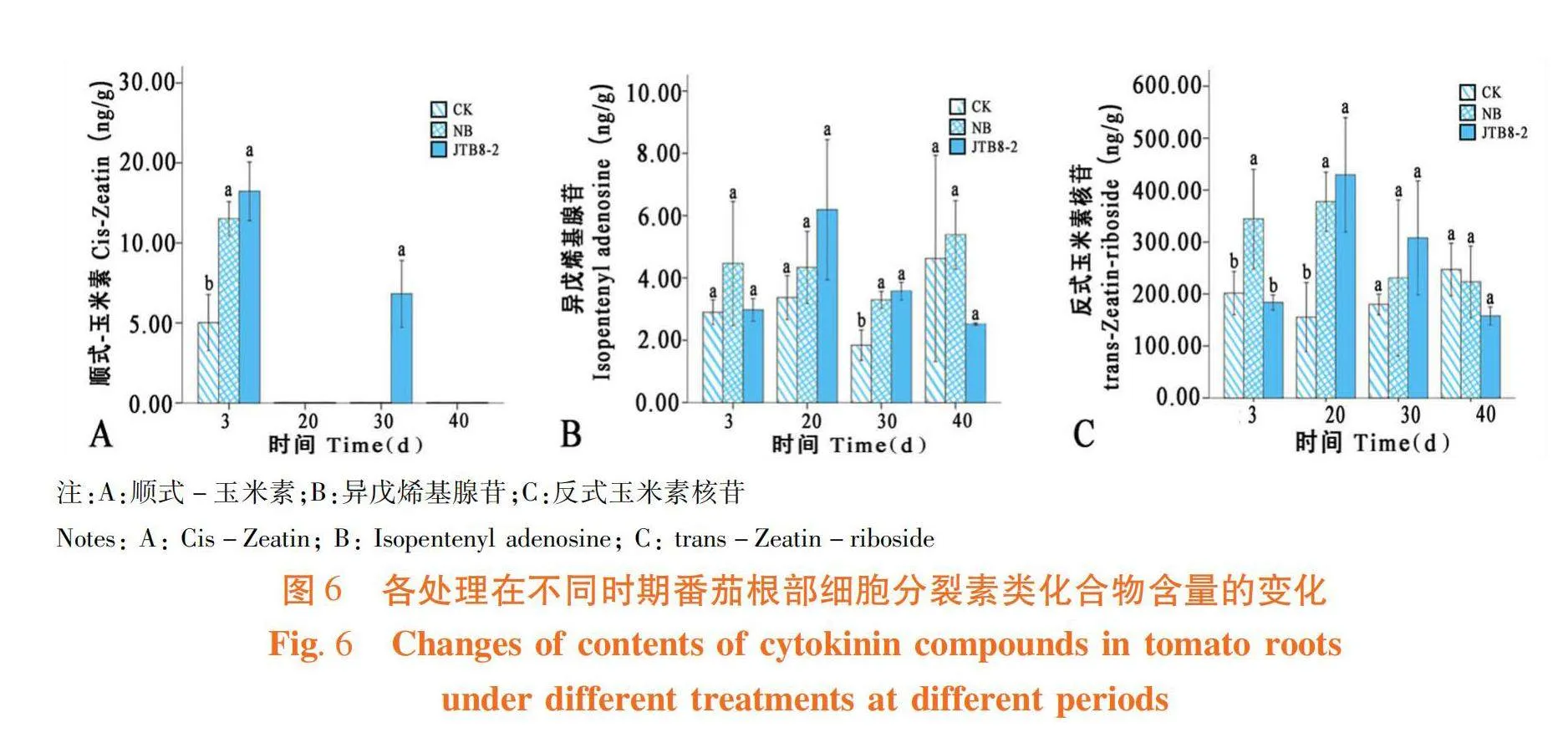
菌株JTB8-2處理的番茄根系在第3 d順式-玉米素(Cis-Zeatin)含量顯著高于清水對照,是清水對照的2.64倍,第30 d在培養基和清水處理的番茄根系中均未檢測到順式-玉米素,僅在菌株處理的番茄根部檢測到,20和40 d時3種處理根部全部未檢測到該物質(圖6A);菌株JTB8-2處理的番茄根系中異戊烯基腺苷(Isopentenyl adenosine)含量在3、20和30 d時均高于清水對照,分別為清水對照的1.02、1.84和1.94倍,在40 d時菌株處理的番茄根系中異戊烯基腺苷含量低于培養基處理和清水對照處理(圖6B);菌株JTB8-2處理的番茄根系中反式玉米素核苷(trans-Zeatin-riboside)含量在20、30 d時分別為清水對照的2.76和1.71倍,3和40 d時低于清水對照但差異不顯著(圖6C)。菌株JTB8-2處理后番茄根部中3種細胞分裂素類化合物含量在20和30 d時均高于清水對照和NB培養基處理。圖6
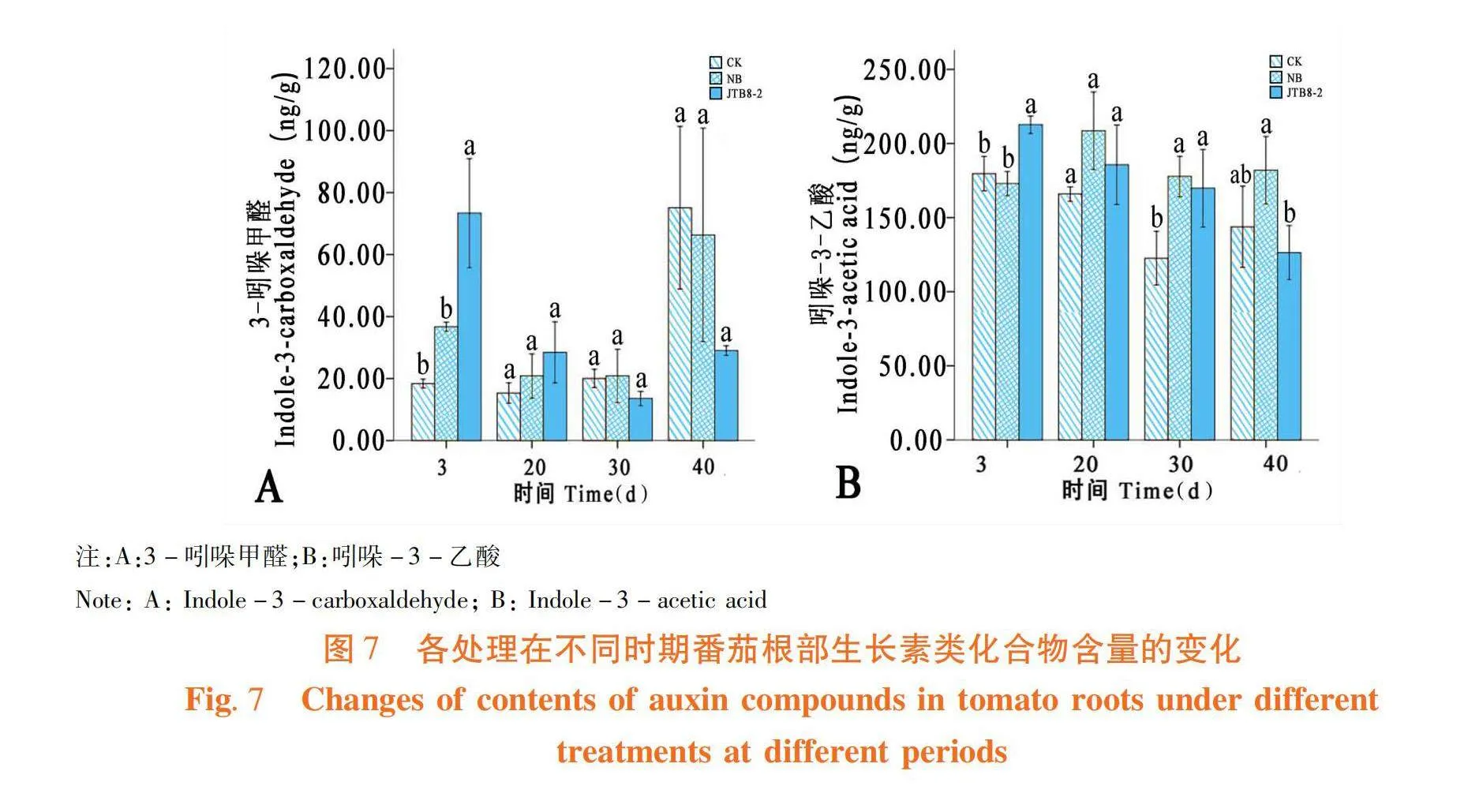
菌株JTB8-2處理的番茄根部中3-吲哚甲醛(Indole-3-carboxaldehyde)含量在3和20 d時分別為73.36和28.43 ng/g,高于清水對照和NB培養基處理,30和40 d時低于清水對照和NB培養基處理(圖7A);菌株處理的番茄根部中吲哚-3-乙酸(Indole-3-acetic acid)含量在3、20和30 d時高于清水對照處理,40 d時該物質含量低于清水對照與NB培養基處理(圖7B)。圖7
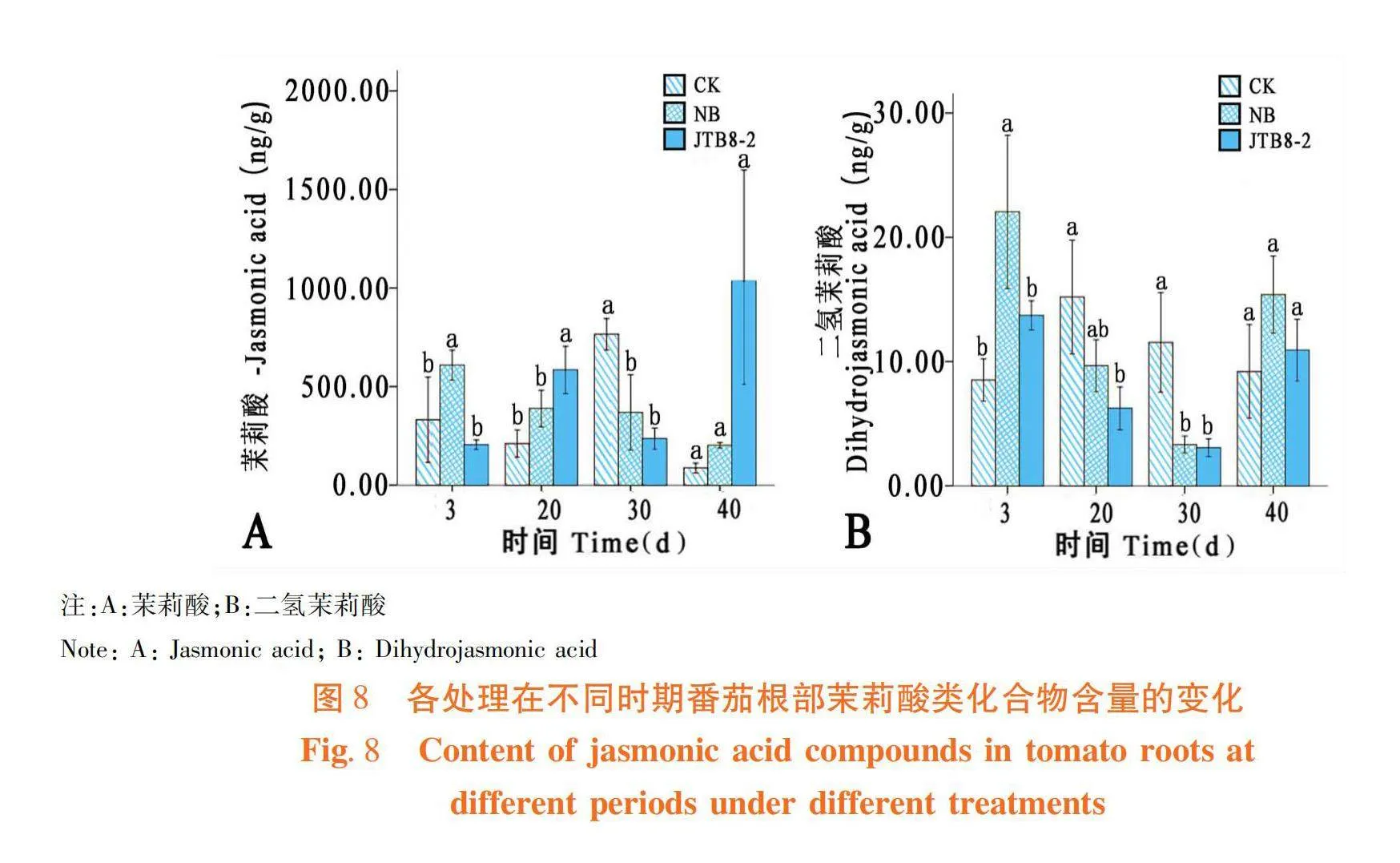
菌株JTB8-2處理的番茄根部中茉莉酸(Jasmonic acid)含量在3和30 d時低于清水對照與NB培養基處理,20和40 d時顯著高于清水對照和NB培養基處理(圖8A);菌株處理的番茄根部中二氫茉莉酸(Dihydrojasmonic acid)含量在3和40 d時高于清水對照,20和30 d時低于清水對照和NB培養基處理(圖8B)。菌株JTB8-2處理后番茄根部中生長素類化合物含量在3和20 d時均高于清水對照。圖8
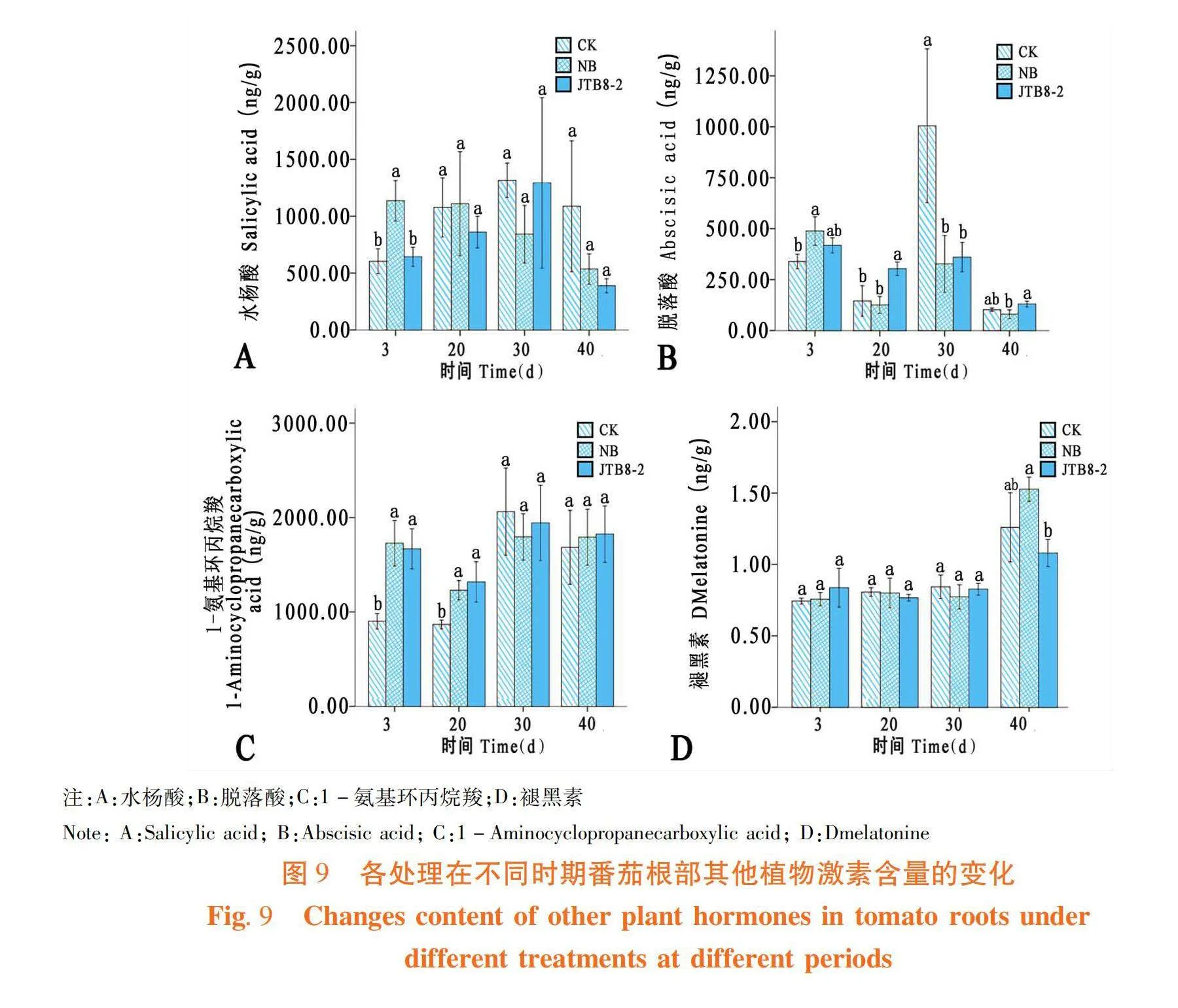
菌株JTB8-2處理的番茄根部中水楊酸(Salicylic acid)含量在3 d時高于清水對照,在20、30和40 d時均低于清水對照(圖9A);菌株處理的番茄根部中脫落酸(Abscisic acid)含量在3、20和40 d時高于清水對照,30 d時低于清水對照(圖9B);菌株處理的番茄根部中1-氨基環丙烷羧(1-Aminocyclopropanecarboxylic acid)含量在3、20和40 d時均高于清水對照,30 d時低于清水對照處理(圖9C);菌株處理的番茄根部中褪黑素(Dmelatonine)含量在3 d時高于清水對照和NB培養基處理,其他時期均低于清水對照(圖9D)。圖9
3 討 論
3.1 微生物防治列當具有安全性高、無殘留和不易產生耐藥性等優點,因此微生物防治列當的研究日益增多[14]。Mcerlean等[15]報道灰黃青霉菌DRPG產生的代謝物中展青霉素和灰黃霉素抑制了向日葵列當和瓜列當種子的萌發;Mehmet等[16]發現尖孢鐮刀菌可通過產生活性氧,顯著且不可逆的DNA遺傳毒性障礙、破壞蛋白質合成和代謝以及誘導列當細胞凋亡來傷害其宿主。貝萊斯芽孢桿菌對環境有較強的適應性,具有可在植物或土壤中大量繁殖和定殖、競爭營養位點和空間位點、誘導抗性、促生、增產和拮抗等特性,廣泛用于植物病害防治[17, 18]。試驗研究中貝萊斯芽孢桿菌 JTB8-2 菌株在防治瓜列當方面具有重要的應用價值,其發酵液可以作為一種綠色、高效、安全的防治方法為農業生產提供新的選擇。
許多微生物通過改變寄主自身防御酶活性來誘導植株抗性,從而減少列當寄生。Chen等[19]發現淡紫褐鏈霉菌通過提高向日葵根系多酚氧化酶活性,獲得對向日葵列當的抗性;Mabrouk等[20]報道根瘤菌提高豌豆中多酚氧化酶和過氧化物酶活性,使豌豆根部產生更多的酚類化合物和木質素進而增強對鋸齒列當抗性。CAT可通過調控植株體內H2O2穩態來調節植物免疫反應[21];POD參與植物體內許多生理生化反應,減少外界脅迫對植物的傷害,提高植物的抗逆性[22];PAL與木質素、植保素、軟木脂、植物抗毒素和水楊酸的生物合成有關,有助于加固細胞結構獲得抗性[23]。研究加入貝萊斯芽孢桿菌JTB8-2發酵液后,番茄根部在處理后3、20和30 d時CAT、POD與PAL酶活性提高,POD和CAT等酶共同構成植物體內的抗氧化防御系統,菌株可能通過提高CAT和POD活性減少有害H2O2含量[24],阻礙了瓜列當的寄生。瓜列當種子吸器通過穿透植物根部韌皮部和木質部才能完成寄生,PAL升高表明貝萊斯芽孢桿菌JTB8-2可通過增加了番茄細胞壁厚度、組織木質化程度,提高瓜列當芽管穿透番茄根部的難度,減少瓜列當寄生。在40 d時CAT、POD和PAL活性降低可能由于距離菌株處理后時間較長,番茄根部貝萊斯芽孢桿菌數量降低,誘導植株抗性作用減弱。
3.2 寄生雜草與寄主間物質流動是通過吸器來完成的, 吸器一直受到許多學者的關注,黃建中等[25]研究表明,在外源激素誘導日本菟絲子形成吸器過程中,細胞分裂素可使吸器形成的時間縮短;姚東瑞等[26]發現,無根藤吸器發育過程中吸器發育與細胞分裂素密切相關; Billard等[27]用細胞分裂素處理的 P. ramosa微愈傷組織置于寄主番茄根部后,顯著增加了微愈傷對寄主根的侵襲力;田芳等[28]發現細胞分裂素合成相關基因在吸器細胞與寄主維管束連接過程中高表達。研究通過對菌株JTB8-2處理后的番茄根系進行代謝組學分析,番茄根部細胞分裂素與生長素相關激素含量在前期增加,后期降低。可能前期細胞分裂素與生長素含量增加促進了瓜列當吸器的形成,后期這兩種激素含量的降低抑制了瓜列當吸器的形成,從而減少瓜列當寄生量。
3.3 細胞分裂素和生長素是調節植物生長發育和對環境脅迫反應的兩種經典激素[29],并對植物側根啟動有拮抗作用[30],表明細胞分裂素與生長素對于瓜列當寄生過程具有重要作用。細胞分裂素在瓜列當寄生番茄過程中的作用尚不清楚,但已有研究表明,可能涉及到植物的生長、分化和發育等多個方面[31-33]。未來的研究需要深入探討細胞分裂素與生長素在瓜列當寄生番茄中的作用機制,以更好地理解寄主植物生長發育和寄生的關系。
4 結 論
4.1 貝萊斯芽孢桿菌JTB8-2菌株發酵液處理在20 d時番茄植株瓜列當寄生量相比清水對照和NB培養基處理分別降低了81.67%和50.75%,30 d時分別降低了96.96%和79.52%,40 d時分別降低了95.54%和50.75%。貝萊斯芽孢桿菌JTB8-2發酵液在盆栽試驗條件下能夠顯著減少番茄植株瓜列當寄生量。
4.2 菌株發酵液澆灌番茄植株3、20和30 d后,番茄根部過氧化氫酶(CAT)活性均高于NB培養基處理和清水對照;番茄根系中28種植物激素類代謝物中11種代謝物含量具有差異,菌株JTB8-2處理的番茄根系中細胞分裂素類與生長素類化合物含量高于清水對照。番茄根系中過氧化氫酶活性提高及細胞分裂素、生長素相關激素含量增加可能是誘導番茄植株拮抗瓜列當主要因素。
參考文獻(References)
[1]陰知勤, 周桂玲. 新疆高等寄生植物(二)——列當科[J].八一農學院學報, 1993, 16(1): 48-54.
YIN Zhiqin, ZHOU Guiling. A higher parasitic plant in Xinjiang (II)—Orabanchaceae[J].Journal of Xinjiang Agricultural University, 1993, 16(1): 48-54.
[2] 吳海榮, 強勝. 檢疫雜草列當(Orobanche L.)[J].雜草科學, 2006, 24(2): 58-60.
WU Hairong, QIANG Sheng. The quarantine weed Orobanche L[J].Weed Science, 2006, 24(2): 58-60.
[3] 姚兆群, 曹小蕾, 付超, 等. 新疆列當的種類、分布及其防治技術研究進展[J].生物安全學報, 2017, 26(1): 23-29.
YAO Zhaoqun, CAO Xiaolei, FU Chao, et al. Review of the distribution and management technology of various Orobanche L. species in Xinjiang, China[J].Journal of Biosafety, 2017, 26(1): 23-29.
[4] 何偉, 羅文芳, 許建軍, 等. 貝萊斯芽胞桿菌JTB8-2的篩選、鑒定及其對瓜列當拮抗作用研究[J].中國生物防治學報, 2020, 36(5): 786-794.
HE Wei, LUO Wenfang, XU Jianjun, et al. Screening, identification and antagonistic effect of Bacillus velezensis JTB8-2 on orobanch eaegyptaica[J].Chinese Journal of Biological Control, 2020, 36(5): 786-794.
[5] 何偉, 羅文芳, 周軍輝, 等. 貝萊斯芽孢桿菌JTB8-2對加工番茄促生作用及其安全性評價[J].新疆農業科學, 2022, 59(5): 1260-1269.
HE Wei, LUO Wenfang, ZHOU Junhui, et al. Growth promoting effect and safety evaluation of Bacillus velezensis JTB8-2 on processed tomato[J].Xinjiang Agricultural Sciences, 2022, 59(5): 1260-1269.
[6] Iasur Kruh L, Bari V K, Abu-Nassar J, et al. Characterization of an endophytic bacterium (Pseudomonas aeruginosa), originating from tomato (Solanum lycopersicum L.), and its ability to inhabit the parasitic weed Phelipanche aegyptiaca[J].Plant Signaling amp; Behavior, 2020, 15(7): 1766292.
[7] Iasur Kruh L, Lahav T, Abu-Nassar J, et al. Host-Parasite-Bacteria triangle: the microbiome of the parasitic weed Phelipanche aegyptiaca and tomato- Solanum lycopersicum (mill.) as a host[J].Frontiers in Plant Science, 2017, 8: 269.
[8] 王亞嬌, 紀莉景, 栗秋生, 等. 生物除草菌劑Br-2對番茄列當的防治效果[J].中國蔬菜, 2017,(4): 65-68.
WANG Yajiao, JI Lijing, LI Qiusheng, et al. Control efficacy of microbial herbicide Br-2 against Orobanche aegyptiaca[J].China Vegetables, 2017,(4): 65-68.
[9] 王亞嬌, 紀莉景, 栗秋生, 等. 多功能列當生防鐮刀菌的篩選及種類鑒定[J].中國生物防治學報, 2016, 32(6): 788-793.
WANG Yajiao, JI Lijing, LI Qiusheng, et al. Isolation and identification of multifunction Bio-control agent Fusarium against Orobanche cernua[J].Chinese Journal of Biological Control, 2016, 32(6): 788-793.
[10] 陳杰, 馬永清, 郭振國, 等. 灰黃青霉對瓜列當的防效及對番茄根區土壤微生物的影響[J].中國生態農業學報(中英文), 2019, 27(5): 766-773.
CHEN Jie, MA Yongqing, GUO Zhenguo, et al. Effect of Penicillium griseofulvum on control of Orobanche aegyptiaca and microorganisms in rhizosphere soils of tomato[J].Chinese Journal of Eco-Agriculture, 2019, 27(5): 766-773.
[11] 申云鑫, 施竹鳳, 李銘剛, 等. 貝萊斯芽孢桿菌SH-1471發酵條件優化及其番茄枯萎病的防治效果[J].微生物學報, 2024, 64(1): 220-237.
SHEN Yunxin, SHI Zhufeng, LI Minggang, et al. Bacillus velezensis SH-1471: optimization of fermentation conditions and evaluation of the biocontrol effect on tomato Fusarium wilt[J].Acta Microbiologica Sinica, 2024, 64(1): 220-237.
[12] 馬爽. 貝萊斯芽孢桿菌K-9的篩選及其對馬鈴薯瘡痂病生防機制的研究[D].大慶: 黑龍江八一農墾大學, 2023.
MA Shuang. Screening of Bacillus Velezensis K-9 and Its Biocontrol Mechanism against Potato Scab Disease[D].Daqing: Heilongjiang Bayi Agricultural University, 2023.
[13] 蘭成忠. 黃瓜枯萎病菌LAMP檢測及貝萊斯芽孢桿菌FJ17-4生防機制研究[D].南昌: 江西農業大學, 2021.
LAN Chengzhong. LAMP Detection of Fusarium Oxysporum f.sp. cucumerinum Causing Cucumber Fusarium Wilt and Biological Control Mechanism of the Bacillus Velezensis FJ17-4[D].Nanchang: Jiangxi Agricultural University, 2021.
[14] He W, Li Y, Luo W F, et al. Herbicidal secondary metabolites from Bacillus velezensis JTB8-2 against Orobanche aegyptiaca[J].AMB Express, 2022, 12(1): 52.
[15] Chen J, Wei J, Gao J M, et al. Allelopathic inhibitory effects of Penicillium griseofulvum produced patulin on the seed germination of Orobanche cumana Wallr. and Phelipanche aegyptiaca Pers[J].Allelopathy Journal, 2017, 41(1): 65-80.
[16] Aybeke M. Fusarium infection causes genotoxic disorders and antioxidant-based damages in Orobanche spp[J].Microbiological Research, 2017, 201: 46-51.
[17] 孫正祥, 曹帥, 王藍琴, 等. 貝萊斯芽孢桿菌D61-A對水稻根際土壤細菌群落結構的影響[J].長江大學學報(自然科學版), 2023, 20(2): 113-120.
SUN Zhengxiang, CAO Shuai, WANG Lanqin, et al. Effects on bacterial community structure of the rhizosphere soil of rice plant treated by Bacillus velezensis D61-A[J].Journal of Yangtze University (Natural Science Edition), 2023, 20(2): 113-120.
[18] 尉婧, 王碧香, 李詩瑤, 等. 貝萊斯芽孢桿菌(Bacillus velezensis)的研究進展[J].天津農學院學報, 2022, 29(4): 86-91.
WEI Jing, WANG Bixiang, LI Shiyao, et al. Advances in the study of Bacillus velezensis[J].Journal of Tianjin Agricultural University, 2022, 29(4): 86-91.
[19] Chen J, Xue Q H, McErlean C S P, et al. Biocontrol potential of the antagonistic microorganism Streptomyces enissocaesilis against Orobanche cumana[J].BioControl, 2016, 61(6): 781-791.
[20] Mabrouk Y, Zourgui L, Sifi B, et al. Some compatible Rhizobium leguminosarum strains in peas decrease infections when parasitised by Orobanche crenata[J].Weed Research, 2007, 47(1): 44-53.
[21] 劉聰, 鄧宇宏, 劉選明, 等. 過氧化氫酶在植物生長發育和脅迫響應中的功能研究進展[J].生命科學研究, 2023, 27(2): 128-138.
LIU Cong, DENG Yuhong, LIU Xuanming, et al. Research advances in the function of catalase in plant growth, development and stress response[J].Life Science Research, 2023, 27(2): 128-138.
[22] 趙龍飛, 徐亞軍, 邵璇, 等. 兩株內生芽孢桿菌對鹽脅迫下大豆幼苗超氧化物歧化酶和過氧化物酶活性影響[J].微生物學通報, 2022, 49(5): 1664-1677.
ZHAO Longfei, XU Yajun, SHAO Xuan, et al. Two endophytic Bacillus strains from soybean nodules affect superoxide dismutase and peroxidase activities in soybean seedlings under salt stress[J].Microbiology China, 2022, 49(5): 1664-1677.
[23] 王軍, 趙桂琴, 柴繼寬, 等. BYDV侵染對燕麥抗氧化防御酶、苯丙氨酸解氨酶及多酚類氧化酶的影響[J].草地學報, 2020, 28(1): 56-63.
WANG Jun, ZHAO Guiqin, CHAI Jikuan, et al. Effects of BYDV infection on antioxidant enzymes, phenylalanine ammonia lyase and polyphenol oxidase in oat[J].Acta Agrestia Sinica, 2020, 28(1): 56-63.
[24] 祁靜靜, 秦秀娟, 謝宇, 等. 過氧化氫酶基因CsKat01與柑橘潰瘍病相關性分析[J].園藝學報, 2021, 48(1): 26-36.
QI Jingjing, QIN Xiujuan, XIE Yu, et al. Correlation analysis of Citrus catalase gene CsKat01 and Citrus canker disease[J].Acta Horticulturae Sinica, 2021, 48(1): 26-36.
[25] 黃建中, 李揚漢. 外源細胞分裂素誘導日本菟絲子形成吸器與鈣調素的關系[J].西北植物學報, 1991, 11(2): 116-121, 182.
HUANG Jianzhong, LI Yanghan. Relationship between haustorial formation of cuscuta japonica induced by exogenous cytokinin and calmodulin[J].Acta Botanica Boreali-occidentalia Sinica, 1991, 11(2): 116-121, 182.
[26] 姚東瑞, 鄭曉明, 黃建中, 等. 寄生植物無根藤吸器發育過程中酸性磷酸酯酶與細胞分裂素變化的研究[J].植物學報, 1994, 36(3): 170-174.
YAO Dongrui, ZHENG Xiaoming, HUANG Jianzhong, et al. Changes of acid phosphatase and cytokininsduring haustorial development of theparasitic plant cassytha filiformis L[J].Journal of Integrative Plant Biology, 1994, 36(3): 170-174.
[27] Billard E, Goyet V, Delavault P, et al. Cytokinin treated microcalli of Phelipanche ramosa: an efficient model for studying haustorium formation in holoparasitic plants[J].Plant Cell, Tissue and Organ Culture (PCTOC), 2020, 141(3): 543-553.
[28] 田芳. 分枝列當吸器形成過程顯微觀察及影響其形成相關基因的篩選分析[D].石河子: 石河子大學, 2022.
TIAN Fang. Microscopic Observate to Haustorium Formation Process of Phelipanche Aegyptiaca and Screen for Genes That Affects Its Formation[D].Shihezi: Shihezi University, 2022.
[29] de Wit M, Lorrain S, Fankhauser C. Auxin-mediated plant architectural changes in response to shade and high temperature[J].Physiologia Plantarum, 2014, 151(1): 13-24.
[30] Bielach A, Podlesáková K, Marhavy P, et al. Spatiotemporal regulation of lateral root organogenesis in Arabidopsis by cytokinin[J].The Plant Cell, 2012, 24(10): 3967-3981.
[31] Glanz-Idan N, Tarkowski P, Tureková V, et al. Root-shoot communication in tomato plants: cytokinin as a signal molecule modulating leaf photosynthetic activity[J].Journal of Experimental Botany, 2020, 71(1): 247-257.
[32] 陳兆玉, 王永, 丁靜, 等. 細胞分裂素受體基因SlHK4突變對番茄抗旱性的影響[J].南京農業大學學報, 2022, 45(2): 235-243.
CHEN Zhaoyu, WANG Yong, DING Jing, et al. Effects of cytokinin receptor gene SlHK4 mutation on drought resistance of tomato[J].Journal of Nanjing Agricultural University, 2022, 45(2): 235-243.
[33] Liu C F, Yang N, Teng R M, et al. Exogenous methyl jasmonate and cytokinin antagonistically regulate lignin biosynthesis by mediating CsHCT expression in Camellia sinensis[J].Protoplasma, 2023, 260(3): 869-884.
Metabolomics analysis of Bacillus velezensis JTB8-2 induced tomato antagonism towards Orobanche aegyptiaca based on defense enzyme
ZHU Xiafen1, 2, HE Wei2, LUO Wenfang2, ZHOU Junhui2, LI Kemei1, XU Jianjun2
(1. College of Agriculture, Xinjiang Agricultural University, Urumqi 830052, China;2. Key Laboratory of Integrated Pest Management on Crops in Northwestern Oasis Ministry of Agriculture/Xinjiang Key Laboratory of Agricultural Biosafety/Institute of Plant Protection/Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China)
Abstract:【Objective】 Orobanche aegyptiaca is a completely parasitic, malignant weed. Bacillus velezensis JTB8-2 demonstrates potent inhibitory capabilities against O. aegyptiaca. Investigating its mechanism, so research into it might provide a solid theoretical foundation for the application of this strain in the field. 【Methods】 In order to investigate the molecular mechanism of B. elezensis JTB8-2-induced resistance to O. aegyptiaca in tomato, we employed pot culture, enzyme activity assays, and ultra-high performance liquid chromatography-mass spectrometry (UHPLC-MRM-MS/MS).【Results】 The findings revealed that the application of B. elezensis JTB8-2 fermentation broth to tomatoes at 20, 30, and 40 days after transplantation resulted in a parasitic O. aegyptiaca tubercle count of 0.33, 0.17, and 0.33, respectively. This represented a reduction of 81.67%, 96.96%, and 95.54% compared to the control group, and a reduction of 50.75%, 79.52%, and 50.75%, respectively, compared to the NB medium treatment. The catalase (CAT) activity of tomato roots was found to be higher than that of both the medium treatment and water control group after 3, 20, and 30 days. Moreover, differences were observed in the content of 11 metabolites among 28 plant hormone metabolites in tomato roots. The levels of cytokinins and auxin compounds in tomato roots treated with strain JTB8-2 were higher than those in the water control group.【Conclusion】 The upregulation of catalase activity, cytokinin, and auxin-related hormones in tomato roots treated with strain JTB8-2 may elicit a systemic resistance response in the plant, thereby reducing the severity of O. aegyptiaca parasitism.
Key words:Orobanche aegyptiaca; Bacillus velezensis; defensive enzyme; metabolomics; induced resistance
Fund projects:Project of Natural Science Foundation of Xinjiang Uygur Autonomous Region (2022D01A91); Project for Supporting Stable Agricultural Sci-Tech Renovation(xjnkywdzc-2022004); Earmarked Fund for XJARS (XJARS-07)
Correspondence author:LI Kemei(1972-), femal, from Rugao, Jiangsu, professor, master's supervisor, research direction: vegetable disease and control, (E-mail)likemei@xjau.edu.cn
XU Jianjuni(1972-), male, from Mengjin, Henan, researcher,research direction: control of vegetables diseases and insect pests,(E-mail)xjj72@163.com

