不同相態婁徹氏鏈霉菌A144揮發性物質對蘋果樹腐爛病菌的抑制效果
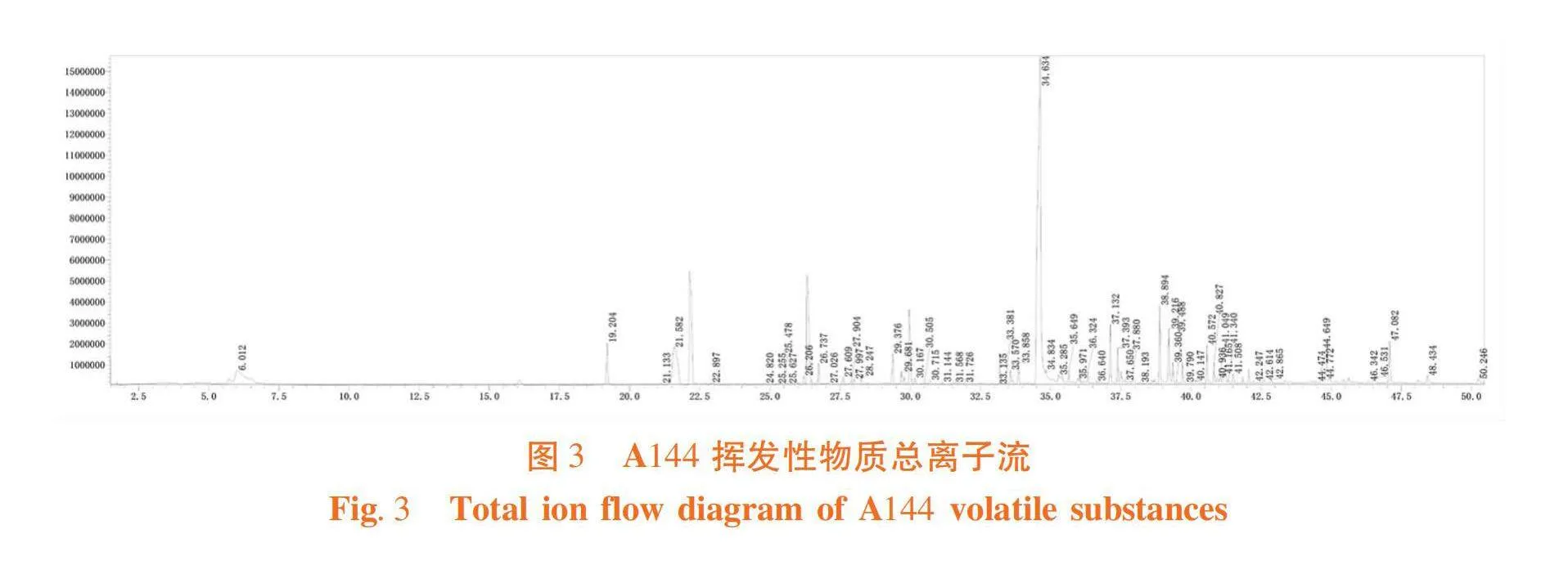

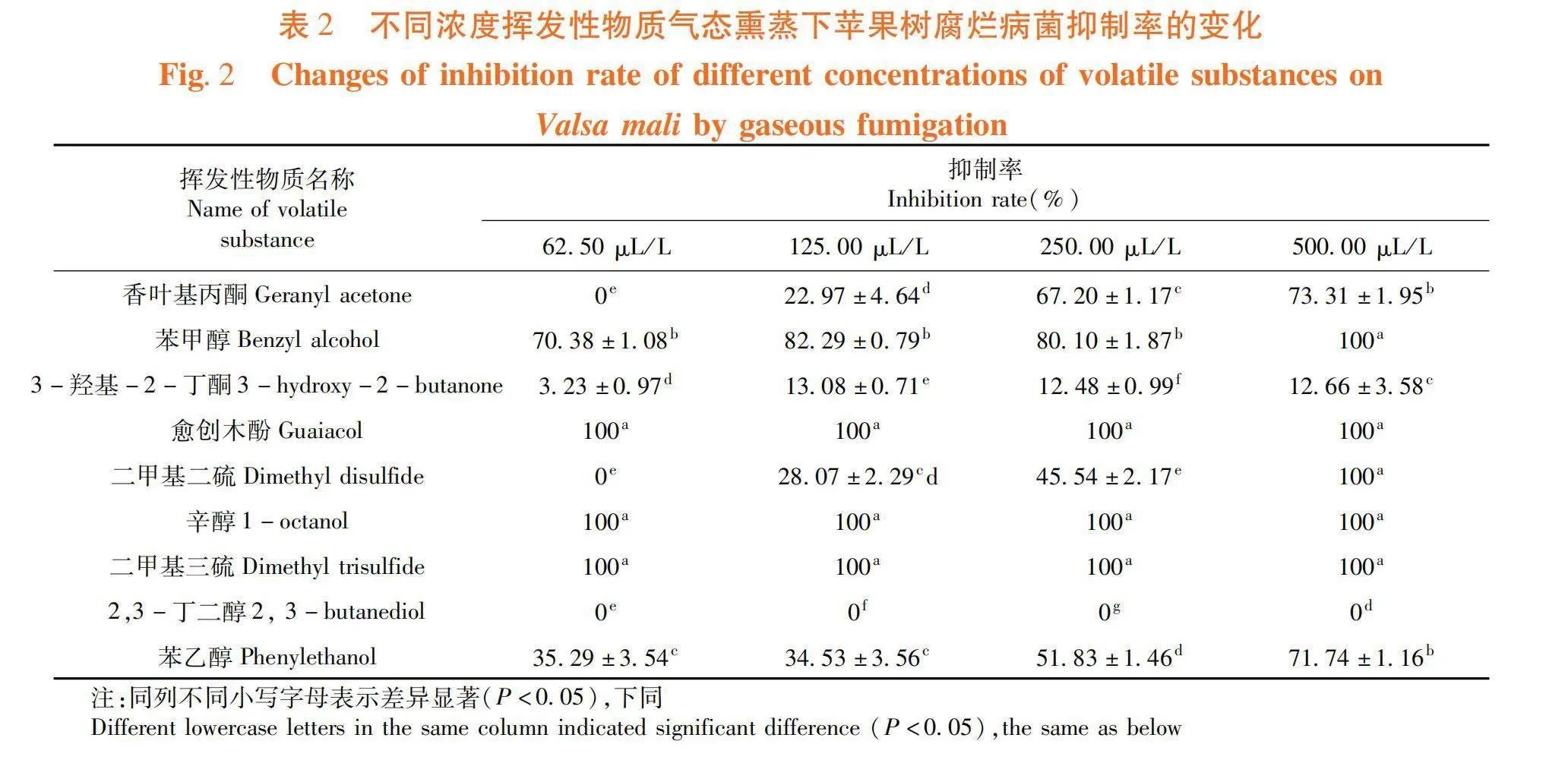
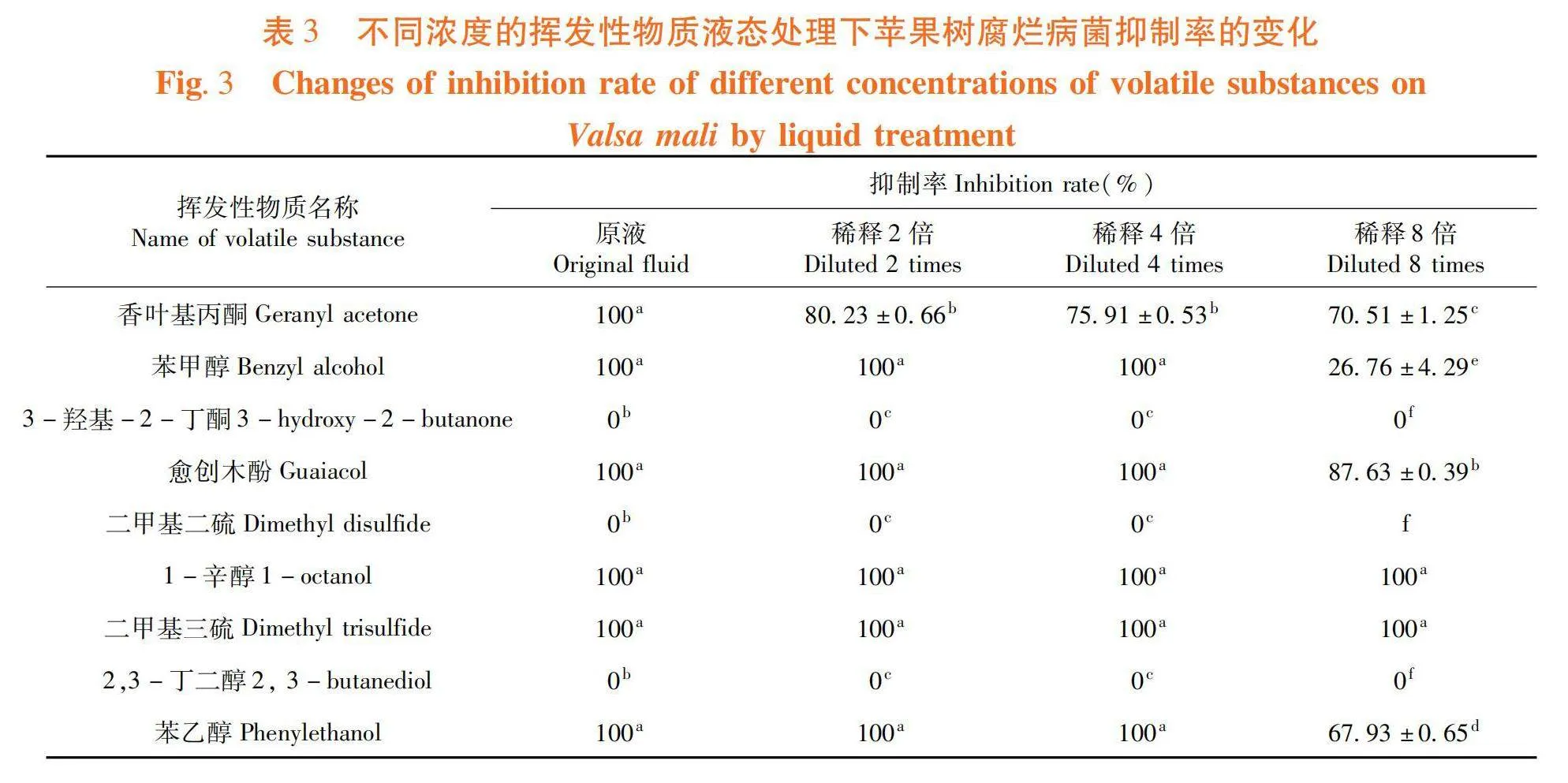
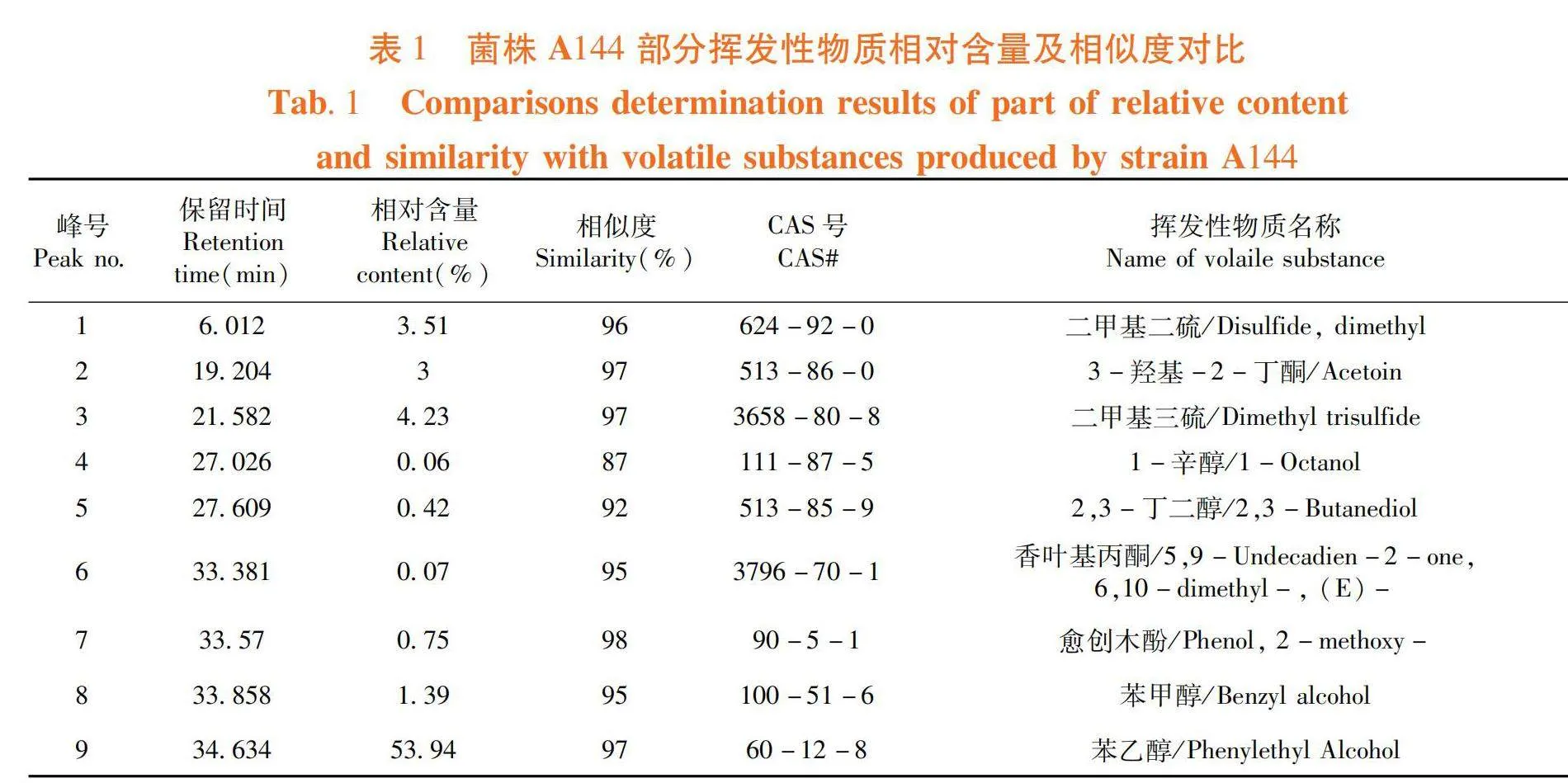
摘 要:【目的】研究不同相態下婁徹氏鏈霉菌Streptomyces rochei A144揮發性物質對蘋果樹腐爛病菌殼囊孢Valsa mali的抑制效果,并進行體外檢測,確定具有抑菌活性揮發性物質種類。【方法】采用平板對扣法測定不同生長時期(0、10、20、25、30 d)婁徹氏鏈霉菌A144揮發性物質對蘋果樹腐爛病菌的抑制效果,使用頂空固相微萃取和氣相色譜-串聯質譜法檢測分析其揮發性物質的含量,分別采用平板對扣法和涂抹法得出液態和氣態處理下具有較好抑菌活性的揮發性物質。【結果】當婁徹氏鏈霉菌A144生長至20 d時,菌株A144產生的揮發性物質對蘋果樹腐爛病菌的抑制率為100%;生長至20 d的菌株A144共產生了63種揮發性物質。當濃度為62.50 μL/L時,愈創木酚、1-辛醇和二甲基三硫氣態熏蒸處理仍能完全抑制蘋果樹腐爛病菌的生長;將原液稀釋8倍后,即體積分數為12.5% 的1-辛醇和二甲基三硫液態處理仍能完全抑制蘋果樹腐爛病菌的生長。【結論】揮發性物質單體化合物1-辛醇和二甲基三硫具有顯著抑制蘋果樹腐爛病菌的能力,有潛力作為抗蘋果樹腐爛病的重要開發農藥藥劑來源。
關鍵詞:婁徹氏鏈霉菌;生長時期;揮發性物質;蘋果樹腐爛病菌
中圖分類號:S188 文獻標志碼:A 文章編號:1001-4330(2024)10-2475-09
收稿日期(Received):2024-04-08
基金項目:新疆維吾爾自治區重點實驗室開放課題(2020D04032);新疆維吾爾自治區青年基金項目(2022D01B172);新疆農業科學院青年骨干創新能力培養項目(xjnkq-2023015、xjnkq-2023013)
作者簡介:黃偉(1991-),男,新疆阿圖什人,助理研究員,研究方向為有益微生物代謝產物,(E-mail)1428775150@qq.com
通訊作者:張麗娟(1986-),女,山東人,副研究員,研究方向為微生物資源,(E-mail)532172011@qq.com
王瑋(1973-),女,新疆人,研究員,博士,研究方向為微生物資源,(E-mail)mypony926@163.com
0 引 言
【研究意義】我國是世界上最大的蘋果生產和消費國,蘋果栽培面積及總產量均居世界第一[1]。由黑腐皮殼Valsa mali引起的蘋果樹腐爛病是蘋果樹的主要病害[2-3],可使樹皮腐爛,枝條枯死,最終造成蘋果樹死亡[4-5]。目前對蘋果樹腐爛病防治主要措施包括農業防治、化學防治和生物防治,粗放管理果園將加重蘋果樹腐爛病的發生程度,長期大量施用化學農藥易導致病原菌的抗藥性。因此,篩選安全、高效、低毒的新型生物農藥具有實際意義。【前人研究進展】利用拮抗菌及其代謝產物防治植物病害是極具前景的方法[6-7]。拮抗菌產生的揮發性物質(volatile organic compounds,VOCs)可以在常溫常壓下快速揮發,進入氣相狀態,擴散并達到控制植物病害的目的[8],作用機理主要有抑制植物病原菌的生長、孢子萌發,干擾病原菌代謝,誘導植物產生抗病性等[9-10]。Mccain[11]報道了微生物產生的揮發性物質具有抑菌作用,灰色鏈霉菌Streptomyces griseus產生的揮發性物質對炭疽病菌Gleosporium aridum的孢子形成具有很強的抑制效果。Fiddaman 等[12]報道細菌也可以產生抑菌揮發性物質,枯草芽胞桿菌Bacillus subtilisNCIMB 12376菌株產生的揮發性物質可以顯著抑制立枯絲核菌Rhizoctonia solani和終極腐霉Globisporangium ultimum的生長。解淀粉芽胞桿菌T-5產生的揮發性物質使番茄青枯病原菌Ralstonia solanacearum毒力相關基因表達量下降,病原菌代謝活性受到影響,運動性相關基因表達減少,移動能力受限[13]。拮抗菌產生的揮發性物質熏蒸處理不會與果蔬直接接觸,在常溫下易揮發,易降解,不易在果蔬表面殘留,因此在防治果蔬采后病害方面具有廣泛的應用前景[14]。【本研究切入點】來自耐輻射微生物資源庫中的婁徹氏鏈霉菌A144,其代謝產物蛋白、脂肽和揮發性物質對蘋果樹腐爛病原菌均表現出一定的抑制效果[15],然而,對菌株A144揮發性物質單體化合物抑制蘋果樹腐爛病菌的研究尚未深入。【擬解決的關鍵問題】測定并分析婁徹氏鏈霉菌A144菌株產生的揮發性物質對蘋果樹腐爛病菌的抑菌成分,測試在氣態熏蒸和液態直接接觸兩種相態條件下的有效抑菌成分,為該菌株及揮發性物質在蘋果樹腐爛病菌病害防治上的應用提供理論依據。
新疆農業科學第61卷 第10期黃 偉等:不同相態婁徹氏鏈霉菌A144揮發性物質對蘋果樹腐爛病菌的抑制效果
1 材料與方法
1.1 材 料
菌株:菌株A144分離自中國輻射污染區,經鑒定為婁徹氏鏈霉菌(Streptomyces rochei),保存于新疆農業科學院微生物應用研究所耐輻射微生物資源庫;蘋果樹腐爛病原菌(Valsa mali)為中國農業大學李健強教授贈送。
培養基:馬鈴薯葡萄糖瓊脂培養基(PDA)、馬鈴薯葡萄糖培養基(PDB)、ISP2培養基均購自青島海博生物有限公司。苯乙醇、二甲基三硫、二甲基二硫、3-羥基-2-丁酮、苯甲醇、2,3-丁二醇、愈創木酚、香葉基丙酮、1-辛醇等揮發性物質均購自上海麥克林生化科技股份有限公司。無水硫酸鈉購自天津市北聯精細化學品開發有限公司。
儀器與設備:DHP-052型恒溫震蕩培養箱(上海一恒科學儀器有限公司),SX-500型高壓滅菌鍋(日本TOMY公司),FA-2204型電子天平(上海衡平儀器儀表廠),Rot ina 380r型高速冷凍離心機(鄭州長城科工貿有限公司),SW-CJ-2FD型無菌超凈工作臺(蘇州凈化設備有限公司),B-300旋轉蒸發儀(瑞士步琦有限公司),50/30μm DVB/CAR/PDMS固相微萃取頭及萃取手柄(上海安譜實驗科技股份有限公司),TQ8040NX三重四極桿型氣質聯用儀(日本島津公司)。
1.2 方 法
1.2.1 不同生長時間的菌株A144揮發性物質對蘋果樹腐爛病菌的抑制效果
分別在ISP2和PDA培養基中活化菌株A144和蘋果樹腐爛病原菌,待蘋果樹腐爛病菌培養7 d后,取直徑為8 mm的菌餅,放置于新的PDA培養基中;將菌株A144在新的ISP2培養基平板中劃線鋪滿,去掉培養皿皿蓋,與含蘋果樹腐爛病菌菌餅的培養皿對扣,使用兩層封口膜密封,此計為0 d,以此類推,在菌株A144生長至第10、20、25和30 d時,均采用上述操作,每處理重復3次,置于28℃培養箱中培養5 d,采用十字交叉法測量蘋果樹腐爛病菌的菌落直徑,計算抑制率。抑制率=(對照組菌落直徑-處理組菌落直徑)/對照組菌落直徑×100%。
1.2.2 菌株A144揮發性物質的測定
提取:參考黃偉等[16]方法,在菌株A144生長時期為第20 d時取出提取。
頂空固相微萃取:用于頂空固相微萃取的光纖(50/30 μm DVB/CAR/PDMS)在250°C下預處理30 min[17-18]。將預先清潔的纖維插入含有10 mL樣品的100 mL頂空萃取瓶中,并在95℃下浸泡1 h。隨后,將纖維手動插入注射器端口,并在250℃下解吸5 min[19]。
色譜使用島津 InertCap WAX色譜柱(30 m×0.25 mm×0.25 μm)的氣相色譜-質譜儀分離噴油器在無分流模式下工作。注入器、界面和離子檢測器的溫度分別為230、250和220℃。5.0級He用作載氣,流速為1 mL/min。柱在50℃下保持2 min,然后以3℃/min的速度上升至100℃,最后以4℃/min的溫度上升至240℃并保持4 min。EI離子源在70 eV下采集,全掃描質量(m/z)在采集范圍為45~500 amu。根據質譜數據庫NIST 08和FNSC 1.3庫比較質譜,以確定揮發性有機化合物的鑒定[20]。
1.2.3 不同相態揮發性物質純品測定Valsa mali的抑菌活性
1.2.3.1 揮發性物質氣態熏蒸測定Valsa mali的抑菌活性
按照平板對扣法,培養皿體積為80 mL,除去培養基體積20 mL,培養皿對扣后體積為140 mL。使用移液槍分別移取8.75、17.50、35.00和70.00 μL的液態揮發性物質純品置于1.5 mL滅菌離心管蓋中,因此對應揮發物純品含量分別為62.50、125.00、250.00和500.00 μL/L。在溫度為28℃的培養箱中培養5 d,采用十字交叉法測量蘋果樹腐爛病菌的菌落直徑,計算抑制率。抑制率=(對照組菌落直徑-處理組菌落直徑)/對照組菌落直徑×100%。
1.2.3.2 揮發性物質液態處理測定Valsa mali的抑菌活性
使用移液槍移取揮發性物質純品100 μL,此計為原液,然后用無水乙醇分別稀釋2、4、8倍,即體積分數分別為50%、25%和12.5%的揮發性物質,對照組為無水乙醇溶液,吸取不同稀釋倍數的揮發性物質液體100 μL于PDA培養基表面,使用涂布棒將其涂抹均勻,再在培養基中打一個直徑為0.8 cm的孔,接入蘋果樹腐爛病菌菌餅(直徑同樣為0.8 cm),置于28℃下培養5 d,采用十字交叉法測量蘋果樹腐爛病菌的菌落直徑,計算抑制率。抑制率=(對照組菌落直徑-處理組菌落直徑)/對照組菌落直徑×100%。
1.3 數據處理
采用SPSS 20軟件的Duncan氏多重比較檢驗法進行差異顯著性分析(P<0.05,差異顯著),Excel繪制圖表。
2 結果與分析
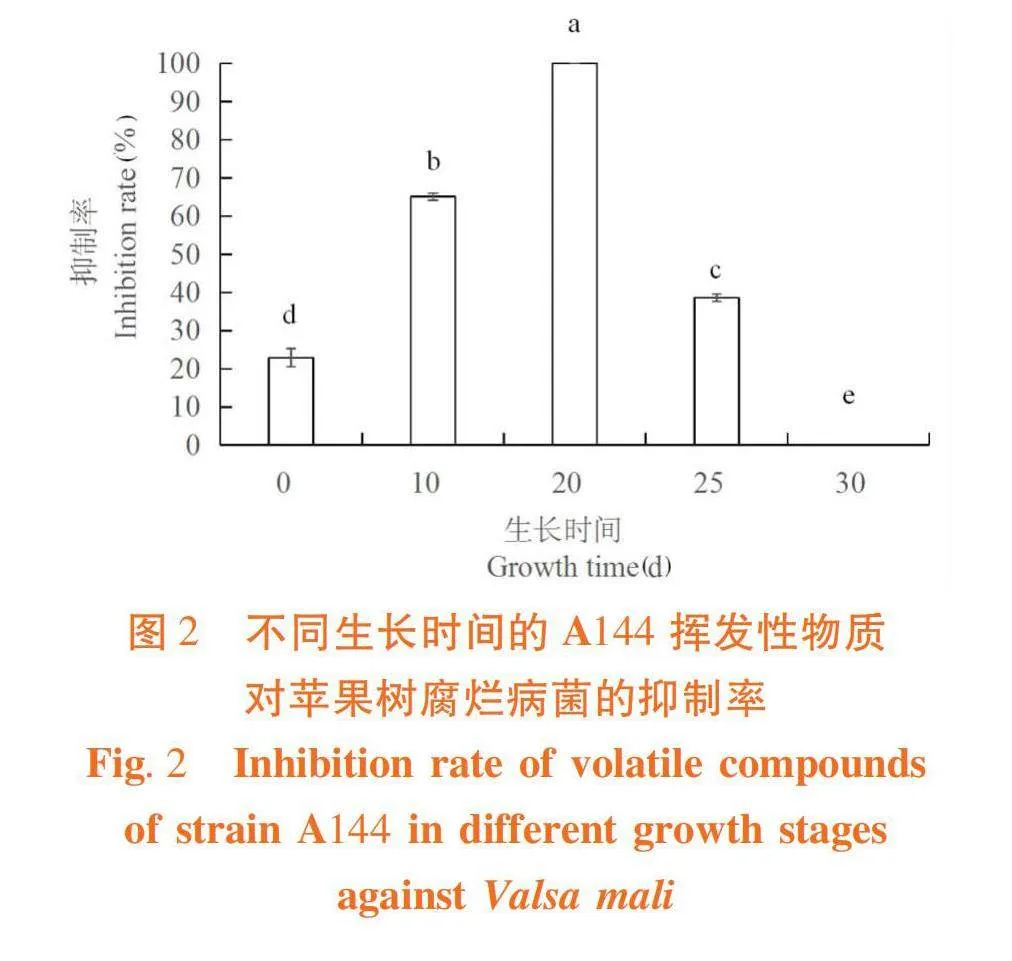
2.1 不同生長時間的A144揮發性物質對Valsa mali的抑制效果
研究表明,采用平板對扣法檢測不同生長時間(0、10、20、25 和30 d)A144揮發性物質對蘋果樹腐爛病菌的抑制效果并計算出抑制率,隨著生長時間的延長,抑制效果整體呈先增強后減弱的趨勢,其中生長至20 d的A144產生的揮發性物質對蘋果樹腐爛病菌的抑制效果最佳,抑制率達到100%,高于其他生長時期,達到顯著性差異(Plt;0.05);當生長時期為30 d時A144產生的揮發性物質對蘋果樹腐爛病菌已無抑制效果,抑制率降為0%。圖1~2
2.2 菌株A144產生的揮發性物質測定結果
研究表明,采用頂空吸附法收集生長至20 d的A144產生的揮發性物質,獲得總離子流圖,菌株A144共產生了63種揮發性物質,其中主要成分為苯乙醇、二甲基三硫、棕櫚酸甲酯、二甲基二硫等,分別占揮發性物質總量的53.94%、4.23%、3.88%和3.51%。圖3,表1
2.3 揮發性物質純品不同相態對蘋果樹腐爛病菌抑菌活性的影響
研究表明,篩選出9種化合物測試體外條件下的抑菌活性,分別為苯乙醇、二甲基三硫、二甲基二硫、3-羥基-2-丁酮、苯甲醇、愈創木酚、2,3-丁二醇、香葉基丙酮、1-辛醇。
2.3.1 揮發性物質氣態熏蒸對蘋果樹腐爛病菌抑菌活性的影響
研究表明,不同濃度下,同種揮發性物質氣態熏蒸對蘋果樹腐爛病菌的抑制率總體呈濃度依賴效應,即濃度越高,抑制率也越高。當濃度為500 μL/L,5種揮發性物質對蘋果樹腐爛病菌的抑制率均達到了100%,分別為苯甲醇、愈創木酚、二甲基二硫、1-辛醇和二甲基三硫;隨著濃度降低,大部分揮發性物質的抑菌效果也在降低,但愈創木酚、1-辛醇和二甲基三硫在濃度為62.50 μL/L時仍能完全抑制蘋果樹腐爛病菌的生長。其次,苯甲醇對蘋果樹腐爛病菌的抑制效果較好,當濃度為62.50 μL/L時,抑制率為70.38%,僅次于3種效果最優的揮發性物質,而苯乙醇在相同濃度條件下對蘋果樹腐爛病菌的抑制率約為苯甲醇的50%(Plt;0.05)。當濃度為62.50 μL/L時,香葉基丙酮、二甲基二硫和2,3-丁二醇對蘋果樹腐爛病菌已無抑制效果,其中2,3-丁二醇在4個濃度條件下,氣態熏蒸處理對蘋果樹腐爛病菌均沒有抑制作用。3-羥基-2-丁酮對蘋果樹腐爛病菌的抑制作用相對較小,當濃度為62.50 μL/L時,抑制率僅為3.23%。表2
2.3.2 A144揮發性物質液態處理下蘋果樹腐爛病菌的抑菌活性變化
研究表明,隨著濃度降低,同種揮發性物質液態直接接觸抑菌率總體呈下降趨勢。當揮發性物質為原液時,有6種揮發性物質對蘋果樹腐爛病菌的抑制率均達到了100%,分別為香葉基丙酮、苯甲醇、愈創木酚、1-辛醇、二甲基三硫和苯乙醇;將原液稀釋8倍后,1-辛醇和二甲基三硫仍能完全抑制蘋果樹腐爛病菌的生長。其次,愈創木酚對蘋果樹腐爛病菌的抑制效果較好,當原液稀釋8倍后,抑制率為87.63%,抑菌效果顯著優于香葉基丙酮、苯乙醇和苯甲醇(Plt;0.05)。在4個濃度條件下,3-羥基-2-丁酮、二甲基二硫和2,3-丁二醇液態處理對蘋果樹腐爛病菌均無抑制作用。表3
3 討 論
3.1 鏈霉菌揮發性物質抑菌活性及種類、含量
目前已報道多種鏈霉菌可以產生抑菌揮發性物質。小白鏈霉菌Streptomyces albulus揮發性有機物對核盤菌菌絲生長的抑制率為40.3%[21]。Li 等[22-23]報道,球孢鏈霉菌S. globisporusJK-1 接種麥粒后,產生的揮發性物質能有效抑制灰葡萄孢霉Botrytis cinerea和意大利青霉Penicillium italicum的菌絲生長、孢子萌發及芽管伸長,有效抑制采后番茄灰霉病和砂糖橘青霉病。王小姣等[24]使用白刺鏈霉菌S. albospinus誘變菌株U-L-4產生的揮發性物質熏蒸處理黃瓜尖孢鐮刀菌,病原菌菌落直徑下降至3.5 cm,與對照相比抑制率達到53.2%。前期研究發現婁徹氏鏈霉菌A144菌株揮發性物質對Valsa mali的抑制率為22.87%[15]。
拮抗微生物揮發性物質的釋放是動態的過程,隨著微生物生長時間的延長,其產生的揮發性物質的種類和含量將發生變化[25]。經過平板對扣試驗,在婁徹氏鏈霉菌A144菌株生長時間為20 d時,其產生的揮發性物質對Valsa mali的抑制率為100%,而當生長時期為30 d時,菌株A144產生的揮發性物質對Valsa mali已無抑制效果。揮發性物質的抑菌效果隨著A144生長時間的延長呈先增強再減弱的趨勢,張春慧[26]研究發現,當培養時間為8 d時,鏈霉菌TD-1產生的揮發性物質的對指示菌灰霉病菌的抑菌作用最強,抑菌率為45.92%,顯著高于其他各組;培養4 d的鏈霉菌TD-1就開始產生揮發性抑菌物質,培養4~8 d的鏈霉菌TD-1產生的揮發性物質對灰霉病菌抑菌率逐漸增強,而后抑菌率逐漸減弱。
Wilkins等[27]通過 GC-FIC 和 GC-MS 測定了26種鏈霉菌產生的揮發性物質,通過保留指數和質譜的數據確定了120種揮發性物質,主要是烷類、烯烴類、醇類、酯類、酮類、含硫揮發性物質等。試驗中通過GC-MS/MS測定生長至20 d的婁徹氏鏈霉菌A144揮發性物質有63種,其中苯乙醇占比最高,為53.94%,其次為二甲基三硫,占比為4.23%。呂昂[28]報道了將陽陵鏈霉菌S. yanglinensis3-10菌株接種于小麥粒培養物中,發現培養10 d 后其產生的揮發性物質對黃曲霉Aspergillus flavus菌落生長的抑制效果最佳,比對照組菌落直徑減少38.19%;經氣相色譜-質譜聯用儀測定共產生了19種揮發性物質,含有醇類、酮類、萜類、有機酸酯類等,其中含量最高的揮發性物質為2-甲基異莰醇,且當該菌生長時間為10 d時產生的揮發性物質數量也是最多的。說明不同的鏈霉菌產生的揮發性物質種類和含量均有所差別,而生長時間也是其重要的影響因素之一。
3.2 揮發性物質氣態和液態處理對蘋果樹腐爛病菌的抑菌效果
試驗使用9種純品驗證揮發性物質氣態熏蒸和液態直接接觸對蘋果樹腐爛病菌的抑制效果。當揮發性物質濃度為62.5 μL/L(氣態抑菌)和原液稀釋8倍(液態抑菌)時,二甲基三硫和1-辛醇均能完全抑制蘋果樹腐爛病菌的生長。已有報道二甲基三硫可以抑制多種病原菌,濃度為250 μL/L的二甲基三硫醚氣態熏蒸完全抑制了蘋果輪腐病菌Botryosphaeria dothidea的菌絲體生長[29]。二甲基三硫醚濃度在4.58 μL/L時對膠孢炭疽菌Colletotrichum gloeosporioides熏蒸處理后抑菌率達到50%,而濃度為12.69 μL/L時抑菌率達到95%[30]。1-辛醇作為生物熏蒸劑在防治植物病原菌中也展現出廣闊的應用潛力。1-辛醇氣態熏蒸和液體接觸在低濃度下劑量依賴性地抑制黃曲霉孢子萌發和菌絲體生長。模擬貯藏試驗表明,300 μL/L的1-辛醇熏蒸處理完全控制了含水量為 20%小麥、玉米中黃曲霉的生長[31]。
目前對愈創木酚抑制植物病原菌的研究較少。含有大量愈創木酚的植物提取物表現出抑菌作用[32-33]。揮發性物質濃度為62.5 μL/L時,愈創木酚氣態熏蒸對蘋果樹腐爛病菌的抑制率為100%,原液稀釋8倍后,液態直接接觸處理對蘋果樹腐爛病菌的抑制率為87.63%,氣態抑菌效果強于液態抑菌效果。氣態抑菌和液態抑菌效果僅次于二甲基三硫和1-辛醇,說明愈創木酚在植物病原菌防治中具有很強的應用價值。苯乙醇是許多拮抗菌都會產生的揮發性物質[34-35],當苯乙醇加入量為50 μL時,尖孢鐮刀菌的菌落直徑只有1.2 cm,氣態熏蒸的抑菌率達到82.27%[36]。在最低濃度條件下,苯乙醇液態處理抑菌效果優于氣態熏蒸處理,香葉基丙酮也是同樣的結果,說明使用液體處理更能達到較好的抑制蘋果樹腐爛病菌的效果。3-羥基-2丁酮能夠對番茄頸腐根腐病尖孢鐮刀菌有明顯的抑制作用[37],但在試驗研究中其氣態熏蒸和液態直接接觸的抑菌效果均表現微弱。二甲基二硫也是報道較多的抑菌揮發性物質[38-39],研究中二甲基二硫液態處理無抑菌效果,當濃度為500 μL/L時,氣態熏蒸對蘋果樹腐爛病菌的抑制率達到100%,濃度降低至62.5 μL/L時已無抑制效果,表明當二甲基二硫氣態熏蒸時,比其液態處理時對蘋果樹腐爛病菌的抑制效果更好。
揮發性物質氣態熏蒸處理適用于密閉空間,未來在溫室大棚中蘋果樹苗木或盆景病害防治具有潛在的應用價值,將拮抗微生物自身或揮發性物質以間接熏蒸的方式作用于樹體,預防和控制初期病害。李寶慶等[40]報道了枯草芽抱桿菌CAB-1對黃瓜白粉病具有較好的防治作用,防治效果為94.6%。因使用環境主要為相對密閉的溫室大棚,推測揮發性物質在在其生防過程中可能起到了相對重要的作用。而液態處理適用于農藥成分配制或與其它抗菌劑復配,應用于大田中的蘋果樹或其它果樹、作物,直接作用于刮除蘋果樹病害組織處,達到治療的作用。
4 結 論
當婁徹氏鏈霉菌A144生長20 d時,所產生的揮發性物質對蘋果樹腐爛病菌的抑制效果最佳,達到100%。菌株A144在不同生長時期共產生63種揮發性物質。當揮發性物質濃度為62.5μL/L(氣態抑菌)和體積分數為12.5%(液態抑菌)時,二甲基三硫和1-辛醇均能完全抑制蘋果樹腐爛病菌的生長,揮發性物質單體化合物有潛力成為農藥藥劑來源。
參考文獻(References)
[1]張瓊, 劉召陽, 高承宇, 等. 蘋果樹腐爛病菌含cupin結構域蛋白Vmcupin1的鑒定及功能分析[J].植物病理學報, 2023, 53(4): 580-588.
ZHANG Qiong, LIU Zhaoyang, GAO Chengyu, et al. Identification and functional analysis of cupin domain-containing protein Vmcupin1 in Valsa Mali[J].Acta Phytopathologica Sinica, 2023, 53(4): 580-588.
[2] 戴蓬博, 張榮, 孫廣宇. 中國蘋果病害病原菌物名錄[J].菌物學報, 2021, 40(4): 936-964.
DAI Pengbo, ZHANG Rong, SUN Guangyu. A checklist of pathogenic fungi on apple in China[J].Mycosystema, 2021, 40(4): 936-964.
[3] Wang X L, Wei J L, Huang L L, et al. Re-evaluation of pathogens causing Valsa canker on apple in China[J].Mycologia, 2011, 103(2): 317-324.
[4] Meng X L, Yang R, Liu A T, et al. The influence of lower temperature induction of Valsa mali on the infection of apple trees[J].Plant Disease, 2021, 105(10): 2776-2780.
[5] Wang X L, Shi C M, Gleason M L, et al. Fungal species associated with apple Valsa canker in East Asia[J].Phytopathology Research, 2020, 2(1): 35.
[6] Compant S, Duffy B, Nowak J, et al. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects[J].Applied and Environmental Microbiology, 2005, 71(9): 4951-4959.
[7] Raaijmakers J M, Vlami M, de Souza J T. Antibiotic production by bacterial biocontrol agents[J].Antonie Van Leeuwenhoek, 2002, 81(1/2/3/4): 537-547.
[8] Morath S U, Hung R, Bennett J W. Fungal volatile organic compounds: a review with emphasis on their biotechnological potential[J].Fungal Biology Reviews, 2012, 26(2/3): 73-83.
[9] 鐘濤, 王智榮, 杜木英. 微生物源揮發性物質防治采后果蔬病害的研究進展[J].微生物學報, 2021, 61(7): 1771-1785.
ZHONG Tao, WANG Zhirong, DU Muying. Control of postharvest fruits and vegetables diseases by microbial volatile compounds[J].Acta Microbiologica Sinica, 2021, 61(7): 1771-1785.
[10] 黃偉, 張麗娟, 王寧, 等. 芽孢桿菌屬揮發性物質及其在植物病害防治中的應用研究進展[J].中國植保導刊, 2021, 41(9): 30-36.
HUANG Wei, ZHANG Lijuan, WANG Ning, et al. Research progress and application of Bacillus spp. volatile organic compounds in plant disease control[J].China Plant Protection, 2021, 41(9): 30-36.
[11] Mcain A H. A volatile antibiotic produced by Streptomyces griseus[J].Phytopathology, 1966, 56(2): 150.
[12] Fiddaman P J, Rossall S. The production of antifungal volatiles by Bacillus subtilis[J].The Journal of Applied Bacteriology, 1993, 74(2): 119-126.
[13] Raza W, Wang J C, Wu Y C, et al. Effects of volatile organic compounds produced by Bacillus amyloliquefaciens on the growth and virulence traits of tomato bacterial wilt pathogen Ralstonia solanacearum[J].Applied Microbiology and Biotechnology, 2016, 100(17): 7639-7650.
[14] Sapers G M, Gorny J R, Yousef A E. 果蔬微生物學[M].陳衛, 田豐偉, 譯. 北京: 中國輕工業出版社, 2011: 58-65.
Sapers G M, Gorny J R, Yousef A E. Microbiology of fruits and vegetables translated by CHEN Wei, TIAN Fengwei [M].Beijing: China Light Industry Press, 2011:58-65.
[15] 王寧, 黃偉, 魯致遠, 等. 蘋果樹腐爛病生防鏈霉菌A144的鑒定及其代謝產物的抑菌活性[J].西北農業學報, 2023, 32(3): 440-449.
WANG Ning, HUANG Wei, LU Zhiyuan, et al. Identification of biocontrol Streptomyces A144 against apple tree Valsa cancer and antifungal activity of its metabolites[J].Acta Agriculturae Boreali-occidentalis Sinica, 2023, 32(3): 440-449.
[16] 黃偉, 王寧, 劉峰娟, 等. 產香真菌M6-5的鑒定及其揮發性物質對庫爾勒香梨果實采后黑斑病的抑制效果[J].食品科學, 2022, 43(22): 199-206.
HUANG Wei, WANG Ning, LIU Fengjuan, et al. Identification of aroma-producing fungal strain M6-5 and inhibitory effect of volatile substances from it on postharvest black spot of Korla fragrant pear[J].Food Science, 2022, 43(22): 199-206.
[17] Murungi L K, Kirwa H, Coyne D, et al. Identification of key root volatiles signaling preference of tomato over spinach by the root knot nematode Meloidogyne incognita[J].Journal of Agricultural and Food Chemistry, 2018, 66(28): 7328-7336.
[18] Estupi?an-López L, Campos V P, da Silva Júnior J C, et al. Volatile compounds produced by Fusarium spp. isolated from Meloidogyne paranaensis egg masses and corticous root tissues from coffee crops are toxic to Meloidogyne incognita[J].Tropical Plant Pathology, 2018, 43(3): 183-193.
[19] Zhai Y L, Shao Z Z, Cai M M, et al. Multiple modes of nematode control by volatiles of Pseudomonas putida 1A00316 from Antarctic soil against Meloidogyne incognita[J].Frontiers in Microbiology, 2018, 9: 253.
[20] Ye L, Wang J Y, Liu X F, et al. Nematicidal activity of volatile organic compounds produced by Bacillus altitudinis AMCC 1040 against Meloidogyne incognita[J].Archives of Microbiology, 2022, 204(8): 521.
[21] 吳云成. 拮抗油菜菌核病的功能菌篩選與作用機制研究[D].南京: 南京農業大學, 2016: 65-68.
WU Yuncheng. Isolation and Antagonisitic Mechanism Investigation of Biocontrol Agents Against Sclerotinia Stem Rot of Canola[D].Nanjing: Nanjing Agricultural University, 2016: 65-68.
[22] Li Q L, Ning P, Zheng L, et al. Fumigant activity of volatiles of Streptomyces globisporus JK-1 against Penicillium italicum on Citrus microcarpa[J].Postharvest Biology and Technology, 2010, 58(2): 157-165.
[23] 李其利. 鏈霉菌JK-1的鑒定及其防病潛能和防病機制的研究[D].武漢: 華中農業大學, 2011: 105-111.
LI Qili. Identification, Biocontrol Potential and Mode of Action of Streptomyces JK-1[D].Wuhan: Huazhong Agricultural University, 2011: 105-111.
[24] 王小姣. Streptomyces albospinus CT205誘變育種及在芹菜根腐病防控中的應用[D].南京: 南京農業大學, 2020: 34-35.
WANG Xiaojiao. Mutation Breeding of Streptomyces Albospinus CT205 and the Application in Preventing Celery Root Rot[D].Nanjing: Nanjing Agricultural University, 2020: 34-35.
[25] 李其利, 郭堂勛, 黃穗萍, 等. 細菌產生的揮發性物質及其生物學功能[J].微生物學雜志, 2012, 32(5): 74-82.
LI Qili, GUO Tangxun, HUANG Suiping, et al. Volatile substances produced by bacteria and their biological functions[J].Journal of Microbiology, 2012, 32(5): 74-82.
[26] 張春慧. 鏈霉菌TD-1產揮發性物質抑制番茄灰霉病菌的研究[D].天津: 天津科技大學, 2015: 24.
ZHANG Chunhui. Study on the Inhibiting of Volatiles Produced by Streptomyces Alboflavus TD-1 on Botrytis Cinerea[D].Tianjin: Tianjin University of Science amp; Technology, 2015: 24.
[27] Wilkins K, Sch?ller C. Volatile organic metabolites from selected Streptomyces strains[J].Actinomycetologica, 2009, 23(2): 27-33.
[28] 呂昂. 鏈霉菌3-10抗真菌代謝產物鑒定及防病潛力評估[D].武漢: 華中農業大學, 2017: 111-118.
LYU Ang. Identification of the Antifungal Metabolites from Streptomyces sp.3-10 and Evaluation of Their Efficacy against Plant Fungal Diseases[D].Wuhan: Huazhong Agricultural University, 2017: 111-118.
[29] Sun M, Duan Y X, Liu J P, et al. Efficacy of dimethyl trisulfide on the suppression of ring rot disease caused by Botryosphaeria dothidea and induction of defense-related genes on apple fruits[J].Frontiers in Microbiology, 2022, 13: 796167.
[30] 唐利華, 郭堂勛, 黃穗萍, 等. 二甲基三硫醚對杧果膠孢炭疽菌的抑制作用及機理研究[C]//中國植物病理學會2017年學術年會論文集. 泰安, 2017: 427.
TANG Lihua, GUO Tangxun, HUANG Suiping, et al. Study on inhibition and mechanism of dimethyl trithioether against P. indica [C]//Proceedings of 2017 Annual Conference of Chinese Plant Pathology Society, Taian, 2017: 427.
[31] Qin Y L, Zhang S B, Lv Y Y, et al. The antifungal mechanisms of plant volatile compound 1-octanol against Aspergillus flavus growth[J].Applied Microbiology and Biotechnology, 2022, 106(13/14/15/16): 5179-5196.
[32] Romero-Cortes T, Pérez Espa?a V H, López Pérez P A, et al. Antifungal activity of vanilla juice and vanillin against Alternaria alternata[J].CyTA-Journal of Food, 2019, 17(1): 375-383.
[33] Yang J F, Yang C H, Liang M T, et al. Chemical composition,Antioxi-dant,and antibacterial activity of wood vinegar from Litchi chenensis[J].Molecules,2016,21(9): 1150.
[34] Qadri M, Deshidi R, Ali Shah B, et al. An endophyte of Picrorhiza kurroa Royle ex. Benth, producing menthol, phenylethyl alcohol and 3-hydroxypropionic acid, and other volatile organic compounds[J].World Journal of Microbiology and Biotechnology, 2015, 31(10): 1647-1654.
[35] 陳利軍, 王國君, 田雪亮, 等. 產香真菌ZY-2菌株鑒定及其揮發性物質抑菌活性測定與組分分析[J].南方農業學報, 2013, 44(11): 1818-1822.
CHEN Lijun, WANG Guojun, TIAN Xueliang, et al. Identification of an aroma-producing fungus ZY-2 and its analysis on antifungal activity and chemical component of volatile compounds[J].Journal of Southern Agriculture, 2013, 44(11): 1818-1822.
[36] 孫敏. 白刺鏈霉菌(Streptomyces albospinus)CT205次生代謝活性物質的結構鑒定及對尖孢鐮刀菌的抑制作用[D].南京: 南京農業大學, 2019: 43.
SUN Min. Strctural Identification of Secindary Metabolically Active Substance of Streptomyces Albosponus CT205 and Its Antagonistic Effect Against Fusarium Oxysporum[D].Nanjing: Nanjing Agricultural University, 2019: 43.
[37] CN202210019112.6.揮發性物質在防治番茄頸腐根腐病中的應用[P].
CN202210019112.6.Application of volatile substances in the control of tomato neck rot root rot [P].
[38] Papazlatani C, Rousidou C, Katsoula A, et al. Assessment of the impact of the fumigant dimethyl disulfide on the dynamics of major fungal plant pathogens in greenhouse soils[J].European Journal of Plant Pathology, 2016, 146(2): 391-400.
[39] 宮安東, 董飛燕, 吳楠楠, 等. 吡咯伯克霍爾德菌WY6-5產二甲基二硫對儲藏期花生黃曲霉及毒素的抑制作用[J].中國農業科學, 2019, 52(17): 2972-2982.
GONG Andong, DONG Feiyan, WU Nannan, et al. Inhibitory effect of dimethyl disulfide from Burkholderia pyrrocinia WY6-5 on Aspergillus flavus and aflatoxins in peanuts during storage period[J].Scientia Agricultura Sinica, 2019, 52(17): 2972-2982.
[40] 李寶慶, 張曉云, 郭慶港, 等. 枯草芽孢桿菌CAB-1產揮發性物質對病原菌及植物的作用[C]//中國植物病理學會2011年學術年會論文集. 宜昌, 2011: 553.
LI Baoqing, ZHANG Xiaoyun, GUO Qinggang, et al. Effects of volatile substances produced by Bacillus subtilis CAB-1 on pathogenic bacteria and plants[C]//Proceedings of the 2011 Annual Conference of Chinese Society of Plant Pathology. Yichang, 2011: 553.
Inhibitory effect of different phases of Streptomyces rochei A144 volatile substances on Valsa mali var.mali
HUANG Wei1, WANG Ning1, SONG Bo2, WANG Suling1,QIN Xinzheng1, SONG Suqin1, LUO Yi1, WEI Zengzhou1, ZHANG Lijuan1,3, WANG Wei1
(1. Xinjiang Laboratory of Special Environmental Microbiology/Institute of Applied Microbiology, Xinjiang Academy of Agricultural Sciences, Urumqi 830091,China; 2. Institute of Plant Protection, Xinjiang Academy of Agricultural Sciences, Urumqi 830091,China; 3.College of Grassland Science, Xinjiang Agricultural University, Urumqi 830052,China)
Abstract:【Objective】 To investigate the inhibitory effect of volatile substances produced by Streptomyces rochei A144 on Valsa mali under different phases, and to detect and determine the volatile substance with antifungal activity in vitro. 【Methods】 The inhibitory effect of volatile substances of Streptomyces rochei A144 on apple tree rot at different growth stages (0, 10, 20, 25 and 30 d) was determined by plate coupling method, and the content of volatile substances was detected by headspace solid phase microextraction and gas chromatography-tandem mass spectrometry. After that, the volatile substances with good antibacterial activity under liquid and gas treatment were obtained by plate and coating method, respectively. 【Results】 When the growth time was 20 days, the inhibition rate of volatile substances produced by strain A144 was 100%. Strain A144 produced 63 volatile substances after 20 days of growth. When the concentration was 62.50 μL/L, the gas fumigation treatment of guaiacol, 1-octanol and dimethyl trisulfide could still completely inhibit the growth of apple tree rot. After diluting the original solution by 8 times, the liquid treatment of 1-octanol and dimethyl trisulfide with volume fraction of 12.5% could still completely inhibit the growth of apple tree rot. 【Conclusion】 The volatile substances 1-octanol and dimethyl trisulfide have the ability to significantly inhibit the pathogen of apple tree rot, and have the potential to be an important pesticide source of anti-apple tree rot.
Key words:Streptomyces rochei; growth time; volatile substances; Valsa mali
Fund projects:The Open Project of Key Laboratory of Xinjiang Uygur Autonomous Region (2020D04032); Youth the Fund Project of Xinjiang Uygur Autonomous Region (2022D01B172); Innovation Ability Training Project for Young Sci-Tech Backbone Talents Sponsored by Xinjiang Academy of Agricultural Sciences (xjnkq-2023015 and xjnkq-2023013)
Correspondence author: ZHANG Lijuan (1986-), female, from Shandong, associate researcher, research direction: microbial resources, (E-mail)532172011@qq.com
WANG Wei(1973-),female, from Xinjiang, researcher, research direction: microbial resources, (E-mail) mypony926@163.com

