豬CREBRF 基因生物信息學(xué)和表達(dá)規(guī)律分析

摘要:CREBRF 基因在雌性動物生殖過程中具有重要調(diào)控作用,為了深入了解豬的CREBRF 基因特征和功能,對CREBRF 基因進(jìn)行生物信息學(xué)分析,并通過RT-qPCR分析不同階段巴馬豬卵巢組織中CREBRF 的表達(dá)規(guī)律。結(jié)果顯示,在5個品種豬基因組上鑒定到20個CREBRF 基因的堿基突變,其中7個為同義突變,13個為錯義突變。豬CREBRF 基因的CDS區(qū)全長1 920 bp,共編碼639個氨基酸,不穩(wěn)定系數(shù)較高,為親水性蛋白,有85個高置信度的磷酸化位點(diǎn)和4個糖基化位點(diǎn),且CREBRF 的mRNA具有20個高可信度的m6A甲基化修飾位點(diǎn),豬、人和小鼠中的CREBRF蛋白保守性較強(qiáng)。RT-qPCR結(jié)果顯示,豬卵巢中CREBRF 基因的表達(dá)量在豬出生0 和28 d 時表達(dá)水平較高,隨著豬生長發(fā)育,在出生180 d 時表達(dá)量顯著降低,在母豬妊娠38 和80 d 時CREBRF 的表達(dá)再次升高。通過比對不同品種豬中CREBRF 基因CDS區(qū)的堿基突變并分析該基因的理化性質(zhì)及表達(dá)規(guī)律,發(fā)現(xiàn)了CREBRF 基因在豬胎兒期、出生早期和妊娠期卵巢組織中的高表達(dá),推測CREBRF 在母豬生殖過程中起重要作用,為豬高繁殖力基因挖掘和分子標(biāo)記開發(fā)提供參考。
關(guān)鍵詞:豬;卵巢;CREBRF;生物信息學(xué)分析;基因表達(dá)
doi:10.13304/j.nykjdb.2024.0154
中圖分類號:S828 文獻(xiàn)標(biāo)志碼:A 文章編號:1008‐0864(2024)09‐0044‐10
雌性動物的繁殖性狀直接影響著畜牧業(yè)的生產(chǎn)效率和經(jīng)濟(jì)效益,近年來對雌性動物繁殖性狀的研究主要集中于生殖生理調(diào)控、營養(yǎng)管理與疾病控制、遺傳改良與選擇育種及生殖技術(shù)應(yīng)用等方面,以提高種畜的繁殖能力和生產(chǎn)效率。豬是重要的畜牧動物之一,在農(nóng)業(yè)經(jīng)濟(jì)中扮演著重要角色,豬的繁殖性能直接影響了養(yǎng)殖業(yè)的發(fā)展和效益。對豬繁殖性狀候選基因的研究有助于揭示其對豬繁殖性能的影響,為改良豬的繁殖性狀提供理論依據(jù)和技術(shù)支持,對提高豬的生產(chǎn)效率、加快豬的遺傳改良進(jìn)程具有重要意義[1]。
CREBRF (CREB3 regulatory factor, CREBRF)是Luman/CREB3 蛋白(cAMP responsive elementbinding protein 3,CREB3)的調(diào)節(jié)因子,又稱Luman/CREB3 募集因子[2]。Luman/CREB3 是一種內(nèi)質(zhì)網(wǎng)膜結(jié)合轉(zhuǎn)錄因子,在內(nèi)質(zhì)網(wǎng)應(yīng)激(endoplasmic reticulum stress,ERS)過程中,CREB3參與調(diào)節(jié)膜內(nèi)蛋白水解和核小體轉(zhuǎn)位,激活下游基因,CREBRF蛋白與CREB3在核內(nèi)相互作用并結(jié)合以促進(jìn)CREB3的降解[2]。CREBRF 基因在雌性動物的繁殖中發(fā)揮著非常重要的作用。張麗萌等[3]研究表明,CREBRF 基因在綿羊各組織中均表達(dá),其中腎臟、心臟和卵巢中的表達(dá)水平較高。CREBRF 的敲低會顯著抑制雌性動物子宮內(nèi)膜的功能[4],此外,CREBRF 在ERS誘導(dǎo)的小鼠顆粒細(xì)胞凋亡中也具有重要作用[5],其可通過調(diào)節(jié)小鼠子宮基質(zhì)細(xì)胞的增殖來調(diào)節(jié)妊娠期間的蛻膜化[6]。楊延周等[7]研究了CREBRF 在雌性小鼠發(fā)情周期中的表達(dá)變化規(guī)律,發(fā)現(xiàn)CREBRF 與卵母細(xì)胞的生長、發(fā)育、成熟及排卵等過程息息相關(guān),同時CREBRF 可能參與胚胎發(fā)育及附植并介導(dǎo)ERS通路參與調(diào)節(jié)卵巢顆粒細(xì)胞的凋亡,并受到雌激素、孕激素的調(diào)節(jié)。在基因敲除小鼠中發(fā)現(xiàn)CREBRF缺失的小鼠糖皮質(zhì)激素信號傳導(dǎo)受到影響,母系行為有嚴(yán)重缺陷,不愿照顧幼崽[8]。
上述研究表明,CREBRF 基因在雌性動物生殖生理調(diào)控及卵巢發(fā)育過程中有著不可或缺的作用。目前關(guān)于該基因的研究主要集中于人和小鼠,但對豬的研究較少。本課題組前期研究中發(fā)現(xiàn),豬CREBRF 基因在不同組織中均有表達(dá),且在卵巢、子宮以及輸卵管等組織中表達(dá)水平較高。因此,本研究克隆了不同品種豬CREBRF 基因的CDS區(qū)并進(jìn)行序列比對,對該蛋白進(jìn)行生物信息學(xué)分析,并進(jìn)一步探討了CREBRF 在不同階段豬卵巢中的表達(dá)規(guī)律,為后續(xù)進(jìn)一步探索CREBRF基因?qū)ωi繁殖性能的調(diào)控機(jī)制奠定基礎(chǔ)。
1 材料與方法
1.1 試驗(yàn)材料
本試驗(yàn)組織樣品為不同品種180日齡母豬的卵巢組織,采自山東日照豬場,包括巴馬豬、梅山豬、松遼豬、大白豬和長白豬。CREBRF 基因在豬不同發(fā)育時期的表達(dá)量檢測選用巴馬豬的卵巢組織,包括胚胎期80 d 的雌性胎豬、出生后0、28、180 d和妊娠38和80 d母豬的卵巢組織。
1.2 主要儀器與試劑
無酶無菌水(R1600-10),北京索萊寶科技有限公司;2×Phanta Max Master Mix 高保真酶(P515)、RNA Isolater Total RNA Extraction Reagent傳統(tǒng)總RNA提取試劑(R401-01)、HiScript Ⅲ Allin-one RT SuperMix Perfect for qPCR(R333)、ChamQ Universal SYBR qPCR Master Mix(Q711),南京諾唯贊生物科技股份有限公司;瓊脂糖凝膠DNA回收試劑盒(DR0101050),浙江易思得生物科技有限公司;引物由上海生工生物工程有限公司合成。
組織勻漿儀(PreceIIys 24),Bertin Technologies(法國);研磨珠(120030C),Welab;離心機(jī)(Micro17R),Thermo Scientific;PCR 儀(C1000Touch?)、電泳儀(PowerPac HV)、凝膠成像系統(tǒng)(Universal HoodⅡ),上海伯樂生命醫(yī)學(xué)產(chǎn)品有限公司;分光光度計(jì)(Nano-100),杭州奧盛儀器有限公司;實(shí)時熒光定量PCR 儀(QuantStudio 3),Applied Biosystems。
1.3 組織RNA 提取及反轉(zhuǎn)錄
使用傳統(tǒng)Trizol法提取豬卵巢組織的RNA[9],使用分光光度計(jì)檢測RNA的純度與含量,檢測合格后按照反轉(zhuǎn)錄試劑盒的操作方法取1 μg RNA反轉(zhuǎn)錄為cDNA,存放于-20 ℃冰箱備用,剩余RNA存放于-80 ℃冰箱備用。
1.4 引物設(shè)計(jì)與合成
在NCBI 網(wǎng)站上獲得家豬CREBRF 基因的CDS 區(qū)序列(登錄號:XM_013990647.2),使用SnapGene 軟件和NCBI-Blast設(shè)計(jì)特異性引物(表1),由上海生工生物工程有限公司合成。
1.5 豬CREBRF 基因克隆與測序
使用豬卵巢組織的cDNA為模板進(jìn)行PCR擴(kuò)增,PCR 反應(yīng)體系40 μL:2 × Phanta Max MasterMix 20 μL,上、下游引物各 1 μL,無菌水16 μL,cDNA 2 μL。反應(yīng)條件:95 ℃預(yù)變性3 min;95 ℃變性15 s,56 ℃退火30 s,72 ℃延伸30 s,35次循環(huán);72 ℃修復(fù)延伸5 min。使用膠回收試劑盒回收產(chǎn)物并交由上海生工生物工程有限公司進(jìn)行一代測序。
1.6 生物信息學(xué)分析
在NCBI 上下載豬CREBR 蛋白的氨基酸序列,通過在線工具Expasy-ProtParam(https://web.expasy. org/protparam/)分析其理化性質(zhì);使用Expasy-ProtScale(https://web.expasy.org/protscale/)在線工具分析親/疏水性;使用WOLF PSORT(https://wolfpsort.hgc.jp/)進(jìn)行亞細(xì)胞定位;使用NetNGlyc(https://services.healthtech.dtu.dk/services/NetNGlyc-1.0/)進(jìn)行糖基化位點(diǎn)分析;NetPhos3.1(https://services.healthtech.dtu.dk/services/NetPhos-3.1/)進(jìn)行磷酸化位點(diǎn)分析;使用SRAMP(https://www.cuilab.cn/sramp)進(jìn)行m6A 甲基化位點(diǎn)預(yù)測;在NCBI上下載豬(登錄號:XP_005657688.1)、人(登錄號:NP_705835.2)、小鼠(登錄號:NP_084146.1)的氨基酸序列,用ClustalW進(jìn)行多序列比對,用ESPript 3.0對結(jié)果進(jìn)行可視化分析。蛋白質(zhì)二級結(jié)構(gòu)使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在線工具進(jìn)行分析預(yù)測。
1.7 基因相對表達(dá)量檢測和分析
以不同發(fā)育時期豬卵巢組織的cDNA 為模板,通過RT-qPCR測定豬CREBRF 基因的相對表達(dá)量,使用β-ACTIN 作為內(nèi)參,每組設(shè)置3個生物學(xué)重復(fù)。RT-qPCR 反應(yīng)體系15 μL:2 × ChamQUniversal SYBR qPCR Master Mix 7.5 μL,CREBRF-F/R各0.3 μL,無菌水16 μL,cDNA 1 μL。反應(yīng)程序:95 ℃預(yù)變性30 s;95 ℃變性5 s,60 ℃退火34 s,40 次循環(huán);95 ℃ 15 s ,60 ℃延伸1 min,95 ℃退火1 s。結(jié)果采用2-△△CT法[10]計(jì)算基因的相對表達(dá)量。
1.8 統(tǒng)計(jì)分析
試驗(yàn)結(jié)果使用GraphPad prism進(jìn)行統(tǒng)計(jì)學(xué)分析,用One-Way ANOVA 方差分析進(jìn)行顯著性分析,數(shù)據(jù)結(jié)果采用平均值±標(biāo)準(zhǔn)差表示,Plt;0.05表示差異顯著,Pgt;0.05表示差異不顯著。
2 結(jié)果與分析
2.1 豬CREBRF 基因的擴(kuò)增及測序
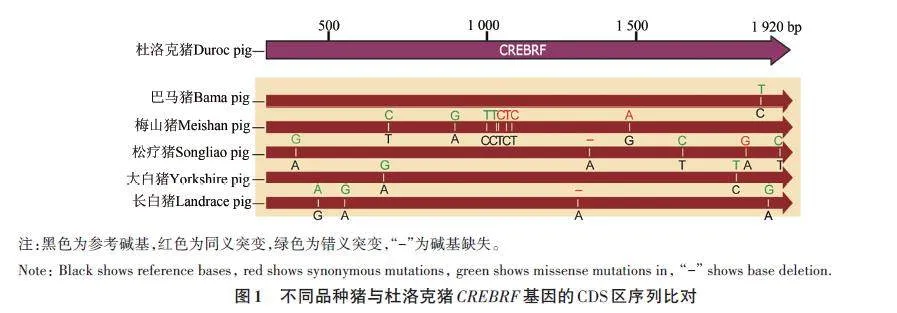
選取巴馬豬、梅山豬、松遼豬、大白豬和長白豬的卵巢組織cDNA為模板,通過PCR擴(kuò)增得到豬CREBRF 基因的CDS 區(qū)。對PCR 純化產(chǎn)物進(jìn)行測序,比對后發(fā)現(xiàn)(圖1),巴馬豬CREBRF 的CDS區(qū)與參考基因組(杜洛克豬)相比存在1個突變位點(diǎn),為錯義突變;梅山豬的CDS區(qū)存在8個突變位點(diǎn),其中有4個同義突變,4個錯義突變;松遼豬的CDS區(qū)存在1個堿基缺失和4個堿基突變,其中有2 個同義突變,3 個錯義突變;大白豬的CDS區(qū)存在2個突變位點(diǎn),均為錯義突變;長白豬的CDS區(qū)存在1個堿基缺失,3個堿基突變,其中有1個同義突變,3個錯義突變,這些突變表明不同品種豬之間CREBRF 基因編碼區(qū)序列存在堿基突變,不同品種間存在的基因序列差異可能是導(dǎo)致該基因在品種間基因表達(dá)和功能差異的原因。
2.2 CREBRF 蛋白理化性質(zhì)分析
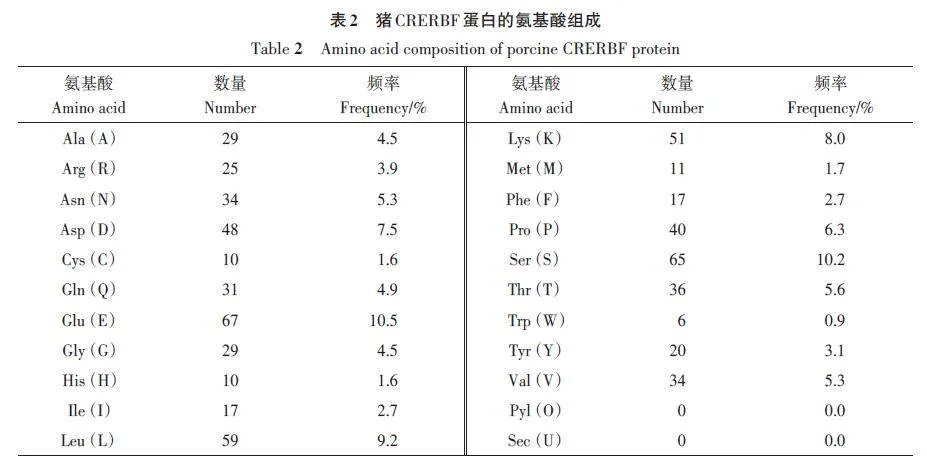
利用ProtParam 在線軟件預(yù)測豬CREBRF 蛋白理化性質(zhì),CREBRF蛋白含有639個氨基酸,在氨基酸組分中谷氨酸(Glu)含量最多(10.5%),色氨酸(Trp)含量最低(0.9%)(表2)。CREBRF的蛋白分子式為C3 128H4 918N856O1 056S21,原子總數(shù)9 979,相對分子質(zhì)量72 085.82 Da,理論等電點(diǎn)(pI)4.77。CREBRF 蛋白帶正電荷殘基總數(shù)量(賴氨酸和精氨酸)為76個,負(fù)電荷氨基酸殘基的數(shù)量(天冬氨酸和谷氨酸)為115 個。體外半衰期為30 h,不穩(wěn)定系數(shù)為53.574(lt;40為穩(wěn)定,≥40為不穩(wěn)定),因此CRERBF蛋白為不穩(wěn)定蛋白,容易發(fā)生結(jié)構(gòu)變化或失去功能,易降解。
2.3 CREBRF 蛋白親/疏水性預(yù)測
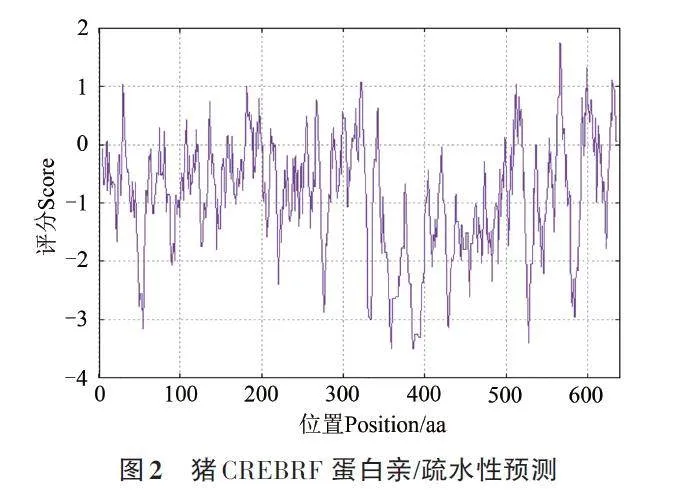
使用Protscale工具分析CREBRF蛋白的親疏水性,分值(score)大于0表示氨基酸在蛋白質(zhì)結(jié)構(gòu)中更偏向疏水性,這些氨基酸往往會在蛋白質(zhì)的內(nèi)部區(qū)域聚集,形成蛋白質(zhì)的核心結(jié)構(gòu),也稱為疏水核心,如苯丙氨酸、亮氨酸、纈氨酸、異亮氨酸、蘇氨酸等。分值小于0則表示氨基酸在蛋白質(zhì)結(jié)構(gòu)中更偏向親水性,如谷氨酸、天冬氨酸、賴氨酸、精氨酸、組氨酸等。這些氨基酸主要位于蛋白質(zhì)的表面區(qū)域,與周圍的水分子相互作用,通過這些親水性氨基酸,蛋白質(zhì)能夠與其他分子進(jìn)行相互作用。由圖2可知,CREBRF 蛋白氨基酸殘基大多數(shù)在親水區(qū),其中親水性最大值為359、328、386和387位的谷氨酰胺,分值為-3.500,疏水性最大值為566位的氨基酸,分值為1.756,表明CREBRF為親水性蛋白。
2.4 CREBRF 蛋白磷酸化位點(diǎn)、糖基化位點(diǎn)和m6A 甲基化位點(diǎn)預(yù)測
磷酸化、糖基化和甲基化是3種常見的生物分子修飾形式,它們對生物分子的功能和相互作用產(chǎn)生重要影響。磷酸化可以改變蛋白質(zhì)的結(jié)構(gòu)和活性,調(diào)節(jié)細(xì)胞信號傳導(dǎo)和代謝途徑;糖基化可以影響蛋白質(zhì)的穩(wěn)定性和功能,參與細(xì)胞黏附和信號轉(zhuǎn)導(dǎo);甲基化在基因表達(dá)調(diào)控中起著重要作用,影響DNA的可讀性和轉(zhuǎn)錄過程。
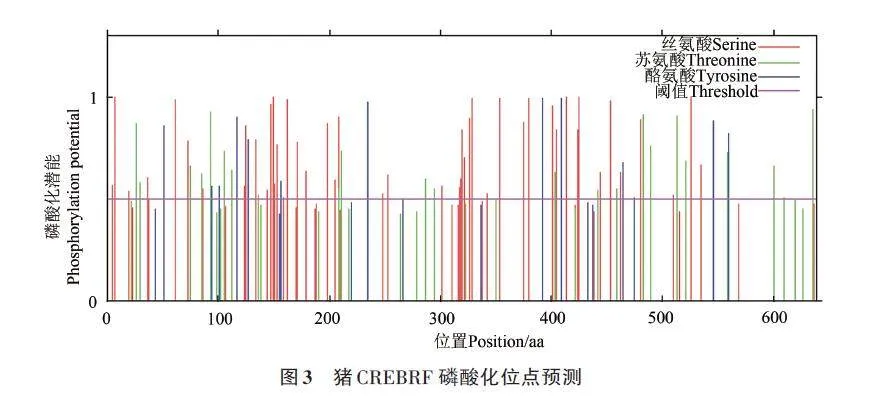
使用在線工具NetPhos3.1預(yù)測CREBRF蛋白潛在的磷酸化位點(diǎn),磷酸化潛能大于0.5表明該位點(diǎn)是潛在的磷酸化位點(diǎn)。結(jié)果顯示,CREBRF蛋白存在85 個潛在的磷酸化位點(diǎn),其中絲氨酸(serine)磷酸化位點(diǎn)有49個,蘇氨酸(threonine)磷酸化位點(diǎn)有23個,酪氨酸(tyrosine)磷酸化位點(diǎn)有13個(圖3),提示CREBRF可能具有復(fù)雜的調(diào)控機(jī)制和功能,而該蛋白可以在不同的時間點(diǎn)、不同的細(xì)胞環(huán)境下被磷酸化,以實(shí)現(xiàn)其復(fù)雜的功能調(diào)控。
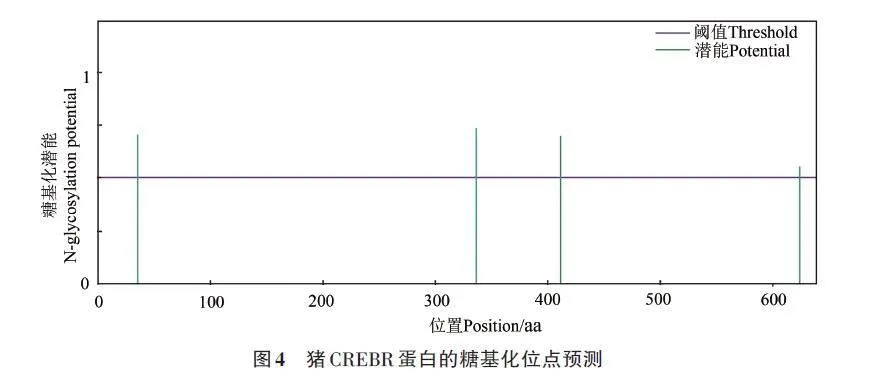
使用在線工具NetNGlyc預(yù)測CREBRF蛋白的糖基化位點(diǎn),糖基化潛能大于0.5為陽性,縱坐標(biāo)的數(shù)值越高,代表該氨基酸位置越可能是個糖基化位點(diǎn)。結(jié)果顯示,CREBRF共存在4個糖基化位點(diǎn),分別為第35位的NSSD(N-糖基化勢能0.699 9)、第336位的NYSL(N-糖基化勢能0.730 1)、第411位的NDSV(N-糖基化勢能0.694 8)和第624 的NPTG(N-糖基化勢能0.551 2)(圖4),這些高置信度的糖基化位點(diǎn)可能參與調(diào)控蛋白質(zhì)的活性或信號轉(zhuǎn)導(dǎo)途徑,可能對蛋白質(zhì)的功能具有關(guān)鍵影響。
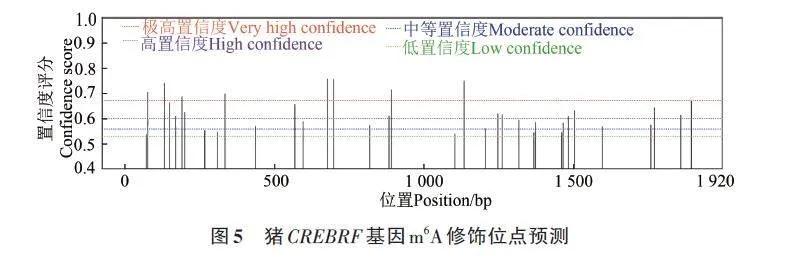
通過SRAMP 網(wǎng)站對CREBRF 基因的CDS區(qū)的N6-甲基腺苷(m6A)修飾位點(diǎn)進(jìn)行預(yù)測。結(jié)果顯示,CREBRF 基因CDS區(qū)存在8個極高置信度的位點(diǎn)(very high confidence),12 個高置信度的位點(diǎn)(high confidence)(圖5),因此認(rèn)為其CDS區(qū)存在m6A修飾。
2.5 豬、人和小鼠CREBRF 氨基酸序列比對
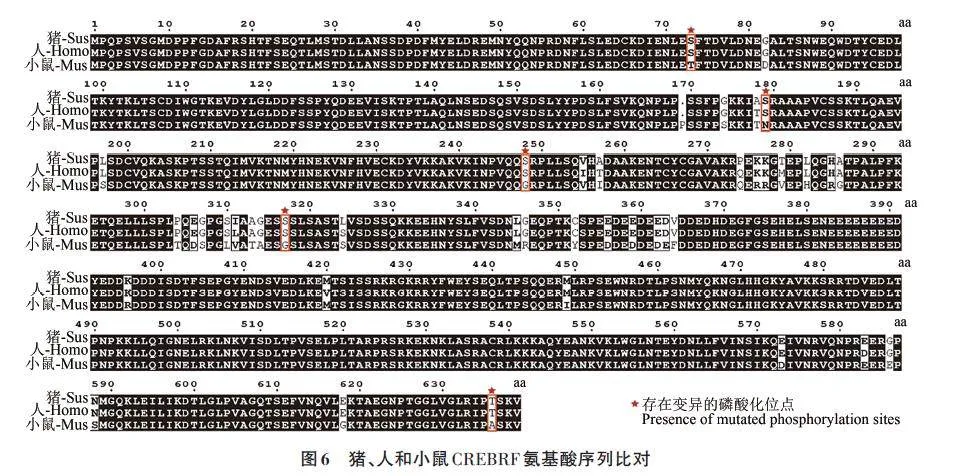
小鼠是最常用的實(shí)驗(yàn)動物之一,其基因組與人類有很高的相似性,繁殖周期較短且維護(hù)成本相對低廉,因此常被用于研究遺傳學(xué)、免疫學(xué)、藥理學(xué)、腫瘤學(xué)等領(lǐng)域[11]。而豬作為大型哺乳動物,其生理結(jié)構(gòu)和代謝特征更接近人類,被廣泛用于心血管病學(xué)、外科手術(shù)模型以及藥物安全性評價等研究領(lǐng)域[12]。將豬、人和小鼠CREBRF的氨基酸序列進(jìn)行比對。由圖6 可見,豬、人和小鼠CREBRF的氨基酸序列保守性較強(qiáng),豬和人的序列相似性為98.59%,小鼠和人的序列相似性為93.74%。同時,通過將差異氨基酸與CREBRF蛋白的化學(xué)修飾位點(diǎn)比對發(fā)現(xiàn),在第73、第179、第248、第317 和第636 位氨基酸處,CREBRF 蛋白的磷酸化位點(diǎn)在豬和人中保持一致,在小鼠中發(fā)生變異,這些磷酸化位點(diǎn)的差異可能影響CREBRF 蛋白的磷酸化修飾及其調(diào)控的基因表達(dá)模式。
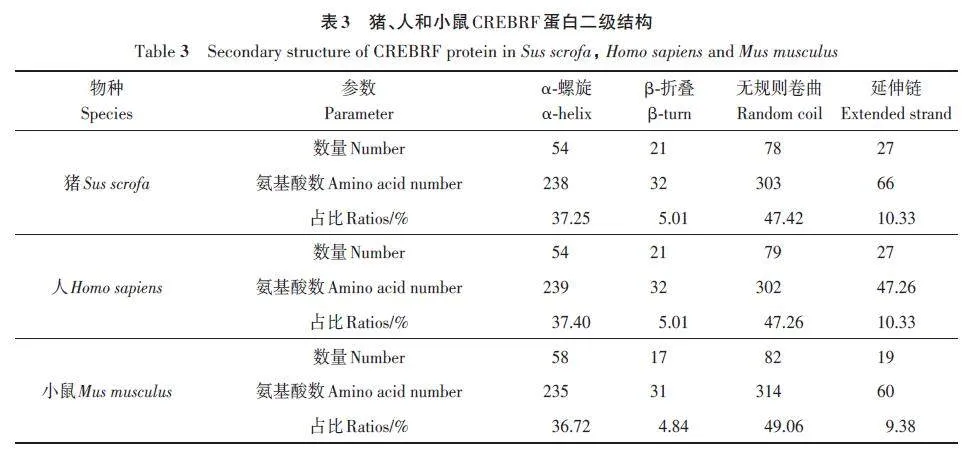
2.6 豬、人和小鼠CREBRF 二級結(jié)構(gòu)比對
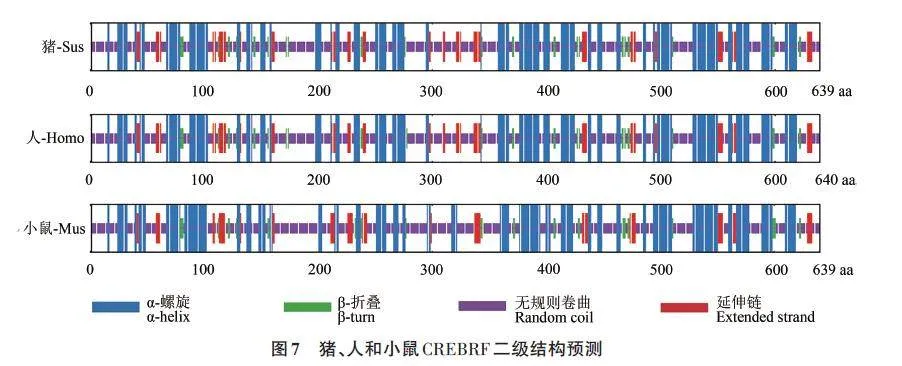
基于氨基酸序列的比對結(jié)果,對豬、人和小鼠CREBRF蛋白進(jìn)行二級結(jié)構(gòu)預(yù)測,根據(jù)預(yù)測結(jié)果(圖7),在豬、人和小鼠這3種物種CREBRF蛋白的二級結(jié)構(gòu)分布略有不同。
豬和人CREBRF 蛋白中的α-螺旋結(jié)構(gòu)均有54個,β-折疊結(jié)構(gòu)均有21個,但小鼠CREBRF蛋白中α-螺旋結(jié)構(gòu)有58 個,β-折疊結(jié)構(gòu)有17 個,同時,在豬和人的CREBRF 蛋白中,無規(guī)則卷曲結(jié)構(gòu)個數(shù)接近,分別為78和79個,而在小鼠中無規(guī)卷曲結(jié)構(gòu)個數(shù)為82 個(表3)。綜上所述,CREBRF 蛋白的二級結(jié)構(gòu)顯示豬和人CREBRF蛋白結(jié)構(gòu)更加相近,提示豬可以更好地作為人的研究模型。
2.7 CREBRF 在不同階段豬卵巢組織的表達(dá)水平差異
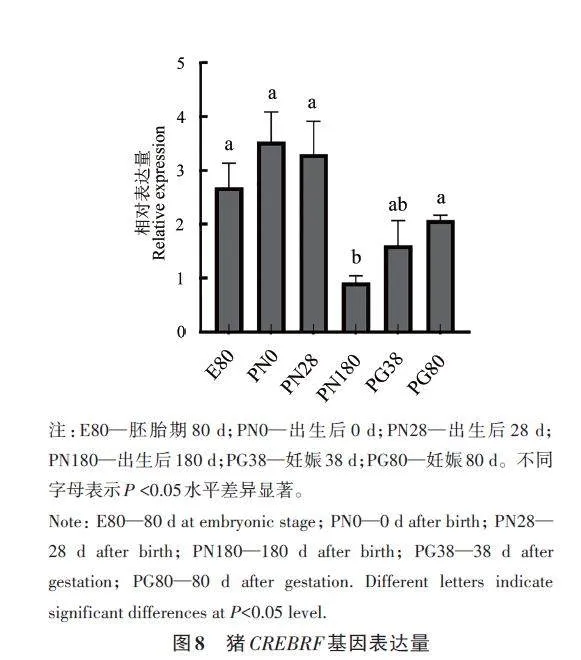
通過RT-qPCR對胚胎期80 d的胎豬,出生后0、28 和180 d 及妊娠38 d 及妊娠80 d 母豬卵巢組織中CREBRF 基因的表達(dá)量進(jìn)行分析,結(jié)果(圖8)表明,CREBRF 基因的表達(dá)量在仔豬出生第0天時最高,隨著豬生長發(fā)育,在出生180 d時表達(dá)量最低,在妊娠母豬和胎豬的卵巢中表達(dá)量顯著上升。CREBRF 基因在豬胎兒期、出生早期和妊娠期卵巢組織中的高表達(dá)提示其在豬的生殖系統(tǒng)發(fā)育和妊娠過程中非常重要。
3 討論
CREBRF最早是由加拿大圭爾夫大學(xué)發(fā)現(xiàn)的一種具有未折疊蛋白質(zhì)反應(yīng)的堿基區(qū)亮氨酸拉鏈蛋白[2],其通過與細(xì)胞轉(zhuǎn)錄因子CREB3/Luman相互作用促進(jìn)CREB3蛋白降解[2],抑制蛋白反應(yīng)元件的激活。目前CREBRF 已被鑒定為多種核受體的新型轉(zhuǎn)錄調(diào)節(jié)因子[13‐14],CREBRF 通過內(nèi)質(zhì)網(wǎng)絡(luò)應(yīng)激途徑參與誘導(dǎo)細(xì)胞凋亡[5],還可通過CREB3/ATG5途徑阻斷缺氧誘導(dǎo)的自噬[14]。
中外豬種在表型和基因型上均存在巨大差異[15],與歐洲豬相比,亞洲品種表現(xiàn)出更高的繁殖能力、更多的脂肪積累和更慢的生長速度[16]。豬的繁殖效率受卵母細(xì)胞成熟[17]、卵巢激素[18‐19]、卵巢顆粒細(xì)胞凋亡[20]等諸多因素影響,本團(tuán)隊(duì)前期研究中發(fā)現(xiàn)并鑒定了梅山豬和大白豬的CREB3基因單核苷酸多態(tài)性[21],并在后續(xù)研究中發(fā)現(xiàn)了妊娠中期母豬卵巢黃體中的差異表達(dá)基因[22],本研究進(jìn)一步分析了CREBRF 基因的特征及其表達(dá)規(guī)律。克隆得到全長為1 920 bp的豬CREBRF 基因片段,基于CREBRF 基因所編碼蛋白展開生物信息學(xué)分析發(fā)現(xiàn),該基因共編碼639個氨基酸,分子質(zhì)量為72 085.82 Da,蛋白分子式為C3128H4918N856O1056S21,親水性較高,為極不穩(wěn)定蛋白。亞細(xì)胞定位預(yù)測顯示CREBRF蛋白主要定位于細(xì)胞核,但是在Yang等[5]對小鼠卵泡閉鎖期間的卵巢顆粒細(xì)胞的研究中發(fā)現(xiàn)CREBRF 蛋白定位于凋亡顆粒細(xì)胞的細(xì)胞質(zhì)中,提示CREBRF 蛋白可能具有多種亞細(xì)胞位置,其定位可能受到細(xì)胞環(huán)境、信號通路激活等因素的影響。因此,在不同的條件下,CREBRF蛋白可能呈現(xiàn)不同的亞細(xì)胞定位。
豬的CREBRF 蛋白被預(yù)測到有85個磷酸化位點(diǎn),與張麗萌等[3]對綿羊CREBRF 蛋白磷酸化位點(diǎn)預(yù)測到的87個磷酸化位點(diǎn)相近,進(jìn)一步證實(shí)CREBRF 基因的氨基酸序列的高保守性,有學(xué)者提出CREB 會應(yīng)答各種信號等磷酸化反應(yīng)[23],而作為CREB3的募集因子,CREBRF蛋白高置信度的磷酸化位點(diǎn)提示其在細(xì)胞信號傳導(dǎo)、代謝調(diào)節(jié)、基因轉(zhuǎn)錄等方面也可能受到磷酸化修飾的影響。CREBRF 蛋白預(yù)測的糖基化位點(diǎn)只有4個,提示該蛋白在糖基化修飾方面的影響相對較少。本研究通過預(yù)測發(fā)現(xiàn),CREBRF 基因CDS 區(qū)共存在20個高置信度的m6A甲基化位點(diǎn),說明CREBRF基因在轉(zhuǎn)錄后調(diào)控過程中可能受到m6A修飾的影響,提示該基因在轉(zhuǎn)錄后調(diào)控中扮演重要角色。通過對豬、人和小鼠CREBRF蛋白進(jìn)行氨基酸序列比對發(fā)現(xiàn),其保守性較強(qiáng),可能在生理過程有著相似的功能。
作為CREBRF 的互作蛋白[24],CREB3在果蠅胚胎發(fā)生終止時具有特定的作用[25],并且在雌性哺乳動物的生殖過程中也發(fā)揮重要作用,CREB3在雌性小鼠的子宮、卵巢以及輸卵管中均有表達(dá)[26],而且CREB3 的表達(dá)量也隨發(fā)情周期的變化呈現(xiàn)規(guī)律性地表達(dá)[27]。鑒于CREBRF 調(diào)節(jié)CREB3的活性,而CREBRF 敲除的小鼠母性行為嚴(yán)重喪失[8],Penney等[28]為了闡明CREB3 的生物學(xué)功能,構(gòu)建了CREB3 敲除的基因編輯小鼠,發(fā)現(xiàn)CREB3缺失的小鼠產(chǎn)仔數(shù)顯著下降,且與野生型相比母性較差。CREB3 與雌性動物的生殖相關(guān),進(jìn)一步表明了其募集因子CREBRF 在雌性動物繁殖過程中的重要調(diào)控作用。
本研究初步分析了CREBRF 在不同階段母豬卵巢中的表達(dá)規(guī)律,結(jié)果顯示,CREBRF 在仔豬出生時表達(dá)量最高,隨著豬的生長發(fā)育,表達(dá)量逐漸降低,在母豬妊娠期CREBRF 基因表達(dá)水平再次升高,CREBRF 在母豬卵巢中的動態(tài)表達(dá)提示其可能在母豬生長發(fā)育和懷孕過程中發(fā)揮重要功能。然而,關(guān)于CREBRF 基因具體的作用機(jī)制仍需要進(jìn)一步深入研究和探討。
通過對CREBRF 的基因和表達(dá)特征研究發(fā)現(xiàn),豬的CREBRF 基因的蛋白翻譯后修飾位點(diǎn)非常豐富,表明它可能在調(diào)控細(xì)胞信號傳導(dǎo)、基因表達(dá)調(diào)控以及細(xì)胞內(nèi)外相互作用中起著重要作用,且CREBRF 在豬生長生殖過程中的卵巢組織中呈現(xiàn)的“ 先高后低再高”的動態(tài)表達(dá)模式,提示CREBRF 基因在胎兒發(fā)育和生長過程中扮演著重要的角色,且在母豬妊娠過程中具有重要的調(diào)控作用。本研究能夠?yàn)槟肛i高繁殖力基因挖掘和分子標(biāo)記開發(fā)提供參考。
參考文獻(xiàn)
[1] 孫敬春.基于基因組變異信息鑒定大白豬繁殖性狀關(guān)鍵候選基因的研究[D].楊凌:西北農(nóng)林科技大學(xué), 2023.
SUN J C. Identification of key candidate genes for reproductivetraits in large white pigs based on genomic variationinformation [D]. Yangling: Northwest Aamp;F University, 2023.
[2] AUDAS T E, LI Y, LIANG G Q, et al .. A novel protein, Luman/CREB3 recruitment factor, inhibits luman activation of theunfolded protein response [J]. Mol. Cell. Biol., 2008, 28(12):3952-3966.
[3] 張麗萌,劉愛菊,李閏婷,等. 綿羊CREBRF 基因克隆、生物信息學(xué)及組織表達(dá)分析[J]. 中國畜牧獸醫(yī), 2022, 49(5):1599-1609.
ZHANG L M, LIU A J, LI R T, et al .. Cloning, bioinformaticsand tissue expression analysis of CREBRF gene in ovis aries [J].China Anim. Husb. Vet. Med., 49(5): 1599-1609.
[4] YANG D, JIANG T, LIU J, et al.. CREB3 regulatory factormTOR-autophagy regulates goat endometrial function duringearly pregnancy [J]. Biol. Reprod., 2018, 98(5): 713-721.
[5] YANG Y Z, LIN P F, CHEN F L, et al .. Luman recruitingfactor regulates endoplasmic reticulum stress in mouse ovariangranulosa cell apoptosis [J]. Theriogenology, 2013, 79(4): 633-639.
[6] LI X, LIN P, CHEN F, et al.. Luman recruiting factor isinvolved in stromal cell proliferation during decidualization inmice [J]. Cell Tissue Res., 2016, 365(2): 437-447.
[7] 楊延周. LRF在雌性小鼠生殖及卵巢顆粒細(xì)胞凋亡過程中的作用研究[D]. 楊凌: 西北農(nóng)林科技大學(xué), 2012.
YANG Y Z. Study on function of LRF in female mousereproduction and granulosa cell apoptosis [D]. Yangling: NorthwestAamp;F University, 2012.
[8] MARTYN A C, CHOLERIS E, GILLIS D J, et al .. Luman/CREB3 recruitment factor regulates glucocorticoid receptoractivity and is essential for prolactin-mediated maternalinstinct [J]. Mol. Cell. Biol., 2012, 32(24): 5140-5150.
[9] SUN S, LIU S M, LUO J, et al .. Repeated pregnant mare serumgonadotropin-mediated oestrous synchronization alters geneexpression in the ovaries and reduces reproductive performance indairy goats [J]. Reprod. Domest. Anim., 2019, 54(6): 873-881.
[10] LIVAK K J, SCHMITTGEN T D. Analysis of relative geneexpression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method [J]. Methods, 2001, 25(4): 402-408.
[11] LIU E T, BOLCUN-FILAS E, GRASS D S, et al.. Of mice andCRISPR: The post-CRISPR future of the mouse as a model systemfor the human condition [J]. EMBO Rep., 2017, 18(2): 187-193.
[12] 王妍,曹永春,邢凱.豬作為模式動物的研究進(jìn)展[J].中國實(shí)驗(yàn)動物學(xué)報(bào), 2023, 31(12): 1636-1645.
WANG Y,CAO Y C,XING K. Progress in use of pigs as modelanimals [J]. Acta Lab. Anim. Sci. Sinica, 31(12): 1636-1645.
[13] WANG L, LU M J, ZHANG R X, et al .. Inhibition of Luman/CREB3 expression leads to the upregulation of testosteronesynthesis in mouse Leydig cells [J]. J. Cell Physiol., 2019, 234(9):15257-15269.
[14] XUE H, ZHANG J S, GUO X, et al .. CREBRF is a potenttumor suppressor of glioblastoma by blocking hypoxia-inducedautophagy via the CREB3/ATG5 pathway [J]. Int. J. Oncol.,2016, 49(2): 519-528.
[15] ZHOU R, LI S T, YAO W Y, et al .. The Meishan pig genomereveals structural variation-mediated gene expression andphenotypic divergence underlying Asian pig domestication [J].Mol. Ecol. Resour., 2021, 21(6): 2077-2092.
[16] HALEY C S, LEE G J. Genetic basis of prolificacy in Meishanpigs [J]. J. Reprod. Fertil. Suppl., 1993, 48: 247-259.
[17] EPPIG J J. Reproduction: oocytes call, granulosa cells connect[J]. Curr. Biol., 2018, 28(8): R354- R356.
[18] SIROTKIN A V, PIVKO J. Hormonal indexes as predictors ofporcine reproductive traits [J/OL]. Anim. Sci. J., 2023, 94(1):e13879 [2024-04-18]. https://doi.org/10.1111/asj.13879.
[19] GUO Z H, LV L, LIU D, et al .. A meta-analysis: Effect ofandrogens on reproduction in sows [J/OL]. Front. Endocrinol.(Lausanne), 2023, 14: 1094466 [2024-04-18]. https://doi.org/10.3389/fendo.2023.1094466.
[20] DU X, WANG L F, LI Q Q, et al .. miR-130a/TGF- β1 axis isinvolved in sow fertility by controlling granulosa cell apoptosis [J].Theriogenology, 2020, 157: 407-417.
[21] LARSON S, ZHOU R, LI K, et al .. Genetic diversity in thestress regulatory gene LUMAN/CREB3 of Yorkshire andMeishan pigs [J]. Can. J. Anim. Sci., 2021, 101(4): 798-804.
[22] ZHOU R, YANG Y L, LIU Y, et al .. High serum reproductivehormone levels at mid-pregnancy support Meishan pigprolificacy [J]. J. Integr. Agric., 2023, 22(11): 3489-3499.
[23] MAYR B, MONTMINY M. Transcriptional regulation by thephosphorylation-dependent factor CREB [J]. Nat. Rev. Mol.Cell. Biol., 2001, 2(8): 599-609.
[24] LAN X L, JIN Y P, YANG Y Z, et al .. Expression andlocalization of Luman RNA and protein during mouseimplantation and decidualization [J]. Theriogenology, 2013,80(2): 138-144.
[25] ANDREW D J, BAIG A, BHANOT P, et al .. The DrosophiladCREB-A gene is required for dorsal/ventral patterning of thelarval cuticle [J]. Development,1997,124(1): 181-193.
[26] 蘭向莉. Luman在小鼠卵巢、輸卵管、子宮中表達(dá)[D].楊凌:西北農(nóng)林科技大學(xué), 2013.
LAN X L. Expression of Luman in mouse ovary, testis anduterus [D]. Yangling: Northwest Aamp;F University, 2013.
[27] 趙璠.Luman在小鼠顆粒細(xì)胞和子宮內(nèi)膜基質(zhì)細(xì)胞功能調(diào)節(jié)中的作用研究[D].楊凌: 西北農(nóng)林科技大學(xué), 2018.
ZHAO F. The regulation of Luman on the funactionality ofgranulosa cell and endometrial stromal cell [D]. Yangling:Northwest Aamp;F University, 2018.
[28] PENNEY J, MENDELL A, ZENG M H, et al .. LUMAN/CREB3is a key regulator of glucocorticoid-mediated stress responses [J].Mol. Cell. Endocrinol., 2017, 439: 95-104.
基金項(xiàng)目:科技創(chuàng)新2030重大項(xiàng)目(2023ZD0404702);國家自然科學(xué)基金項(xiàng)目(32130102,31972541)。

