藍舌病病毒感染對綿羊微血管內皮細胞中Ⅰ型干擾素應答的影響



摘" 要: 藍舌病病毒(bluetongue virus,BTV)是一種嚴重危害綿羊等反芻動物的蟲媒病毒,而綿羊微血管內皮細胞(sheep lung microvascular endothelial cells,SLMECs)構成肺半選擇性屏障,為研究BTV感染與SLMECs干擾素抗病毒免疫應答的分子機制。本研究通過BTV噬斑試驗以感染復數(MOI)為1的BTV誘導18、24、36 h的SLMECs,通過實時熒光定量PCR分析干擾素相關通路基因mRNA表達特征,以及 Western blot分析MDA5、TRAF3、RIG-I和 TBK1蛋白表達。結果表明,在誘導36 h時,干擾素信號通路基因mRNA表達的變化最明顯,RIG-I、MDA5、IKKε、IFN-β、TBK1和TRAF6基因mRNA上調表達,差異極顯著;而IFN-α、VISA、USP18基因mRNA下調表達,差異極顯著;在蛋白水平上 MDA5、TBK1、RIG-I和TRAF3蛋白都上調表達。本研究發現BTV可感染SLMECs誘導Ⅰ型干擾素免疫應答,為進一步分析IFN-I信號通路的激活在抗BTV感染天然免疫應答中的作用機制研究奠定基礎。
關鍵詞: 藍舌病病毒;Ⅰ型干擾素;綿羊肺微血管內皮細胞
中圖分類號: S852.659.4
文獻標志碼:A
文章編號:0366-6964(2024)12-5631-10
doi: 10.11843/j.issn.0366-6964.2024.12.026
開放科學(資源服務)標識碼(OSID):
收稿日期:2024-01-23
基金項目:重慶市自然科學面上項目基金(CSTB2022NSCQ-MSX0419);重慶市基礎研究與前沿探索專項項目基金(cstc2018jcyjAX0615)
作者簡介:羅世美(1998-),女,云南昭通人,碩士生,主要從事獸醫臨床感染與免疫研究,E-mail: 1918239281@qq.com;陳韻伊(2000-),女,云南麗江人,碩士生,主要從事獸醫臨床感染與免疫研究,E-mail: 2249029810@qq.com。羅世美和陳韻伊為同等貢獻作者
*通信作者:馬鮮平,主要從事獸醫病原微生物學研究,E-mail:124520096@qq.com;易華山,E-mail:dyxyihuashan@swu.edu.cn
Effect of Bluetongue Virus Infection on Type Ⅰ Interferon Responses in Sheep Lung Microvascular Endothelial Cells
LUO" Shimei1, CHEN" Yunyi1, LI" Qisha1, ZHOU" Yanmei1, HU" Xuerou1, LI" Mingyue1, WEI" Ziyu1, LI" Fang2, MA" Xianping1*, YI" Huashan1*
(1.College of Veterinary Medicine, Southwest University, Chongqing 402460," China;
2.Dazu Center for Animal Disease Prevention and Control, Chongqing 402360," China)
Abstract:" Bluetongue virus (BTV) is an arbovirus that seriously harms ruminants such as Sheep, while sheep lung microvascular endothelial cells (SLMECs) constitute a semi-selective barrier in order to study the molecular mechanism of interferon antiviral immune response in BTV infection and SLMECs. In this study, BTV plaque assay was used to induce SLMECs at 18 h, 24 h and 36 h with multiple infection (MOI) 1. The mRNA expression characteristics of interferon-related pathway genes were analyzed by real-time fluorescence quantitative PCR, and the protein expressions of MDA5, TRAF3, RIG-I and TBK1 were analyzed by Western blot. The results showed that the changes of interferon signaling pathway gene expression were most obvious, and the mRNA expressions of RIG-I, MDA5, IKKε, IFN-β, TBK1 and TRAF6 genes were up-regulated, and the differences were extremely significant (Plt;0.01) at 36 h of BTV induction, while the mRNA expressions of IFN-α, VISA and USP18 genes were significantly downregulated (Plt;0.01). At the protein level, the protein expressions of MDA5, TBK1, RIG-I and TRAF3 were mainly upregulated. This study found that BTV infection can induce an IFN immune response of SLMECs, which lays a foundation for further analysis of the mechanism of IFN-Ⅰ signaling pathway activation in the innate immune response against BTV infection.
Key words: bluetongue virus; type Ⅰ interferon; sheep lung microvascular endothelial cells
*Corresponding authors:" MA Xianping, E-mail: 124520096@qq.com; YI Huashan, E-mail:" dyxyihuashan@swu.edu.cn
藍舌病病毒(bluetongue virus,BTV)是呼腸孤病毒科(Reoviridae)的環狀病毒,其基因組由10個節段的雙鏈RNA組成[1-3]。BTV由媒介昆蟲庫蠓叮咬傳播,也通過直接接觸感染動物的分泌物或血液傳播,主要影響牛、綿羊等家畜及野生反芻動物[4-5]。BTV感染綿羊常引致其發熱、流鼻液、白細胞減少和嚴重的口腔和胃腸道黏膜炎癥和呼吸系統癥狀的藍舌病(bluetongue,BT)[6-7]。綿羊等易感動物被感染BTV的庫蠓叮咬后,BTV進入附近的淋巴結開始最初的復制增殖,然后侵染到全身其他組織,在單核吞噬細胞、淋巴細胞和內皮細胞中復制增殖[7]。宿主細胞對入侵的病毒通過模式識別受體(pattern-recognition receptors,PRRs)如維甲酸誘導基因I(retinoic acidinducible gene I,RIG-I)與黑色素瘤分化相關蛋白5(melanoma differentiation associated protein 5,MDA5)等識別并激活TANK結合激酶1(tank binding kinase 1,TBK1)等,從而產生具有啟動與增強抗原遞呈、抑制病毒復制等廣泛生物學活性的干擾素(inteferon,IFN)[8-9] 。隨著全球變暖加劇,BT的分布更加廣泛,主要集中于全球北緯40°~南緯35°之間的熱帶和亞熱帶地區,近年來還在向更高緯度地區蔓延流行,因此加強對BT發病機制及其防控研究對畜牧業發展具有重要意義[10]。
研究表明,肺是反芻動物變態反應的休克器官,而BTV能在單核吞噬細胞和內皮細胞中進行復制從而誘導炎癥細胞因子的表達和細胞凋亡,BTV感染肺組織引起肺微血管通透性障礙及誘導微血管損傷[11-13]。肺內皮細胞(lung endothelial cells , LECs)炎癥被認為是肺部炎癥或損傷的重要致病特征;例如BTV可以感染綿羊肺微血管內皮細胞(sheep lung microvascular endothelial cells,SLMECs),導致感染細胞凋亡或壞死及血管滲透性增加、 出血、液體滲出、血栓形成和組織梗死等[11,14-17]。干擾素作為一類重要的免疫調節因子,在機體抵御病毒感染方面發揮重要作用,而BTV感染SLMECs及其細胞內IFN信號通路的影響仍不清楚。本研究以BTV誘導SLMECs,研究BTV誘導對SLMECs中Ⅰ型IFN信號分子表達的影響,為深入理解BTV誘導宿主細胞免疫應答及揭示病毒逃逸免疫監視分子機制奠定基礎。
1" 材料與方法
1.1" 材料
BHK-21細胞、原代綿羊肺微血管內皮細胞、BTV-1株由本實驗室保存。
1.2" 主要試劑與儀器
胎牛血清購自美國Gibco公司;內皮細胞完全培養基購自賽百慷(上海)生物技術股份有限公司;細胞培養板購自Corning公司;MDA5、TRAF6、RIG-I兔單克隆抗體,CD31鼠單克隆抗體、CoraLite488標記羊抗鼠 IgG(H+L)購自武漢三鷹生物公司;TBK1兔多克隆抗體、RIG-I、β-Actin鼠單克隆抗體、辣根過氧化物酶標記山羊抗鼠IgG(H+L)、辣根過氧化物酶標記山羊抗兔IgG(H+L)等購自杭州碧云天生物科技公司;24孔板圓形細胞爬片購自上海臥宏生物科技公司,DAPI、Triton X-100購自Solarbio;ChamQ Universal SYBR qPCR Master Mix購自Vazyme公司,TRIzolTMReagent購自Thermo Fisher公司,其余所用試劑均為進口或國產分析純。倒置熒光顯微鏡 LEICA DMi8購自LEICA公司,QuantStudio 3 Quantita- tive RT-PCR儀為ABI公司,超高靈敏度化學發光檢測儀FUSION FX-XT 為VILBER 公司產品。
1.3" 藍舌病病毒滴度測定
37 ℃水浴復蘇SLMECs,1 000 r·min-1離心5min,用含5%胎牛血清、1%三抗(100X青霉素-鏈霉素-兩性霉素B溶液)、1%內皮細胞營養因子、90% 內皮細胞培養基重懸細胞,均勻鋪于T25細胞培養瓶,于37 ℃、5% CO2細胞培養箱中培養。待細胞密度達到1.2×105 cells·mL-1以上后進行傳代時,鋪于24孔培養板。在24孔細胞培養板接種已在BHK-21細胞上增殖一次后的BTV毒株,通過噬斑法測定病毒的含量并以“PFU·mL-1”表示。
1.4" SLMECs的免疫熒光分析
取爬片置于24孔板中,每孔加入培養基1 mL,加入細胞0.02 million個·孔-1。置培養箱2 h或過夜。吸出培養基,用PBS洗1遍,加入4% PFA于4 ℃固定30 min。用1×PBS洗3×5 min·次-1,取100 μL破膜封閉液(0.5% Trition X-100與PBS 1∶1混合,再加10% 羊血清)2 h后,吸出破膜封閉液;加200 μL一抗CD31(1∶200),4 ℃,2 h后,用1×PBS洗3×5 min·次-1;加200 μL二抗 CoraLite488標記羊抗鼠 IgG(H+L)(1∶3 000)室溫避光孵育1 h,PBS洗3×5 min·次-1,染DAPI(DAPI:PBS=1∶1 000)5 min,PBS洗3×5min·次-1。取出爬片置于新干凈玻片上加1滴Fluoromount-G熒光封片劑后熒光顯微鏡觀察。
1.5" SLMECs的復蘇及BTV誘導釋放Ⅰ型干擾素
對“1.3”中復蘇培養的SLMECs,待細胞密度達到1.2×105 cells·mL-1以上后進行傳代時,鋪于12孔、6孔細胞培養板上,以感染復數(MOI)為1的BTV-1誘導SLMECs 18、24、36 h,分別設置感染組與對照組(control),進行3次重復試驗。
1.6" 引物的設計與合成
參照NCBI中β-Actin(NM_007393.5)、RIG-Ⅰ(XR_004673265.1)、MDA5(NM_022168.4)、VISA(NM_001206491.2)、TBK1(KU_182750.1)、IKKε(DQ_667176.1)、TRAF3(NM_001199427.2)、TRAF6(XM_035012591.1)、USP18(NM_017414.4)、IFN-α(NM_024013.3)、IFN-β(NM_002176.4)序列應用Primer-Blast程序設計,VP7(M63417.1)應用Primer -Premier 5.0設計的qRT-PCR引物由重慶華大生物有限公司合成,引物序列見表1。
1.7" 實時熒光定量PCR檢測Ⅰ型干擾素通路基因的mRNA表達水平
分別收集3次按“1.5”方法處理的Control及BTV感染18、24和36 h 的SLMECs,吸棄培養基,用1×PBS清洗3次,用TRIzolTM Reagent提取細胞總RNA并反轉錄為cDNA作為模板,以β-Actin、RIG-Ⅰ、MDA5、VISA、TBK1、IKKε、TRAF3、TRAF6、USP18、IFN-α、IFN-β基因引物參照Vazyme公司的ChamQ Universal SYBR qPCR Master Mix試劑盒進行實時熒光定量PCR檢測,反應體系20 μL,反應條件為95 ℃ 1 min,95 ℃ 5 s,60 ℃ 30 s,共45個循環。
1.8" Western blot檢測Ⅰ型干擾素通路基因蛋白表達水平
將生長良好的SLMECs鋪于6孔細胞培養板,待細胞密度達到80%左右時,添加感染復數(MOI)為1的BTV-1分別誘導細胞18、24和36 h,Control組不做處理,取處理的SLMECs,用1×PBS清洗2次,每孔用120 μL細胞裂解液(含PMSF)裂解提取細胞總蛋白,隨后各取10 μL(復孔各5 μL)加上15 μL的1×PBS用BCA蛋白濃度測定試劑盒測定每個樣本的濃度,通過計算將濃度均一化,加上樣緩沖液,渦旋15 s后沸水浴10 min,12 000 r·min-1離心3 min。
1.9" 統計與分析
使用2-ΔΔCt法計算qRT-PCR所得數據,采用Student t測驗進行差異顯著性分析,統計學分析每組試驗的平均值±標準誤,每組為三次重復,使用單因素方差分析,P lt;0.01差異極顯著,P lt;0.05差異顯著。
2" 結" 果
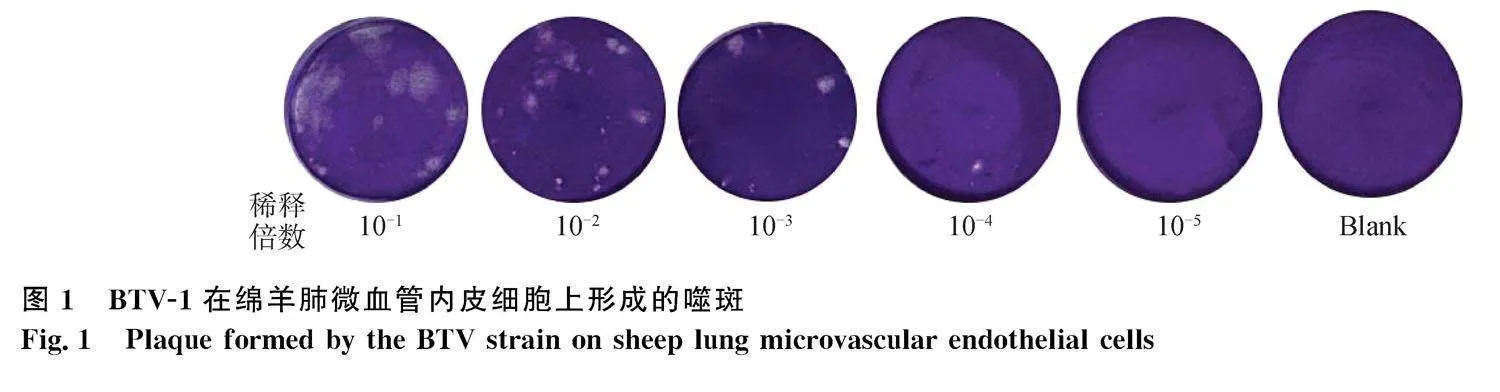
2.1" BTV-1滴度測定
噬斑試驗分析結果顯示,病毒滴度隨著時間延長而不斷增長,感染60~86 h后,出現明顯的病毒噬斑(圖1)。細胞上清BTV-1毒株的病毒滴度(2.6×105 PFU·mL-1)。
2.2" SLMECs的IF分析
IF檢測結果顯示,CD31抗體經 1∶200 稀釋后能檢測到強的綠色熒光信號(圖2),這一結果表明SLMECs純度達到90%以上。
2.3" BTV-1在SLMECs的增殖特性
BTV-1感染SLMECs后,顯微鏡觀察,試驗組24 h后開始出現明顯的細胞病變(CPE),而對照組未出現CPE(圖3A)。BTV-1 感染后試驗感染組和對照組細胞樣品通過 RT-PCR 擴增 BTV VP7基因,電泳結果顯示,對照組樣品未出現目的電泳條帶,而在試驗組不同時間點的樣品出現了預期大小特異的目的條帶(圖3B)。PCR 產物經測序比對為BTV-1 VP7 基因,說明BTV-1可以在SLMECs細胞中復制增殖。
A. BTV-1誘導后SLMECs的形態變化;B. RT-PCR分析BTV-1 VP7 基因;M. DNA 相對分子質量標準;1~3. BTV感染后VP7基因擴增產物;4~6.對照組VP7基因擴增產物
A. Morphological changes of SLMECs infected by BTV-1;B. RT-PCR analysis VP7 gene of BTV-1; M. DL 2000 marker; 1-3. PCR production of VP7 gene infected BTV-1;4-6. PCR production of VP7 gene in the control group
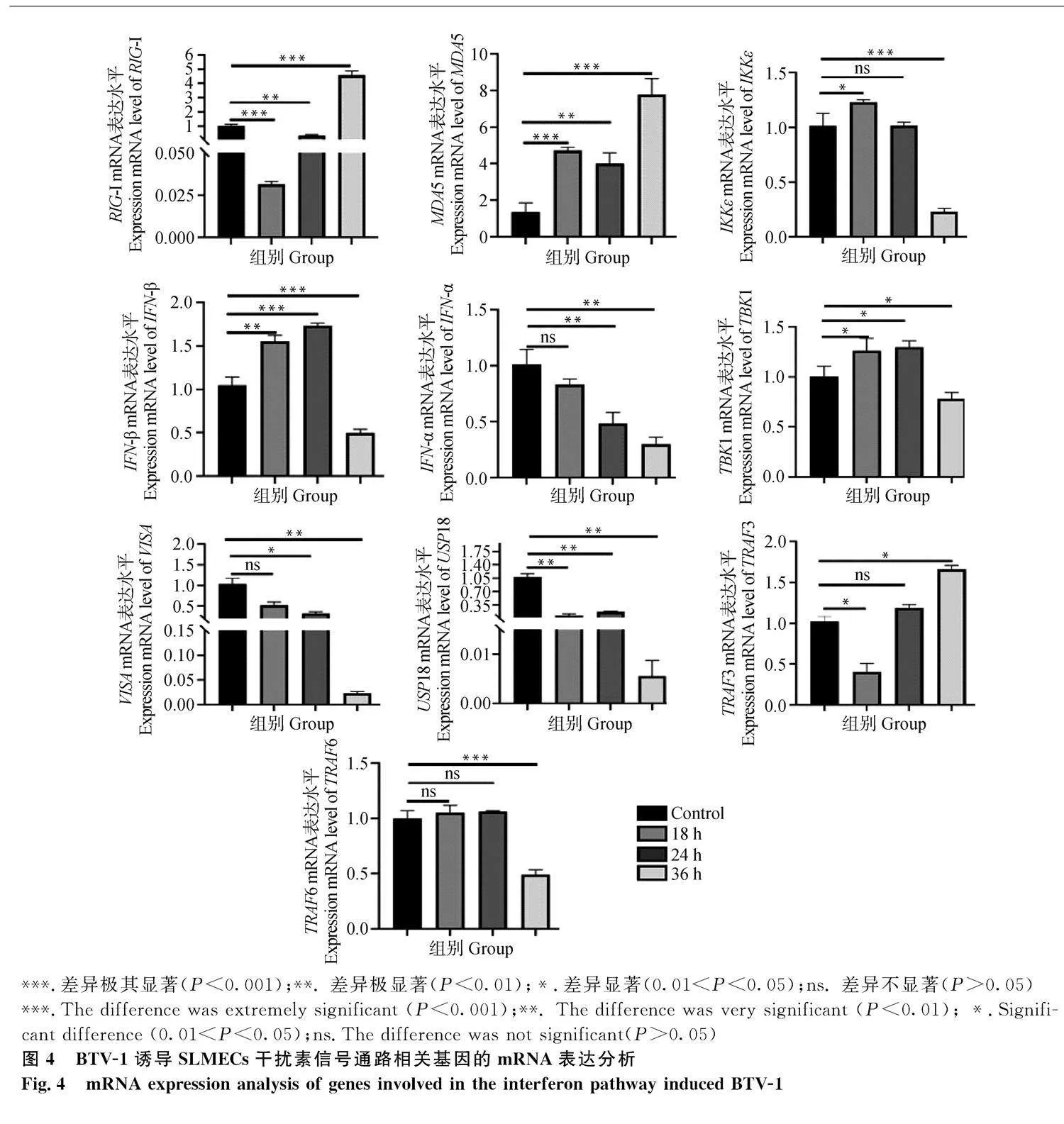
2.4" BTV-1誘導對干擾素通路相關基因mRNA表達的影響
以1 MOI BTV誘導18、24和36 h的SLMECs試驗組和對照組SLMECs(Control)cDNA為模板,以β-Actin(內參基因)、RIG-I、VISA、TBK1、IKKε、MDA5、TRAF3、TRAF6、IFN-α、IFN-β、USP18基因引物進行qRT-PCR分析。結果顯示:Control組與18、24和36 h誘導組細胞結果比較,RIG-I在BTV誘導18、24 h時表達水平明顯下調(Plt;0.001,Plt;0.01),但在36 h時明顯上調,差異極顯著(Plt;0.001);MDA5、IKKε、IFN-β、TBK1和TRAF6基因在BTV誘導18、24 h后mRNA表達水平上調,其中MDA5和IFN-β差異極顯著(Plt;0.01或Plt;0.001),TRAF6差異不顯著(Pgt;0.05),36 h時表達水平除了MDA5都顯著下調(Plt;0.05,或Plt;0.01,或Plt;0.001),MDA5表達水平顯著上調,差異極顯著(Plt;0.001),TBK1差異顯著(Plt;0.05);IFN-α、VISA、USP18基因在BTV誘導18、24和36 h后mRNA表達水平下調,USP18差異極顯著(Plt;0.01),IFN-α和VISA在24~36 h時差異顯著(Plt;0.05)或極顯著(Plt;0.01);TRAF3在BTV誘導18 h時下調(Plt;0.05),在24和36 h上調,36 h時差異顯著(Plt;0.05)(圖4)。
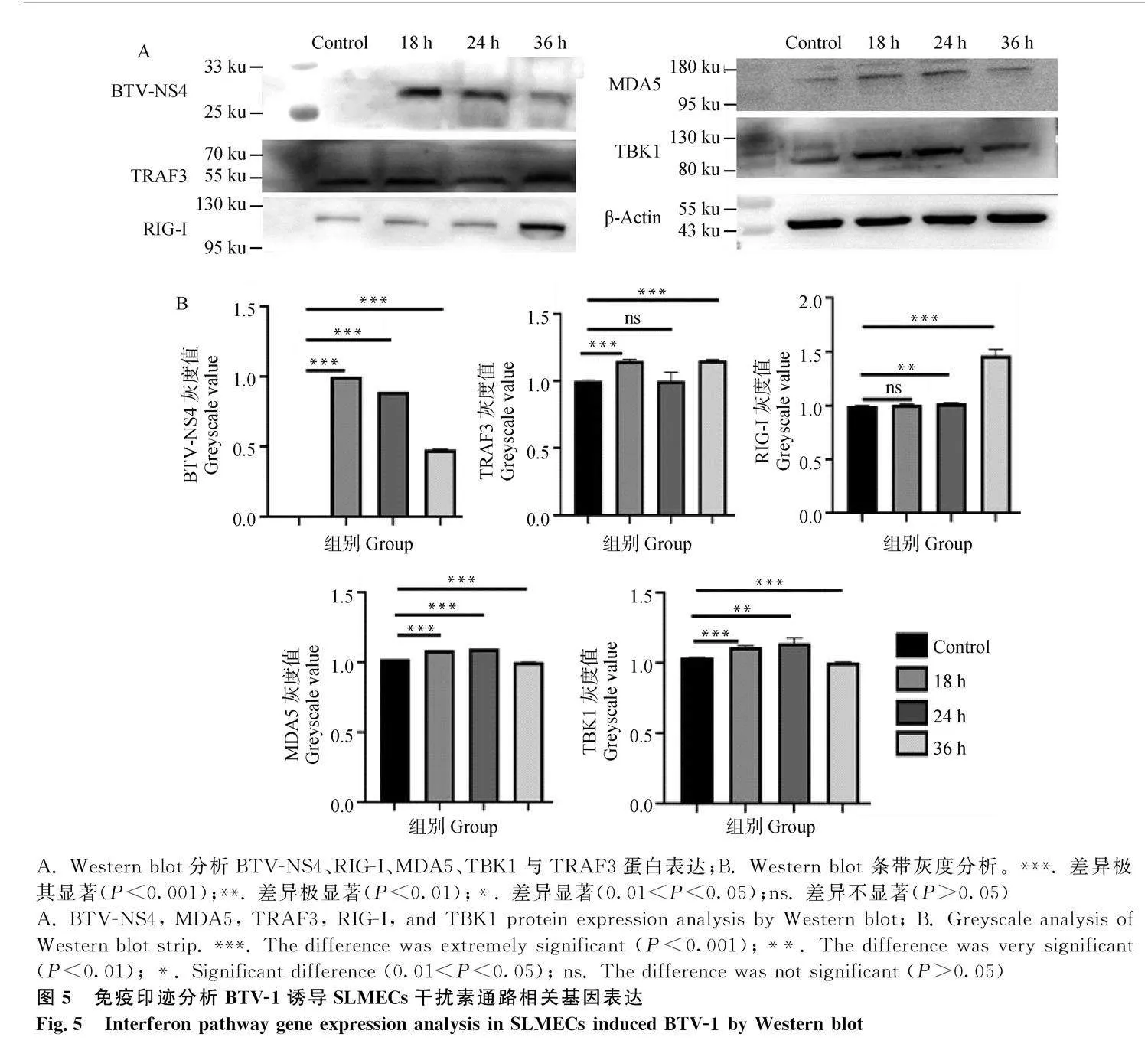
2.5" BTV-1誘導的BTV-NS4、MDA5、TRAF3、RIG-I和 TBK1的蛋白表達的影響
對BTV誘導18、24及36 h的細胞樣品用BTV-NS4、MDA5、TRAF3、RIG-I、TBK1、β-Actin(內參)抗體進行Western blot。結果表明,與對照組相比,BTV-NS4在BTV誘導18、24、36 h后蛋白表達水平上調,差異極顯著(Plt;0.001);RIG-I蛋白在24、36 h后上調表達,差異極顯著(Plt;0.01,Plt;0.001);TRAF3蛋白在24 h時下調表達,差異不顯著(Pgt;0.05),而BTV誘導18、36 h后蛋白表達水平上調,差異極顯著(Plt;0.001);MDA5、TBK1蛋白在BTV誘導18、24 h時上調表達,差異極顯著(Plt;0.01或Plt;0.001),而在36 h時兩者都下調表達,差異極顯著(Plt;0.001)(圖5)。上述結果表明,BTV誘導SLMECs不同時間內對TRAF3、RIG-I、MDA5和TBK1蛋白呈上調表達。
3" 討" 論
本文探究藍舌病病毒感染是否對SLMECs中Ⅰ型IFN表達和信號通路產生影響。研究表明,BTV感染多種細胞誘導強烈的Ⅰ型IFN效應,如BTV-1 在感染PST細胞后能顯著誘導干擾素刺激基因1(interferon-induced protein with tetratricopeptide repeats 1,IFIT1)的轉錄及其蛋白表達[18-20]。在非造血細胞中,BTV誘導IFN-β基因的表達依賴于RNA解旋酶RIG-I和MDA5的激活,BTV感染還會觸發A549細胞中IFN刺激基因(ISGs)的表達[21]。而BTV-16的RNA與巨噬細胞內TLR3結合后,可活化下游信號轉導通路,從而上調細胞內IFN-Ⅰ的表達[22]。目前認為,BTV在綿羊細胞中可變復制動力學主要通過消除細胞IFN-Ⅰ反應而被消除[23]。本研究發現BTV-1可在SLMECs中復制增殖,BTV誘導試驗表明在SLMECs中MDA5、IFN-α、TRAF3、IFN-β、TBK1基因mRNA表達水平顯著上調,而感染24 h后,IFN-β、IKKε、TRAF6、USP18基因的mRNA表達水平下調,表明在BTV病毒感染早期誘導SLMECs內IFN-Ⅰ干擾素免疫應答,在感染后36 h時IFN-Ⅰ干擾素免疫應答通路中IFN-β、TRAF6、USP18基因的下調表達而促進BTV-1在SLMECs中復制增殖。
天然免疫是機體抵抗病毒感染的第一道防線,宿主細胞為了應對各種病原體的感染而表達分泌不同類型的 IFN而增強宿主的抗病毒應答反應[24]。研究表明,BTV感染宿主細胞后可通過NS3/NS4拮抗細胞內IFN信號轉導而抑制IFN-Ⅰ的產生,其中NS3作為拮抗宿主細胞反應的病毒蛋白,而NS4蛋白在BTV逃逸宿主天然免疫的過程中發揮重要作用,如顯著抑制IFN-β啟動子活性,BTV NS3和NS4協同靶向STAT1的SH2結構域,抑制其磷酸化、異二聚化、核易位以及JAK-STAT通路下游基因的激活及STAT1磷酸化[20,25-30]。本研究發現BTV-1感染SLMECs,干擾素信號通路蛋白MDA5、TRAF3、RIG-I和 TBK1蛋白都上調表達,表明BTV-1感染誘導IFN-Ⅰ信號通路基因在蛋白水平的表達;揭示BTV-1感染宿主細胞后,病毒dsRNA被病原體模式識別受體(pathogen associated molecule patterns,PAMPs)識別(如RIG-I、MDA5和cGAS),進一步激活后結合IPS-1(也稱MAVS)蛋白形成RIG-I/MDA5-IPS-1復合物,觸發MAVS-TBK1-IRF3等信號通路,使磷酸化的IRF3 (p-IRF3)易位到細胞核中,誘導IFN-Ⅰ(如IFN-α和IFN-β)基因的轉錄抗BTV免疫應答。
研究表明,環狀GMP-AMP (cGAMP)合成酶(cGAS)與dsDNA結合后,招募ATP和GTP生成cGAMP,作為第二信使,cGAS從基因組DNA損傷中識別出胞質病原體衍生的DNA(例如病毒DNA)或自身DNA,然后激活STING,被激活的STING招募TBK1磷酸化IRF3而調控IFN-β的產生[31]。有研究通過293T細胞結合重組試驗發現MAVS通過TRAFs-TBK1/IKKε復合物招募TBK1/IKKε再通過磷酸化使TBK1/IKε活化,其中TBK1/IKKε對IRF3的磷酸化是誘導IFN-Ⅰ響應病毒感染的關鍵[32]。TRAF3作為NF-κB信號通路的負調控因子可抑制NF-κB信號通路及凋亡產物的表達[33]。TBK1是一種絲氨酸/蘇氨酸蛋白,其在哺乳動物中高度保守,屬于非經典的IκB激酶(IKK)家族,包括IKKε和TBK1[32-35]。本研究中,BTV-1誘導SLMECs MDA5、TBK1、TRAF3和RIG-I蛋白表達呈上調趨勢,表明這四個蛋白在BTV誘導SLMECs抗病毒免疫中具有重要作用,但SLMECs抗病毒活性與病毒侵襲力之間的關系及與BTV病毒dsRNA識別及其IFN信號通路蛋白分子調控機制有待進一步研究,以深入揭示BTV感染與宿主細胞IFN-Ⅰ信號通路關鍵調控蛋白間分子機制,為BTV感染、致病機理及其防控策略提供基礎。
4" 結" 論
本研究通過BTV-1誘導SLMECs,發現RIG-I、MDA5、IKKε、IFN-β、TBK1和TRAF6基因mRNA上調表達,IFN-α、VISA、USP18基因mRNA下調表達;在蛋白水平上 MDA5、TBK1、RIG-I和TRAF3蛋白呈上調表達,說明BTV感染SLMECs后,激活宿主細胞Ⅰ型干擾素通路基因的表達,在不同時間段表達水平不同,表明BTV感染和宿主細胞抗病毒免疫應答及其病毒蛋白拮抗宿主免疫應答間的復雜關系,為進一步探究BTV感染與宿主細胞抗病毒免疫應答機制提供參考。
參考文獻(References):
[1]" SANDERS C, VERONESI E, RAJKO-NENOW P, et al. Field-reassortment of bluetongue virus illustrates plasticity of virus associated phenotypic traits in the arthropod vector and mammalian host in vivo[J]. J Virol, 2022, 96(13):e00531-22.
[2]" 李成輝, 肖朋朋, 趙冠宇, 等. 藍舌病毒RT-PCR檢測方法的建立及對云南省庫蠓藍舌病流行病學檢測[J]. 中國獸醫學報, 2019, 39(5):821-825.
LI C H, XIAO P P, ZHAO G Y, et al. Establishment of RT-PCR diagnosis for bluetongue virus and epidemiological detection of blue tongue disease in cucoidopsis chinensis in Yunnan province[J]. Chinese Journal of Veterinary Science, 2019, 39(5):821-825. (in Chinese)
[3]" ATTOUI H, JAAFAR F M, MONSION B, et al. Increased clinical signs and mortality in IFNAR(-/-) mice immunised with the bluetongue virus outer-capsid proteins VP2 or VP5, after challenge with an attenuated heterologous serotype[J]. Pathogens, 2023, 12(4):602.
[4]" 李蘇勝, 楊清榮, 何于雯, 等. 云南庫蠓源藍舌病毒血清5型的分離與鑒定[J]. 中國獸醫科學, 2024, 54(2):193-199.
LI S S, YANG Q R, HE Y W, et al. Isolation and identification of bluetongue virus serotype 5 from Culiocides in Yunnan of China[J]. Chinese Veterinary Science, 2024, 54(2):193-199. (in Chinese)
[5]" 林俊泓, 王" 讓, 趙" 瑤, 等. 藍舌病毒釋放機制的研究進展[J]. 生物工程學報, 2021, 37(9):3179-3189.
LIN J H, WANG R, ZHAO Y, et al. Advances in the release mechanisms of bluetongue virus[J]. Chinese Journal of Biotechnology, 2021, 37(9):3179-3189. (in Chinese)
[6]" LIU F, GONG Q L, ZHANG R, et al. Prevalence and risk factors of bluetongue virus infection in sheep and goats in China:A systematic review and meta-analysis[J]. Microb Pathog, 2021, 161:105170.
[7]" ROY P. Bluetongue virus structure and assembly[J]. Curr Opin Virol, 2017, 24:115-123.
[8]" SHAABANI N, VARTABEDIAN V F, NGUYEN N, et al. IFN-β, but not IFN-α, is responsible for the pro-bacterial effect of type I interferon[J]. Cell Physiol Biochem, 2021, 55(3):256-264.
[9]" SNELL L M, MCGAHA T L, BROOKS D G. Type I interferon in chronic virus infection and cancer[J]. Trends Immunol, 2017, 38(8):542-557.
[10]" 高" 輝, 方" 敏, 姜玲玲, 等. 中國2012—2022年羊群中藍舌病毒流行的Meta分析[J]. 畜牧獸醫學報, 2024, 55(2):706-717.
GAO H, FANG M, JIANG L L, et al. Meta-analysis of bluetongue virus prevalence in sheep flocks in China from 2012—2022[J]. Acta Veterinaria et Zootechnica Sinica, 2024, 55(2):706-717. (in Chinese)
[11]" MEYRICK B, HOOVER R, JONES M R, et al. In vitro effects of endotoxin on bovine and sheep lung microvascular and pulmonary artery endothelial cells[J]. Cell Physiol, 1989, 138(1):165-174.
[12]" DEMAULA C D, LEUTENEGGER C M, BONNEAU K R, et al. The role of endothelial cell-derived inflammatory and vasoactive mediators in the pathogenesis of bluetongue[J]. Virology, 2002, 296(2):330-337.
[13]" SCHWARTZ-CORNIL I, MERTENS P P C, CONTRERAS V, et al. Bluetongue virus: virology, pathogenesis and immunity[J]. Vet Res, 2008, 39(5):46.
[14]" GEE M H, TAHAMONT M V, FLYNN J T, et al. Prostaglandin E1 prevents increased lung microvascular permeability during intravascular complement activation in sheep[J]. Circ Rea, 1987, 61(3):420-428.
[15]" DEMAULA C D, JUTILA M A, WILSON D W, et al. Infection kinetics, prostacyclin release and cytokine-mediated modulation of the mechanism of cell death during bluetongue virus infection of cultured ovine and bovine pulmonary artery and lung microvascular endothelial cells[J]. J Gen Virol, 2001, 82(4):787-794.
[16]nbsp; DEMAULA C D, LEUTENEGGER C M, JUTILA M A, et al. Bluetongue virus-induced activation of primary bovine lung microvascular endothelial cells[J]. Vet Immunol Immunopathol, 2002, 86(3-4):147-157.
[17]" MACLACHLAN N J, DREW C P, DARPEL K E, et al. The pathology and pathogenesis of bluetongue[J]. J Comp Pathol, 2009, 141(1):1-16.
[18]" FANG R, JIANG Q, ZHOU X, et al. MAVS activates TBK1 and IKKε through TRAFs in NEMO dependent and independent manner[J]. PLoS Pathog, 2017, 13(11):e1006720.
[19]" 張國芮, 康" 棣, 王軒瑩, 等. 干擾素刺激基因IFIT1抑制藍舌病病毒的復制[J]. 病毒學報, 2023, 39(6):1660-1669.
ZHANG G R, KANG D, WANG X Y, et al. Interferon-stimulated gene IFIT1 inhibits the replication of bluetongue virus[J]. Chinese Journal of Virology, 2023, 39(6):1660-1669. (in Chinese)
[20]" VITOUR D, DOCEUL V, RUSCANU S, et al. Schwartz-Cornil I, Zientara S. Induction and control of the type I interferon pathway by Bluetongue virus[J]. Virus Res, 2014, 182:59-70.
[21]" DOCEUL V, CHAUVEAU E, LARA E, et al. Dual modulation of type I interferon response by bluetongue virus[J]. J Virol, 2014, 88(18):10792-10802.
[22]" 高云飛, 高鳳成, 李清峰. 藍舌病毒通過誘導巨噬細胞產生干擾素抑制HBV增殖[J]. 中國肝臟病雜志(電子版), 2019, 11(2):42-47.
GAO Y F, GAO F C, LI Q F. Bluetongue virus inhibits HBV proliferation by inducing macrophages to produce interferon[J]. Chinese Journal of Liver Diseases (Electronic Version), 2019, 11(2):42-47. (in Chinese)
[23]" HARDY A, BAKSHI S, FURNON W, et al. The timing and magnitude of the type I interferon response are correlated with disease tolerance in arbovirus infection[J]. mBio, 2023, 14(3):e00101-23.
[24]" AVIA M, ROJAS J M, MIORIN L, et al. Virus-induced autophagic degradation of STAT2 as a mechanism for interferon signaling blockade[J]. EMBO Rep, 2019, 20(11):e48766.
[25]" LI Z R, LU D F, YANG H, et al. Bluetongue virus non-structural protein 3 (NS3) and NS4 coordinatively antagonize type Ⅰ interferon signaling by targeting STAT1[J]. Vet Microbiol, 2021, 254:108986.
[26]" 馬" 驥, 朱文青, 林俊泓, 等. 藍舌病病毒NS4基因原核表達載體的構建與表達[J]. 西北農業學報, 2022, 31(9):1168-1173.
MA J, ZHU W Q, LIN J H, et al. Construction and expression of prokaryotic expression vector of bluetongue virus NS4 gene[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2022, 31(9):1168-1173. (in Chinese)
[27]" 朱" 沛, 肖" 雷, 吳" 梅, 等. 藍舌病病毒NS3蛋白抑制細胞Ⅰ型干擾素的產生[J]. 中國獸醫學報, 2022, 42(6):1156-1162, 1204.
ZHU P, XIAO L, WU M, et al. Bluetongue virus NS3 protein inhibiting the production of type Ⅰ interferon from epithelial cells[J]. Chinese Journal of Veterinary Science, 2022, 42(6):1156-1162, 1204. (in Chinese)
[28]" 馬鮮平, 羅世美, 蔡旭研, 等. 藍舌病病毒NS4蛋白亞細胞定位對Ⅰ型干擾素應答的影響[J]. 中國獸醫學報, 2023, 43(7):1373-1380.
MA X P, LUO S M, CAI X Y, et al. Effects of subcellular localization of bluetongue virus NS4 protein on type Ⅰ interferon response[J]. Chinese Journal of Veterinary Science, 2023, 43(7):1373-1380. (in Chinese)
[29]" 羅世美, 趙" 瑤, 馬鮮平, 等. 藍舌病病毒NS4蛋白原核表達及多克隆抗體制備[J]. 中國畜牧獸醫, 2023, 50(7):2923-2930.
LUO S M, ZHAO Y, MA X P, et al. Prokaryotic expression and polyclonal antibody preparation of bluetongue virus NS4 protein[J]. China Animal Husbandry amp; Veterinary Medicine, 2023, 50(7):2923-2890. (in Chinese)
[30]" GERTZ G P, MCNALLY K L, ROBERTSON S J, et al. The methyltransferase-like domain of chikungunya virus nsP2 inhibits the interferon response by promoting the nuclear export of STAT1[J]. J Virol, 2018, 92(17):e01008-18.
[31]" JIA M T, QIN D H, ZHAO C Y, et al. Redox homeostasis maintained by GPX4 facilitates STING activation[J]. Nat Immunol, 2020, 21(7):727-735.
[32]" WU J C, HU Y, SONG J Y, et al. Lysine methyltransferase SMYD2 inhibits antiviral innate immunity by promoting IRF3 dephosphorylation[J]. Cell Death Dis, 2023, 14(9):592.
[33]" SUN L P, HU C F, ZHANG X Z. TRAF3 delays cyst formation induced by NF-κB signaling[J]. IUBMB Life, 2017, 69(3):170-178.
[34]" 常" 玉, 丁" 克. TANK結合酶1小分子抑制劑的研究進展[J]. 藥學進展, 2019, 43(7):504-516.
CHANG Y, DING K. Recent advances in research on small-molecule TBK1 inhibitors[J]. Progress in Pharmaceutical Sciences, 2019, 43(7):504-516. (in Chinese)
[35]" HU Z Q, XIE Y C, LU J S, et al. VANGL2 inhibits antiviral IFN-I signaling by targeting TBK1 for autophagic degradation[J]. Sci Adv, 2023, 9(25):eadg2339.
(編輯" 白永平)

