甘薯CIN基因家族鑒定及影響塊根膨大關鍵CIN基因的挖掘



關鍵詞:甘薯;細胞質轉化酶;蔗糖代謝;基因家族;塊根膨大
中圖分類號:S531 文獻標志碼:A
甘薯[Ipomoea batatas (L.) Lam.]適應能力強、產量高且易于管理,在全球廣泛栽培,為世界第七大農作物[1]。我國是世界第一大甘薯種植國,面積、產量均居全球首位[2]。2022 年我國甘薯種植面積和產量分別占全球的30%和54%[3]。甘薯塊根富含淀粉、可溶性糖、蛋白質、維生素和礦物質,可作為主糧和飼料,也可用于鮮食、食品和淀粉加工[4]。和其他發展中國家相比,我國甘薯單產相對較高,但與發達國家相比,仍有一定差距。目前我國甘薯平均單產為22.5 t/hm2[5],而日本和以色列則分別為24.7、33.3 t/hm2[6],澳大利亞更是高達39.7 t/hm2[3]。目前我國甘薯單產已處平臺期,近20 年來一直徘徊在22 t/hm2 左右,沒有進一步提升[3]。雖然很多發展中國家和地區仍依靠甘薯作為主糧來確保糧食安全[7-8],但其甘薯單產遠低于世界平均水平的12 t/hm2,如非洲僅為7t/hm2[3]。如何進一步提高甘薯產量,不僅可以保障“一帶一路”沿線發展中國家和地區的糧食安全,還可提高我國甘薯種植效益。甘薯產量主要由2 個因素決定,即塊根數量和塊根大小。因此,闡明甘薯塊根發育和膨大的機理,將有利于進一步提高甘薯產量,實現高產、穩產的目標。
蔗糖(sucrose, Suc)分解產生的己糖可作為碳骨架、能量或糖信號在植物的生長發育中發揮重要作用[9]。轉化酶(invertase, INV)和蔗糖合酶(sucrose synthase, Sus)參與植物體內Suc 的分解。Sus 將Suc 分解為UDP-葡萄糖(UDP-Glc)和果糖(Fru),該分解過程為可逆過程;INV 則不可逆地將Suc 水解為Glc 和Fru[10]。根據亞細胞定位的不同,INVs 可進一步分為3 種:細胞壁轉化酶(cell wall invertase, CWIN)、液泡轉化酶( vacuolar invertase, VIN ) 和細胞質轉化酶(cytoplasmic invertase, CIN)[11]。這4 種蔗糖分解酶在植物發育、非生物脅迫反應和植物-病原菌互作中分別發揮著重要的作用[9, 11-12]。
迄今為止,有關蔗糖分解酶對塊根/塊莖等地下儲藏器官(如胡蘿卜肉質根和馬鈴薯塊莖等)生長發育影響的研究主要集中于Sus、CWIN 和VIN[13-16],對CIN 的研究較少。與CWIN、VIN不同,CIN 在植物進化過程中更為保守,其基因序列變異程度遠低于CWIN 和VIN,因此在植物生長發育中發揮的作用可能更為重要[17]。研究表明,CIN 分解產生的己糖可參與各種生理生化反應,包括呼吸代謝、抗氧化、各種代謝物的生物合成以及基因表達的調控等[11, 18]。
越來越多的證據表明,CIN 在植物根系發育中發揮著重要的作用。擬南芥中T-DNA 的插入導致CIN 基因CINV1 缺失突變,造成突變體幼苗根系變短[19] 。擬南芥的雙CIN 基因突變體(cinv1/cinv2)表現為初生根伸展減少30%,同時葉片數量也顯著減少[20]。在百脈根( Lotusjaponicus)中,CIN 基因LjINV1 的突變會顯著降低CIN 活性,嚴重抑制根系的生長,且會導致根系上形成根瘤[21] 。EMS 誘導水稻CIN 基因OsCyt-inv1 突變導致根系發育受阻,包括根系伸長區細胞皺縮和根系變短[22]。此外,擬南芥CIN基因AtCYT-INV1 的突變會緩解滲透脅迫對側根生長的抑制,表明CIN 基因還可調控脅迫條件下根系的生長發育[23]。
如上所述,目前CIN 對根系發育影響的研究主要集中在模式植物上,有關CIN 對甘薯塊根膨大調控的研究較少。這很大程度上是由于甘薯是六倍體(2n=6x=90)且染色體高度雜合,基因組測序較晚所導致的[24]。近期公布的甘薯基因組序列可為研究CIN 在甘薯塊根膨大中的潛在作用提供重要幫助[24-25]。本研究對甘薯基因組中的CIN基因家族成員進行鑒定和生物信息學分析,進一步研究CIN 基因成員在甘薯不同組織部位和不同類型根系表達水平以及CIN 活性,最后篩選出可能在塊根膨大中起重要調控作用的關鍵CIN 基因。本研究將為后續通過轉基因技術研究CIN 在甘薯塊根膨大中的功能奠定基礎。
1 材料與方法
1.1 材料
2021年10月20號至12月20號在海南大學露地種植海南甘薯主栽品種高系14,基肥按照450 kg/hm2 的量施史丹利復合肥(N∶P∶K 為15∶15∶15)和12 t/hm2的量施羊糞有機肥。取樣部位分別為高系14 甘薯的幼葉、成熟葉、莖、花(僅花瓣)和60 d 塊根,每個部位取0.3g,4個生物學重復。
2023年2月至4月在海南大學農科實驗田基地的溫室大棚盆栽種植高系14 甘薯。定植前將土壤與基質(由椰糠、泥炭、稻谷殼、珍珠巖及微生物料配置而成)按體積比3∶1 混勻,再施史丹利復合肥作為基肥。花盆規格為外直徑31 cm,高19.4 cm,4 個生物學重復。取樣部位為白色纖維根(白色細纖維狀根)、紅色纖維根(直徑小于0.2 cm 的紅色纖維狀根)、柴根(直徑0.5~2.0 cm的紅色不膨大根)和60 d 塊根。每個樣品分別稱取0.2、0.3 g 存放在2 mL 試管中,液氮處理后保存于?80 ℃超低溫冰箱備用。
1.2 方法
1.2.1 甘薯CIN 基因家族成員鑒定 采用木薯、水稻、擬南芥等3 個物種作為種子序列進行Blast對比,具體參照CHEN 等[26]的方法。在甘薯數據庫(https://ipomoea-genome.org/)下載栽培種甘薯Ipomoea batatas 的全基因組數據,在UniProt(https://www.uniprot.org/)數據庫和文獻查閱中下載擬南芥、水稻、木薯的所需氨基酸序列[10, 27-28]。用TBtools[29]軟件和NCBI(https://www.ncbi.nlm.nih.gov/)數據庫進行雙向Blast 比對篩選。
1.2.2 甘薯CIN 基因家族成員理化性質分析及染色體定位 使用ExPASy(http://web.expasy.org/protparam/)在線軟件分析CIN 的理化性質。使用TBtools 軟件可視化分析CIN 基因家族成員在染色體上的位置。
1.2.3 甘薯CIN 基因家族成員系統發育分析 使用MEGA-X(https://www.megasoftware.net/)在線軟件對擬南芥、木薯和甘薯的CIN 蛋白氨基酸序列進行進化分析,采用鄰接法(neighbor-joiningmethod)構建系統進化樹,自展值為1000。使用Adobe illustrator CC 2019 軟件美化。
1.2.4 甘薯CIN 基因家族成員保守結構域、基因結構和基序分析 通過NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb. cgi)數據庫確定甘薯CIN 基因的保守結構域。使用TBtools 軟件確定甘薯CIN 家族基因結構(內含子-外顯子)。使用MEME(http://meme-suite.org/tools/meme)在線軟件預測甘薯CIN 家族成員的基序(motif),預測CIN 蛋白基序的標準為:不同圖案的數量=10,其他參數默認,得到的結果使用TBtools 軟件進行可視化分析。
1.2.5 甘薯CIN 基因家族成員順式作用元件分析 將甘薯CIN 基因轉錄起始上游2000 bp的序列,通過PlantCare(http://bioinformatics.psb.ugent.be/webtools/plan tcare/html/)在線軟件對甘薯CIN 啟動子進行順式作用元件預測,并使用TBtools 軟件制作熱圖。
1.2.6 甘薯CIN 基因家族共線性分析 用TBtools 軟件的One Step MCscanX 功能分析甘薯CIN 基因的共線性關系,用TBtools 中的Advanced Circos 功能將甘薯CIN 同源基因的共線性關系可視化,計算基因對的Ka/Ks(非同義替換率/同義替換率)。
1.2.7 甘薯CIN 基因家族成員表達分析 采用OmniPlant RNA Kit(DNase I)(CoWin Biotech,北京,中國)試劑盒提取甘薯樣品總RNA。使用HiScript III All-in-one RT SurperMix Perfect forqPCR cDNA 合成試劑盒(Vazyme,南京,中國)對提取的RNA 進行反轉錄cDNA。使用ChamQUniversal SYBR qPCR Master Mix(Vazyme,南京,中國)試劑盒和QuantStudioTM 1 實時熒光定量PCR 儀(applidbiosystems,Thermo Fisher Scientific)進行實時定量PCR。以管家基因IbActin 為內參基因,引物見表1。反應程序:95 ℃ 5 min;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40 個循環。使用2?ΔΔCT 方法計算基因的相對表達水平。
1.2.8 甘薯CIN 酶活性測定 參照TOMLINSON等[30]的方法測定甘薯CIN 活性。
1.3 數據處理
采用Excel 2022軟件對相關數據進行處理,采用SPSS 27.0 軟件對甘薯CIN 基因表達和CIN酶活性數據進行單因素方差分析(ANOVA)。
2 結果與分析
2.1 甘薯CIN 基因家族成員的鑒定
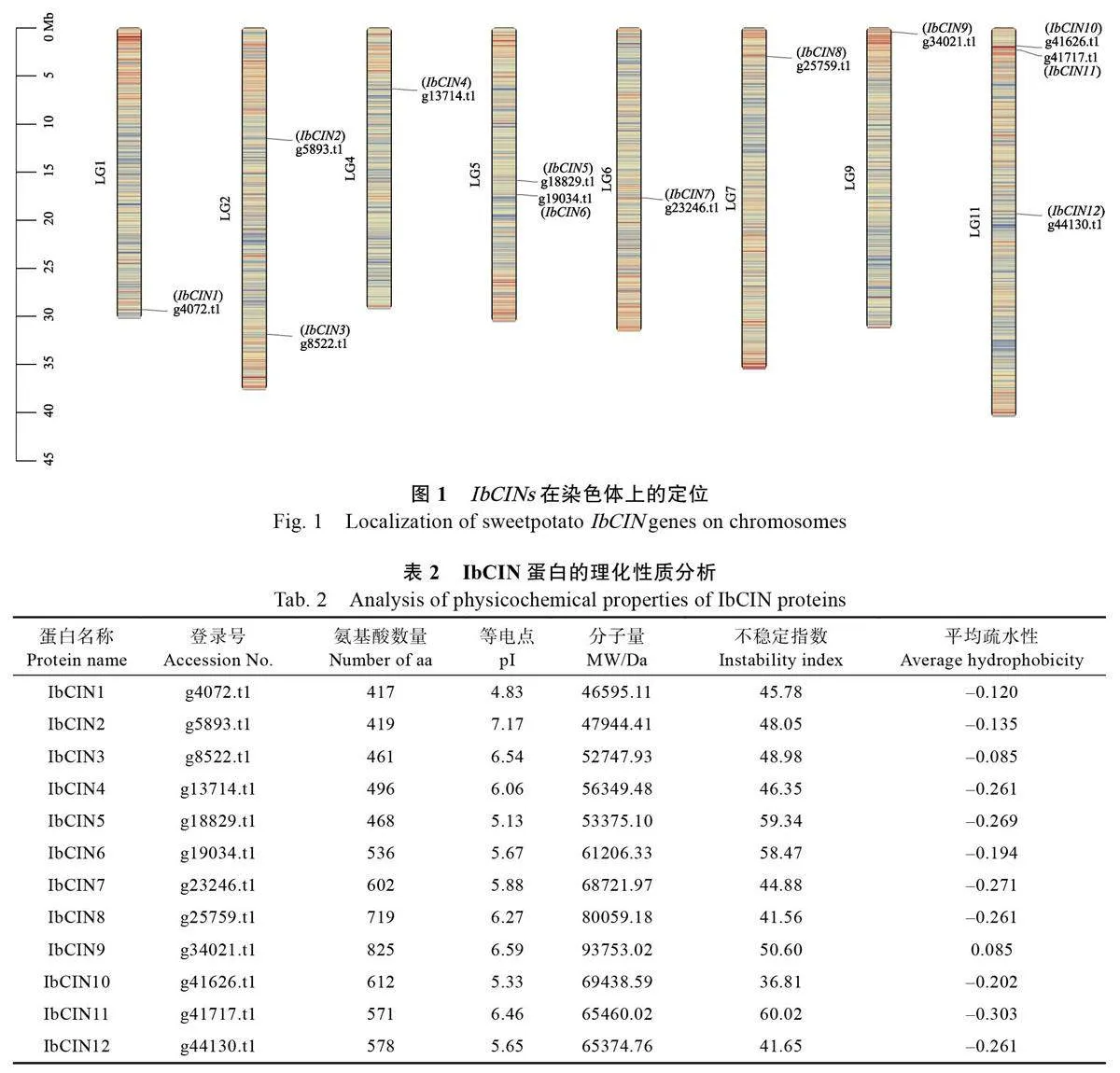
用TBtools 軟件和NCBI 網站進行雙向Blast序列比對篩選,共鑒定出12 個CIN 基因家族成員, 按照其在染色體上的先后順序命名為IbCIN1-12(圖1)。甘薯屬于六倍體(6x=90),其IbCINs 分別分布在15 條染色體中的8 條染色體上,在LG11 上有3 個IbCINs(IbCIN10-12),在LG2 和LG5 上分別有2 個IbCINs(IbCIN2-3、IbCIN5-6),而在LG1、LG4、LG6、LG7 和LG9上均只有1 個IbCIN(IbCIN1、IbCIN4、IbCIN7-9)。在其他7 條染色體上均無IbCIN 基因。
IbCIN 蛋白的理化性質分析結果顯示(表2),IbCIN 蛋白長度在417~825 aa 之間,等電點在4.83~7.17 之間,分子量在46 595.11~93 753.02 Da之間。除IbCIN10 外,其他IbCIN 蛋白的不穩定指數均大于40,為不穩定蛋白,與已有的研究結果一致,即與CWIN 和VIN 不同,由于CIN 蛋白沒有糖基化,導致其結構不穩定,非常容易分解[9]。在所有IbCIN 蛋白中,僅IbCIN9 平均疏水性為正值,屬于疏水蛋白,其他IbCIN 蛋白均為負值,屬于親水蛋白(表2)。
2.2 甘薯CIN 基因家族成員的系統發育分析
前人研究發現CIN 蛋白可被分為3 個亞組,分別為α1、α2 和β 亞組,其中α1 亞組定位于質體上(如葉綠體),α2 亞組定位于線粒體上,β亞組則位于細胞質中[31]。用MEGA-X 軟件將鑒定出的12 個IbCINs 與已鑒定出的9 個擬南芥和10個木薯CIN 家族成員共31 個CIN 基因構建系統發育樹(圖2)。擬南芥α1 亞組有1 個成員,α2亞組有3 個成員,β 亞組有5 個成員;木薯α1亞組有3 個成員,α2 亞組有3 個成員,β 亞組有4個成員,這和前人的研究結果一致[31-32]。12 個IbCINs 也可以分為3 個亞組,α1 亞組有1 個成員(IbCIN8);α2 亞組有3 個成員(IbCIN7、IbCIN10和IbCIN12),β 亞組有8 個成員(IbCIN1-6、IbCIN9和IbCIN11)。
位于細胞質的擬南芥CIN 基因AtCINV1 的缺失可以減少30%的初生根伸長生長[20]。超表達擬南芥CIN 基因At-A/N-InvA 或At-A/N-InvG(AtCINV1)表明,這2 個基因都會顯著降低原生質體中POD 的表達,從而抑制根系過早木質化,最終促進根系生長發育[33-34]。根據系統發育樹, 發現甘薯IbCIN7 、IbCIN12 與擬南芥At-A/N-InvA 親緣關系較近,甘薯IbCIN1 與擬南芥At-A/N-InvG(AtCINV1)親緣關系較近,初步推測甘薯IbCIN1、IbCIN7、IbCIN12 有降低原生質體中POD 表達的功能,與甘薯根系發育相關。木薯中MeNINV1 是塊根淀粉積累的關鍵基因,可促進木薯塊根膨大[27, 35]。擬南芥中A/N-InvH 與根中ROS 合成相關,與根系生長密切相關[36]。IbCIN10 與MeNINV1 親緣關系較近,而IbCIN7、IbCIN12 與At-A/N-InvH 親緣關系較近,推測這3個基因可能與甘薯根系發育相關。綜上所述,IbCIN1、IbCIN7、IbCIN10、IbCIN12 等4 個基因可能均和甘薯根系發育密切相關。但具體哪個基因與甘薯塊根膨大相關還有待進一步確定。
2.3 甘薯CIN 基因家族成員的基因結構和基序分析
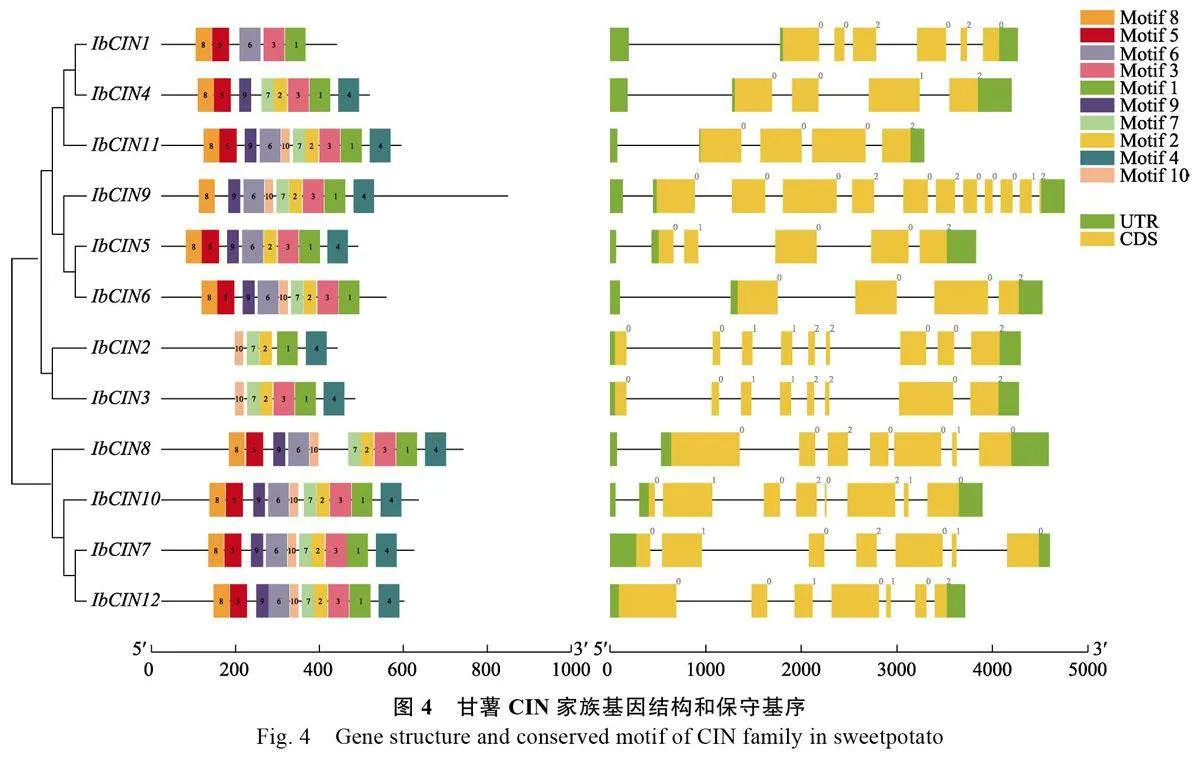
通過N C B I 蛋白保守域數據庫對甘薯(IbCIN1-12)和木薯(MeNINV1-10)的CIN 進行蛋白保守結構域分析發現,與木薯CIN 一樣,12 個甘薯CIN 均含有CIN 蛋白特有的Glyco_hydro_100 保守結構域(圖3),屬于糖基水解酶基因家族GH 100,與前人研究結果一致[31]。表明本研究鑒定出的12 個IbCINs 屬于CIN 基因家族。此外,保守基序分析顯示(圖4),IbCINs 有10個保守基序(motif),α1 和α2 亞組的4 個IbCINs包含10 個motif,在β 亞組中只有IbCIN11 基因包含10 個motif,IbCIN1-2 包含5 個motif,IbCIN3包含6 個motif,IbCIN4-5 包含8 個motif,IbCIN6、IbCIN9 包含9 個motif,只有motif1 存在于所有IbCINs。
為進一步了解甘薯CIN 基因家族的進化,對甘薯CIN 基因家族成員的外顯子-內含子分布進行分析。α1 亞組的唯一一個CIN 基因IbCIN8 有7 個外顯子;α2 亞組中除IbCIN10 具有8 個外顯子外,其他2 個IbCINs 也均有7 個外顯子;β 亞組中IbCIN4、IbCIN6 和IbCIN11 有4 個外顯子,IbCIN5 有5 個外顯子,IbCIN1 有6 個外顯子,IbCIN3 有8 個外顯子,IbCIN2 有9 個外顯子,IbCIN9 有11 個外顯子(圖4)。
α1、α2 亞組成員之間在保守基序和基因結構上差異較小、相對保守,而β 亞組成員之間則差異較大,表明β 亞組CIN 基因在甘薯栽培種的進化過程中經歷了結構缺失和變異,這可能導致其在功能上的多樣化,從而可以參與更多的生物過程[37]。在保守基序方面,α1、α2 亞組的4 個IbCINs都包含有10 個保守基序,而8 個β 亞組成員中僅IbCIN11 含有10 個保守基序,其余7 個IbCINs(IbCIN1-6 和IbCIN9)的保守基序介于5~9 個之間。同樣,在基因結構方面,α1 和α2 亞組4 個基因中除IbCIN10 具有8 個外顯子外,其他3 個IbCINs 具有7 個外顯子,而β 亞組成員包含的外顯子數量則波動較大,介于4~11 個之間。不同亞組CIN 之間在保守基序和基因結構上的差異可能是影響其亞細胞定位和功能的重要原因。
2.4 甘薯CIN基因家族成員的順式作用元件分析
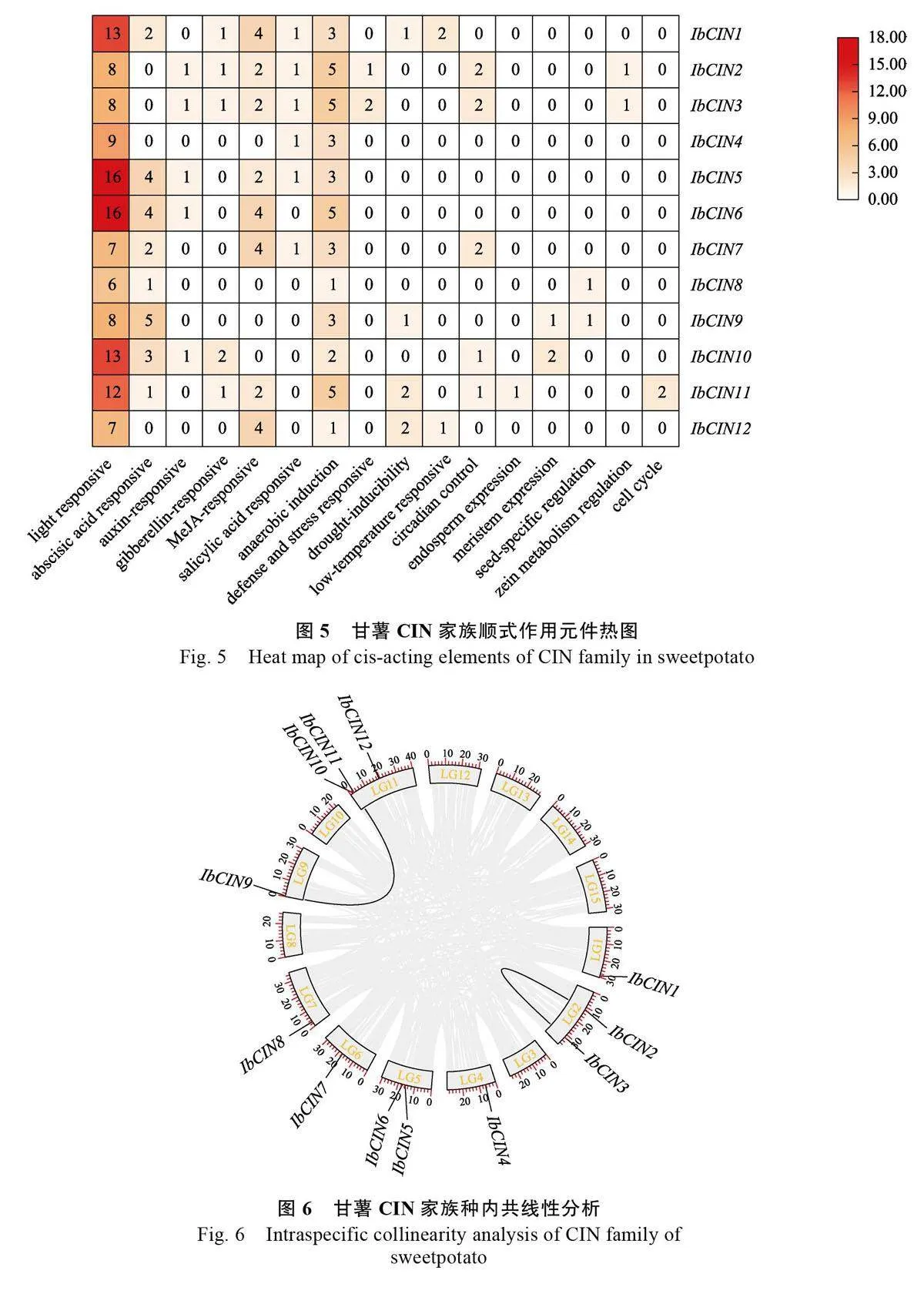
啟動子順式元件與基因功能密切相關,利用甘薯CIN 基因家族的2000 bp 啟動子區域分析其順式作用元件。IbCINs 的啟動子順式作用元件有16 種,可分為4大類,根據每大類中順式元件數量從多到少依次為光響應元件(AAAC-motif、ACA-motif、ACE、AE-box、ATCT-motif、Box 4、Box II、chs-CMA1a、chs-CMA2a、G-box、GAmotif、GATA-motif、GT1-motif、I-box、LAMPelement、L-box、MRE、Sp1、TCCC-motif、TCTmotif)、激素響應元件(生長素AuxRR-core 和TGA-element;脫落酸ABRE、赤霉素GAREmotif、P-box、TATC-box;水楊酸TCA-element;茉莉酸甲酯CGTCA-motif 和TGACG-motif)、逆境脅迫響應元件(低溫LTR、干旱MBS、缺氧ARE 和GC-motif、防御TC-rich repeats)和生長發育響應元件(胚乳表達GCN4_motif、分生組織表達CAT-box;晝夜節律調控circadian、種子特異性元件RY-element、玉米醇溶蛋白代謝元件O2-site、細胞循環MSA-like)(圖5)。由于光響應元件和激素響應元件在CIN 基因中數量最多,推測光和激素是影響IbCIN 基因表達的主要因素。在光周期響應方面,甘薯屬于短日照植物,短日照會促進其開花。IbCIN1、IbCIN5、IbCIN6、IbCIN10、IbCIN11 具有最多的光響應元件,推測這5 個基因可能和甘薯開花密切相關,而其他7個成員的光響應元件相對較少。研究表明,對于塊根/塊莖作物,開花會抑制塊根/塊莖的膨大[38],推測IbCIN1、IbCIN5、IbCIN6、IbCIN10、IbCIN11可能會抑制塊根膨大, 而其他7 個IbCINs(IbCIN2-4、IbCIN7-9、IbCIN12)則可能在甘薯塊根膨大中發揮重要作用。在激素響應方面,脫落酸促進甘薯塊根的形成[39]和膨大[40]。與其他家族成員相比,IbCIN1、IbCIN5-7 和IbCIN9-10 都包含相對較多的ABA 響應元件,推測IbCIN1、IbCIN5-7 和IbCIN9-10 可能通過響應ABA 來促進甘薯塊根膨大。研究表明,赤霉素促進木質化從而抑制甘薯塊根生長[41],而IbCIN4-9 和IbCIN12均不包含赤霉素響應元件,因此推測IbCIN4-9 和IbCIN12 可能會促進甘薯塊根膨大。
2.5 甘薯CIN 基因家族成員共線性分析和壓力選擇分析
使用TBtools 軟件的MCScanX 功能在IbCINs中共鑒定出2 個重復基因對,其中IbCIN9-IbCIN11分布于不同的染色體上,而IbCIN2-IbCIN3位于同一染色體(圖6)。這2 個重復基因對均為片段復制,沒有發現串聯重復,說明片段復制是IbCIN 基因進化的主要動力,從而導致功能冗余和亞/新功能化[42]。通過計算基因對的Ka/Ks 值,發現這2 個重復基因對的Ka/Ks<1,說明IbCIN受純化選擇,IbCIN 在進化過程的非同義突變是有害的,因而在甘薯進化過程中處于劣勢而被淘汰。這表明CIN 在甘薯生長發育中發揮著重要且不可替代的作用,從而在甘薯進化中具有很強的保守性。
2.6 IbCINs 在不同組織部位中的表達分析
為鑒定出與甘薯塊根膨大密切相關的IbCIN基因,本研究對12 個IbCIN 基因在甘薯幼葉、成熟葉、莖、花、60d 塊根等不同組織部位中的表達進行分析(圖7)。IbCIN2-4、IbCIN7、IbCIN9-12等8個基因在5種組織部位中均有表達,其中IbCIN2-6 與IbCIN8-11 在塊根中的表達量最高,IbCIN7在花中的表達量最高,IbCIN12 在莖中的表達量最高。此外,IbCIN1 僅在成熟葉和幼葉中表達,且在幼葉中的表達量高于成熟葉。IbCIN5僅在莖和塊根中表達,且在塊根中的表達量最高。IbCIN6 和IbCIN8 僅在莖、花和塊根中表達,且在塊根中的表達量最高。IbCIN 基因的表達模式具有明顯的組織特異性,12 個IbCINs 中有9 個(IbCIN2-6 和IbCIN8-11)在塊根中的表達量最高,而其他3 個IbCINs 分別在幼葉(IbCIN1)、花(IbCIN7)和莖(IbCIN12)中的表達量最高。
2.7 IbCIN 基因在不同類型根系中的表達分析
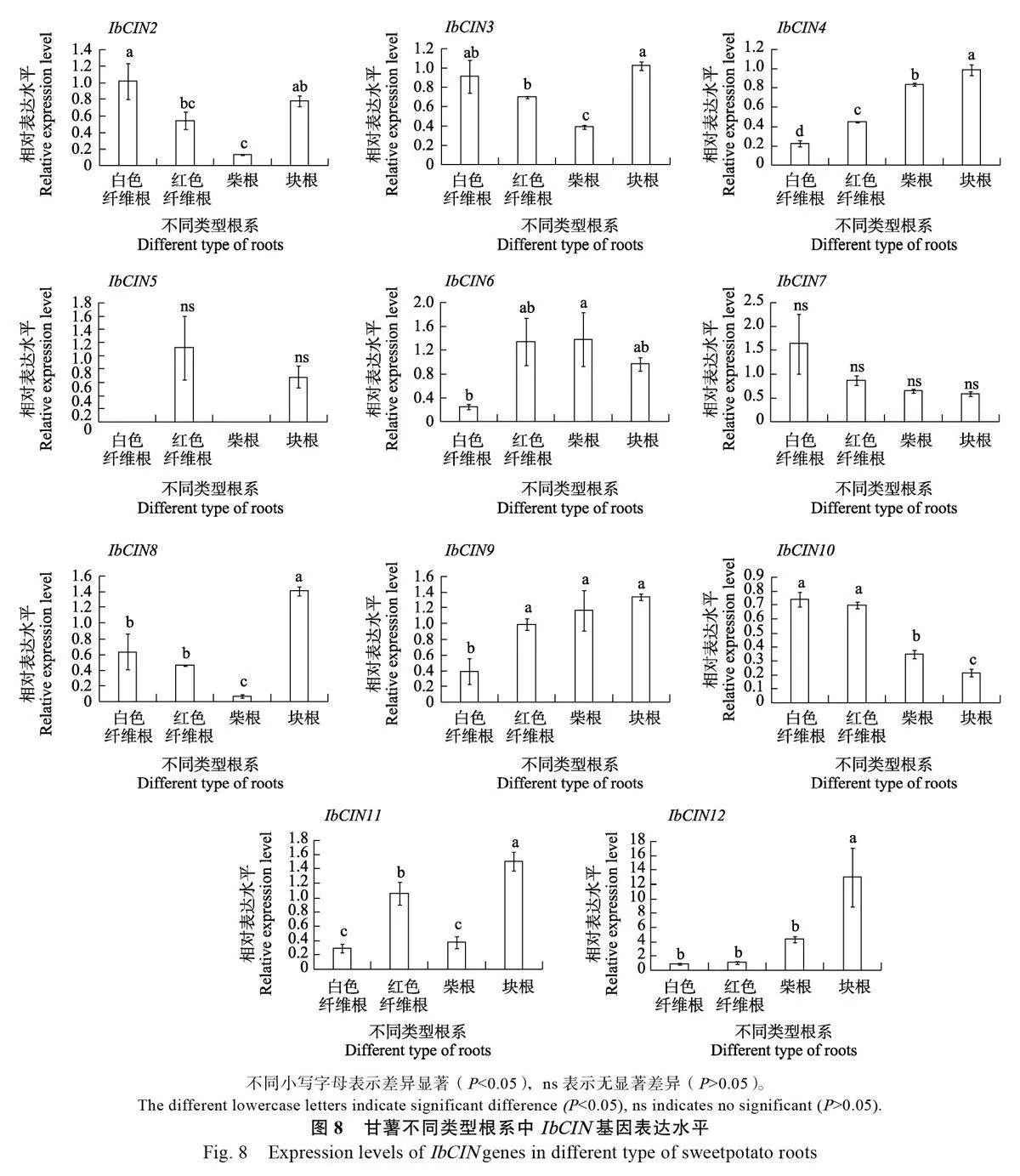
為進一步縮小影響甘薯塊根膨大的候選IbCIN 基因的范圍,對白色纖維根、紅色纖維根、柴根和60 d 塊根等4 種根系進行取樣,測定其IbCIN 基因的表達水平(圖8)。結果發現,IbCIN1在甘薯不同類型根系中均不表達,此結果和圖7的測定結果相吻合。IbCIN5 僅在紅色纖維根和塊根中表達,且在紅色纖維根中的表達量最高。其余10 個IbCINs 在所有類型根系中均有表達,其中IbCIN4、IbCIN8、IbCIN11、IbCIN12 等4個基因在塊根中的表達量最高,顯著高于在其他類型根系中的表達。IbCIN2、IbCIN3 和IbCIN9等3個基因在塊根、白色和紅色纖維根中的表達量較高,且差異不顯著。IbCIN7 和IbCIN10等2個基因在白色和紅色纖維根中的表達量較高,而IbCIN6 在柴根和紅色纖維根中的表達量較高。
由于在12 個IbCINs 中,只有IbCIN4、IbCIN8、IbCIN11 和IbCIN12 等4 個基因的表達水平在塊根中顯著高于其他3 種類型根系,因此推測IbCIN4、IbCIN8、IbCIN11 和IbCIN12 這4 個基因可能在甘薯塊根膨大中發揮著重要作用。IbCIN基因在不同組織部位(幼葉、成熟葉、莖、花、60 d 塊根)中的表達分析結果也顯示,IbCIN4、IbCIN8、IbCIN11 在塊根中的表達量最高。因此,推測IbCIN4、IbCIN8 和IbCIN11 等3 個基因可能是影響甘薯塊根膨大關鍵CIN 基因。
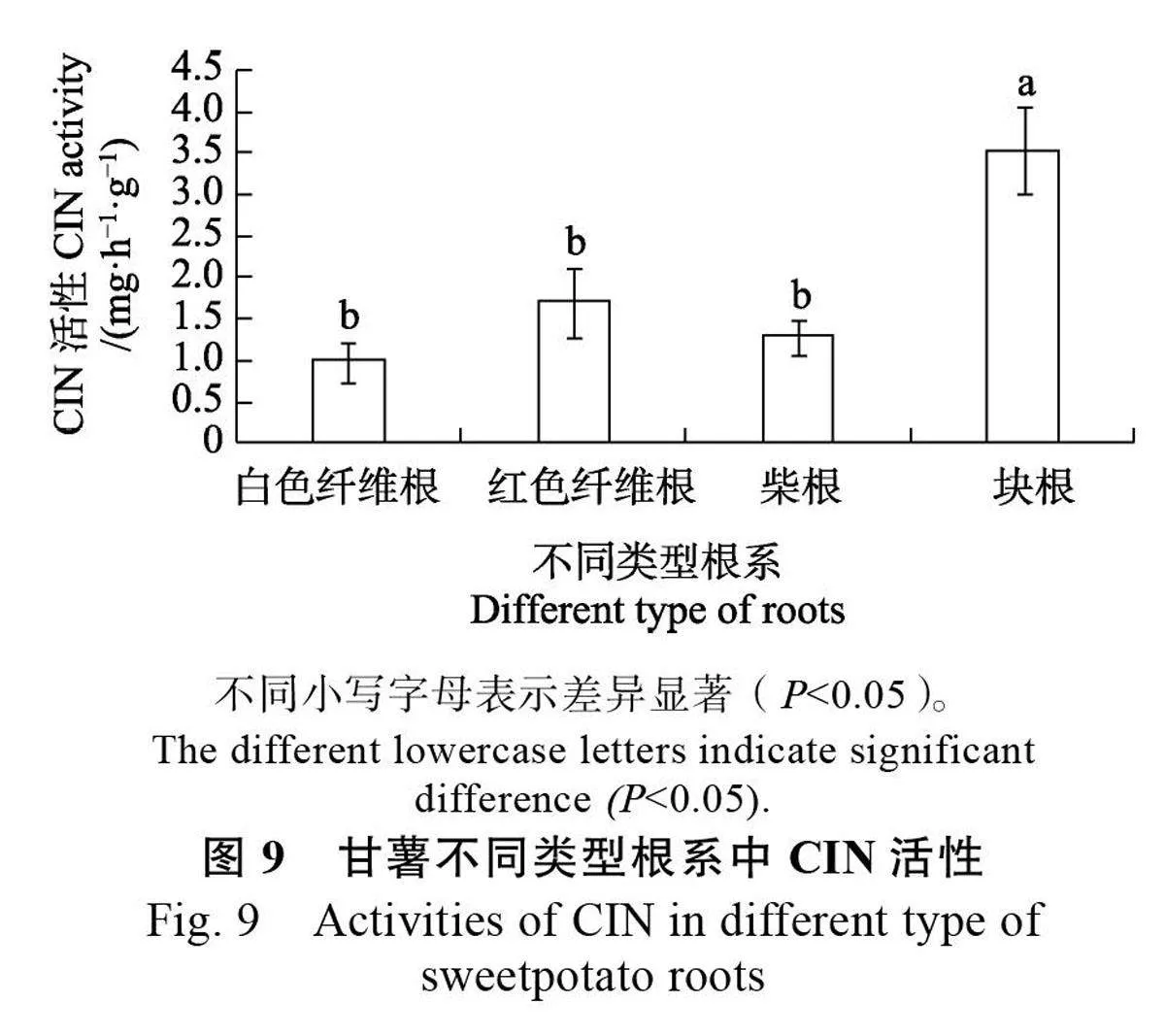
2.8 甘薯不同類型根系CIN 活性分析
甘薯不同類型根系的CIN 活性測定結果顯示,塊根中的CIN 活性顯著高于白色纖維根、紅色纖維根、柴根,且在這3 種根系中的CIN 活性差異不顯著(圖9)。表明CIN 在塊根膨大中發揮著重要的作用。不同類型根系IbCIN 基因的表達分析表明,塊根中只有4 個IbCINs(IbCIN4、IbCIN8 和IbCIN11-12)的表達水平顯著高于其他類型根系。推測IbCIN4、IbCIN8和IbCIN11 是決定塊根CIN 活性的關鍵基因,也是影響甘薯塊根膨大關鍵CIN 基因。
3討論
CIN 在植物中廣泛存在,可通過不同途徑調控植物根系的生長發育。首先,CIN 可通過促進根系中蔗糖的分解降低其濃度,最終促進蔗糖由葉片向根系的轉運,為根系生長提供碳骨架和能量,如EMS 誘導水稻CIN 基因OsCyt-inv1 突變導致根系己糖含量下降,同時根系伸長區細胞皺縮和根系變短,而外源供應3%葡萄糖可以恢復根系生長,表明蔗糖向根系的轉運和分解受阻可能是根系生長受阻的重要原因[22]。其次,過氧化物酶(peroxidase, POD)是木質素合成過程中的關鍵酶[43-44],而CIN 可抑制POD 的表達[34],因此推測CIN 可通過抑制POD 來減緩植物根系木質化進程,從而促進根系的生長發育。此外,CIN 還可通過糖信號途徑對植物根系發育進程進行調控[19],如,CIN 可通過調控葡萄糖含量來影響擬南芥根系發育關鍵激素ABA 的合成和信號轉導[23]。本課題組前期對不同發育時期塊根中的4 種蔗糖分解酶活性測定和相關性分析也表明,CIN 是調控甘薯塊根膨大的關鍵蔗糖分解酶之一[45]。
近年來,多種植物的CIN 基因家族已經被鑒定出來并進行相應的功能研究。本研究首次在甘薯基因組中鑒定出12 個CIN 基因家族成員,并依據其在染色體上的先后順序命名為IbCIN1-12。這和其他植物物種中鑒定出的CIN 家族成員的數量基本相當,如擬南芥為9 個[10],水稻為8 個(OsNINV1-8)[10],木薯為10 個(MeNINV1-10)[27],楊樹為16 個(PtrNINV1-16)[26]。對甘薯CIN 家族蛋白理化性質分析表明, IbCIN 蛋白中除IbCIN10 外不穩定指數均大于40,為不穩定蛋白,這與前人的研究結果一致,即與CWIN 和VIN 不同,由于CIN 蛋白沒有糖基化,導致其結構不穩定,非常容易分解[9]。此外,12 個IbCIN 蛋白均含有CIN 蛋白特有的Glyco_hydro_100 保守結構域,上述結果表明,這12 個IbCINs 確實屬于CIN基因家族。
通過測定IbCIN 在不同組織中以及不同類型根系中的表達水平, 推測在塊根中高表達的IbCIN4、IbCIN8 和IbCIN11 基因可能為調控甘薯塊根膨大的關鍵CIN 基因。對不同類型根系中CIN 活性的測定表明,上述3 個基因在塊根中同時也表現出更高的CIN 活性,進一步證明IbCIN4、IbCIN8 和IbCIN11 等3 個基因可能是調控甘薯塊根膨大的關鍵CIN 基因。通過構建系統發育樹和親緣關系分析,發現IbCIN1、IbCIN7、IbCIN10和IbCIN12 等4 個基因與擬南芥和木薯根系發育相關CIN 基因的親緣關系較近,推測這4 個基因可能也和甘薯根系發育密切相關。然而,和其他組織部位(葉片、花和莖)、其他類型根系相比,這4 個基因在塊根中的表達水平并不是最高,可能不是調控甘薯塊根膨大的關鍵基因。推測這4個基因可能與非塊根類型根系的發育密切相關,例如IbCIN7、IbCIN10 在白色和紅色纖維根中表達水平較高,而IbCIN12 在柴根中表達較高。生物信息學分析結果也從不同角度揭示IbCIN4、IbCIN8、IbCIN11 基因可能通過不同機制調控甘薯塊根的發育。
首先,在這3 個基因中,IbCIN8 屬于α1 亞組,位于質體中,而IbCIN4 和IbCIN11 屬于β 亞組,位于細胞質中。質體作為儲藏淀粉、蛋白質和脂肪等生物大分子的細胞器,在甘薯中主要用來儲藏淀粉。上述證據表明,位于質體中的α1亞組IbCIN8 可通過分解蔗糖為質體自身的發育提供能量和物質供應,從而為淀粉的儲藏提供場所和空間,而位于細胞質中的β 亞組IbCIN4 和IbCIN11 可通過分解蔗糖降低塊根中蔗糖的濃度,從而促進蔗糖由葉片向塊根轉運,為塊根的膨大和淀粉的合成提供能量和碳骨架。因此,這3 個IbCIN 基因可能協同合作,共同通過促進蔗糖向塊根的轉運以及分解代謝來促進塊根的生長發育。
其次,這3 個基因中IbCIN4 和IbCIN11 均屬于β 亞組。保守基序和基因結構分析表明,α1、α2亞組成員之間在保守基序和基因結構上差異較小、相對保守,而β 亞組成員之間則差異較大,表明β 亞組CIN 基因在甘薯栽培種的進化過程中經歷了結構缺失和變異,這可能導致其在功能上的多樣化,從而可以參與更多的生物過程[37],包括塊根的生長發育。本課題組前期的研究也表明,甘薯2個近緣野生種I. trifida 和I. triloba 均具有10個CIN基因成員,且這20 個CIN 基因的保守基序和基因結構與甘薯栽培種的α1、α2亞組更相似,而與甘薯栽培種的β亞組差異較大(結果未列出)。由于2個近緣野生種根系基本不發生膨大,從而推測β 亞組的IbCIN4 和IbCIN11 可能與甘薯塊根的膨大密切相關。
最后,研究表明對于塊根/塊莖作物,開花會抑制塊根/塊莖的膨大[38]。在光周期響應方面,甘薯屬于短日照植物,短日照會促進其開花,但會抑制塊根膨大。通過分析甘薯CIN 基因的啟動子順式作用元件,發現在12 個IbCIN 基因中,IbCIN8具有最少的光響應元件,推測其不受光周期影響,從而可以抑制開花并促進塊根膨大。此外,研究表明赤霉素促進木質化從而抑制甘薯塊根的形成和生長[41],而IbCIN4 和IbCIN8 都不包含赤霉素響應元件,因此推測IbCIN4 和IbCIN8 可能通過減弱赤霉素信號轉導來促進塊根膨大。
通過對甘薯CIN 基因家族進行鑒定,本研究共獲得12個甘薯CIN 基因家族成員。通過對甘薯CIN基因在不同組織部位和不同類型根系中表達的特異性分析,初步鑒定出IbCIN4、IbCIN8和IbCIN11在塊根中的表達高于其他組織部位和其他類型的根系,與這3 個CIN 基因在塊根中的高表達相對應,塊根中的CIN活性也顯著高于其他類型根系,因此IbCIN4、IbCIN8和IbCIN11可能是調控甘薯塊根膨大的關鍵CIN基因。此外,通過系統發育樹分析、保守基序和基因結構分析、基因啟動子順式作用元件分析,進一步證明這3個基因可能通過調控蔗糖轉運和代謝、光周期反應和赤霉素信號轉導等途徑和機制來共同促進甘薯塊根的發育。本研究可為后續通過轉基因技術等手段深入研究甘薯CIN 基因的功能奠定基礎。

