象耳豆根結線蟲2齡幼蟲生防細菌的篩選及其促生特性評價


關鍵詞:象耳豆根結線蟲;生物防治;葡萄球菌;芽孢桿菌;促生特性
中圖分類號:S432.4.5 文獻標志碼:A
根結線蟲(root-knot nematode)是側尾腺綱墊刃目異皮總科根結線蟲科根結線蟲屬的動物,是造成植物根結線蟲病的罪魁禍首,是危害世界各地糧食、蔬菜生產的主要病原之一,每年都會對世界農作物造成巨大損失[1]。根結線蟲生活史包括卵-幼蟲-成蟲3 個階段,在從卵中孵化出來到重新寄生植物這段時間其一直為2 齡幼蟲蟲態,2 齡幼蟲也是它們唯一具備遷移能力的階段,也是從該階段開始寄生植物,線蟲寄生植物后,其吻針會刺傷宿主并吸取寄主營養,并在作物根系上形成根結,影響宿主對營養的吸收而造成植株矮小、發黃、減產甚至絕收;此外,線蟲給宿主造成的傷口會增加作物感染其他病害的幾率,與其他病害形成復合侵染,加重病害發生,根結線蟲種類超過90 種,其寄主范圍廣泛,不同種類之間致病能力差異較大,且分布在各地的優勢種群不同,所以在生產上造成的危害也有差別[1-4]。象耳豆根結線蟲(Meloidogyne enterolobii)是目前我國記錄的根結線蟲中值得關注的一種,其對作物的危害與其他根結線蟲類似,此外,象耳豆根結線蟲繁殖水平高,具有克服Mi、N 和Rk 等抗性基因的能力,易對作物造成嚴重損害。目前在熱帶、亞熱帶和地中海地區已經發現有象耳豆根結線蟲危害,且一些國家已將其列為檢疫性病原[5-7]。據調查,象耳豆根結線蟲在我國海南島已經廣泛存在,并且可以在海南島的主要栽培作物,如葫蘆科作物、茄果類作物、南藥植物、蔬菜作物以及一些熱帶水果上廣泛寄生,且有由南向北逐漸擴展的趨勢[8-11],因此研究適宜的象耳豆根結線蟲防治方法對防止其繼續擴散,減輕其對作物威脅意義重大。
目前尚未發現方便、高效的植物根結線蟲防治方法。在農業生產中,主要采取物理防治、化學防治、農業防治、生物防治等方法。生物防治相較于傳統的防治手段具有巨大的優勢,如降低農藥殘留,減輕環境污染等,此外生物防治還具有持效期長、改善土壤生態等優點[12]。自然界中,尤其是根結線蟲病害高發地的土壤中存在著大量具有殺線蟲活性的細菌, 其中以芽孢桿菌屬(Bacillus sp.)細菌的潛力尤為突出。芽孢桿菌屬在自然界中廣泛存在,在許多土壤生態環境中占據優勢地位,也可在植物表面以及水體中存在,可產生芽孢,對高溫、輻射化學藥品等強烈的物理化學刺激有較強的抵抗能力[13]。芽孢桿菌屬種類繁多,生理特性多樣可產生多種抗生素,包括脂肽類、肽類、磷脂類、多烯類、氨基酸類、核酸類物質,對多種動、植物及人類病原菌起到很好的抑制作用[14-16]。許多芽孢桿菌屬已被報道具有良好的生防效果。2014 年至今,我國有116 種芽孢桿菌類生物農藥在中國農藥信息網中登記,其中4 種具有殺線蟲作用,分別為堅強芽孢桿菌、甲基營養型芽孢桿菌、蠟質芽孢桿菌以及殺線蟲芽孢桿菌,芽孢桿菌是一類極具開發潛力的細菌。
因此,為遏制根結線蟲對果蔬作物造成的危害,亟需研發新的綠色安全的防治方法。本研究采用浸漬法篩選,從海南霸王嶺采集的土壤樣品中分離出的細菌中篩選出具有較高殺線活性的菌株并進行種類鑒定,同時開展菌株對象耳豆根結線蟲2 齡幼蟲的致死條件優化篩選,研究結果將豐富植物根結線蟲生物防治的微生物資源,并為后續研發高活性的生防殺線蟲產品奠定基礎。
1 材料與方法
1.1 材料
1.1.1 供試菌株與線蟲 生防菌株由中國熱帶農業科學院環境與植物保護研究所微生物資源與利用實驗室分離、保存后提供;象耳豆根結線蟲由中國熱帶農業科學院環境與植物保護研究所蔬菜病害與線蟲課題組分離、鑒定、擴繁保存后提供。
1.1.2 主要培養基及配方 LB 培養基:氯化鈉10 g,酵母粉5 g,胰蛋白胨10 g,瓊脂15 g,蒸餾水1000 mL(液體培養基不加瓊脂)。
PDA 培養基:馬鈴薯200 g,葡萄糖20 g,瓊脂15 g,蒸餾水1000 mL。
普通肉湯培養基:氯化鈉5 g,蛋白胨20 g,牛肉粉5 g,蒸餾水1000 mL,pH 7.4~7.6。
羧甲基纖維素鈉剛果紅培養基:硫酸銨0.5 g,羧甲基纖維素鈉5 g,磷酸氫二鉀0.25 g,七水硫酸鎂0.1 g,剛果紅0.4 g,瓊脂16 g,蒸餾水1000 mL。
酪蛋白培養基:NaCl 2.5 g,Na2HPO4 2 g,干酪素10 g,牛肉膏3 g,瓊脂10 g,蒸餾水1000 mL。
以上培養基均在121 ℃條件下滅菌20 min。生理生化鑒定培養基的配制參照《微生物學實驗》第2 版[17]。
1.2 方法
1.2.1 殺線活性菌株的篩選鑒定 (1)象耳豆根結線蟲2 齡幼蟲獲取。供試象耳豆根結線蟲分離自海南文昌患病番茄和辣椒的病根,經中國熱帶農業科學院環境與植物保護研究所植物線蟲研究實驗室鑒定確認種類[9]。將病根洗凈后剪碎,用清水浸沒,按水∶次氯酸鈉溶液=200∶1.5 加入次氯酸鈉溶液,用絞肉機攪拌2~4 下,再手搖5~8 min。將300、400、500 目的網篩從上到下依次疊放,將根系倒入篩網之后用水沖洗揉搓,將500目網篩收集的卵于清水中室溫孵化,孵化后即為2齡幼蟲,每天收集備用。
(2)細菌發酵液制備。將保存的細菌活化后接種于裝有50 mL LB 液體培養基的150 mL 錐形瓶中,在180 r/min,37 ℃條件下培養24 h。將培養液于10 000 r/min,離心4 min,上清液即為細菌發酵液原液,于4 ℃保存,備用。
(3)生防菌發酵上清液對象耳豆根結線蟲2齡幼蟲的防效試驗。吸取900 μL 生防菌發酵液的5 倍稀釋液于24 孔板中,再加入100 μL 2齡幼蟲懸浮液(約含100 頭線蟲),混勻后常溫處理24 h,每處理設置2 個重復,以清水組為對照。處理完成后收集處理液以清水定容至8 mL,2000 r/min,離心2min,去上清,再定容至8 mL 重懸4 h 以上,然后在解剖鏡下觀察,統計死亡線蟲數,線蟲僵直不動且對機械觸碰無反應的視為死亡。根據以下公式計算:
1.2.2 菌株鑒定" (1)形態學鑒定。將生防菌株接種在LB 固體培養基上培養24 h 后觀察其菌落大小、顏色、質地、形狀和濕潤程度等。
(2)生理生化鑒定。菌株的糖發酵、甲基紅、乙酰甲基甲醇、過氧化氫酶、苯丙氨酸脫氫酶試驗參照《微生物學實驗》第2 版[17]。
(3)分子生物學鑒定。將菌株用LB 液體培養基培養12 h 后離心收集菌體,用CTAB 法提取DNA,–20 ℃保存備用。使用通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′ 對菌株的16SrRNA 序列進行擴增。反應體系為50 μL ,2×PCRMix 25 μL,引物各2 μL,DNA模板為2 μL,ddH2O 為19 μL。PCR 擴增程序如下:95 ℃預變性5 min;94 ℃變性30 s,60 ℃退火50 s,72 ℃延伸1 min,共35 個循環;72 ℃延伸10 min。反應結束后將產物回收,送至生工生物工程(上海)股份有限公司進行測序,返回的序列在NCBI 上進行序列比對,同時用MEGA 7.0 軟件以鄰接法構建系統發育樹,結合形態學觀察結果與生理生化鑒定結果確定生防菌株的種屬。
1.2.3 菌株殺線條件優化 (1)種子液制備。用牙簽挑取1.2.1 篩選獲得的3 株生防菌株的單菌落,分別接種于10 mL 的LB 液體培養基中,于37 ℃、180 r/min 搖培過夜作為種子液,備用。
(2) 優勢發酵培養基的篩選。分別吸取100 μL 3株生防菌株的種子液,接種于LB、PDA以及普通肉湯培養基中,于37 ℃、180 r/min 培養后對其發酵上清液進行殺線活性測定。
(3)優勢發酵時間的篩選。分別吸取100 μL3 株生防菌株的種子液,接種于篩選出的優勢培養基中,于37 ℃、180 r/min 進行搖培,分別在第3、5、7、10 天收集發酵上清液進行殺線活性測定。
(4)"對線蟲處理時間的篩選。分別吸取100 μL 3 株生防菌株的種子液,在篩選出的優勢發酵條件下,于37 ℃、180 r/min 進行培養,將其發酵上清液分別處理線蟲24、48、72 h 后,測定發酵上清液在不同處理時間的殺線活性。
1.2.4 促生特性評價" (1)分別對菌株的產吲哚乙酸(IAA)[18]、鐵載體[19]、蛋白酶[20]以及纖維素酶[21]能力進行測定。
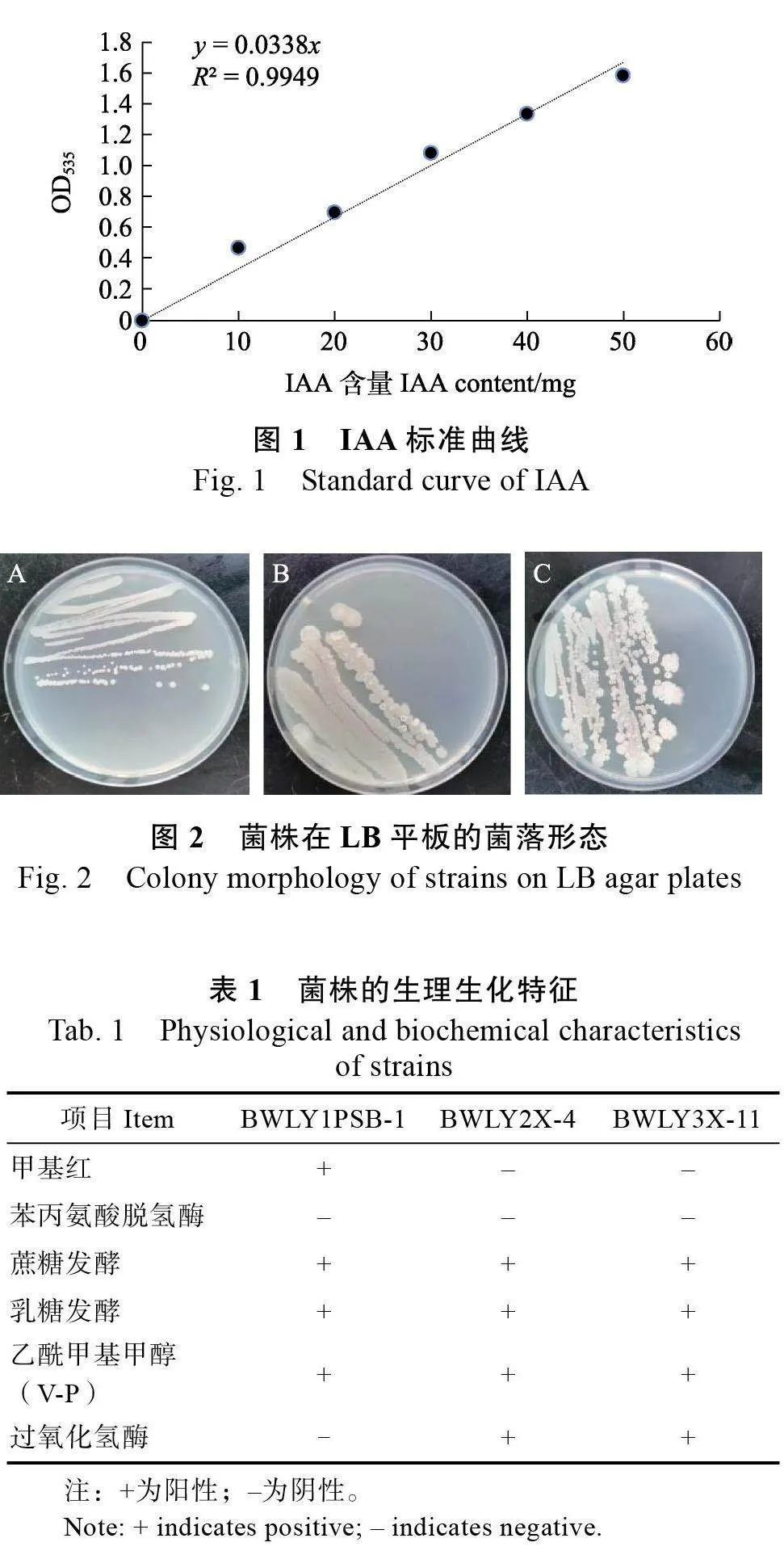
(2)IAA 標準曲線繪制。IAA 標準曲線濃度依次為0、10、20、30、40、50 mg/mL,各吸取2 mL 標準液加入試管中,加入等體積的Salkowski試劑混合均勻,在黑暗中靜置30 min,于535 nm波長測定其吸光值(OD值),記錄數據并繪制IAA標準曲線(圖1),y=0.0338x(R2=0.9949)。
1.3 數據處理
采用Excel 2010和SPSS 19.0軟件對試驗數據進行統計分析。采用LSD法進行多重比較,采用Pearson 法進行相關性分析,利用Excel 2010軟件制圖。
2 結果與分析
2.1 生防菌株的篩選
通過對分離后的菌株進行殺線活性評價,篩選到具有殺線活性的菌株: BWLY1PSB-1 、BWLY1PSB-4、BWLY1X-9、BWLY2X-4、BWLY3X-11、QHY2X-18(透明),其中BWLY1PSB-1、BWLY3X-11 和BWLY2X-4 三個菌株的5 倍稀釋液對象耳豆根結線蟲2 齡幼蟲的校正死亡率較高,分別為73.18%、71.92%和66.13%,因此,選取這3 個菌株開展后續試驗。
2.2 生防菌株的鑒定
2.2.1 形態觀察及生理生化鑒定 形態學觀察表明,菌株BWLY1PSB-1 的菌落(圖2A)乳白色,不透明,圓形,邊緣規則,光滑,表面凸起,濕潤,革蘭氏染色結果為陽性;菌株BWLY2X-4 的菌落(圖2B)白色,不透明,圓形,邊緣呈光滑齒狀, 干燥, 革蘭氏染色結果為陽性; 菌株BWLY3X-11 的菌落(圖2C)白色,不透明,圓形或不規則,干燥,培養3 d 后,中間塌陷,革蘭氏染色結果為陽性。經形態特征鑒定,可初步判斷3株菌均為細菌。
BWLY1PSB-1 的甲基紅、蔗糖發酵、乳糖發酵、乙酰甲基甲醇(V-P)試驗結果均呈陽性,苯丙胺酸脫氫酶與過氧化氫酶試驗為陰性。BWLY2X-4 與BWLY3X- 11 的蔗糖發酵、乳糖發酵、V-P、過氧化氫酶試驗結果均呈陽性,甲基紅、苯丙胺酸脫氫酶試驗為陰性(表1)。
2.2.2 菌株16S rRNA 序列測定及系統發育分析菌株BWLY1PSB-1、BWLY2X-4、BWLY3X-11的16S rRNA 長度分別為1449、1451、1448 bp,將所得序列分別在NCBI 上進行比對,運用MEGA7.0 軟件構建進化樹(圖3,圖4)。
綜合菌株的菌落特征、生理生化特性與系統發育樹,將BWLY1PSB-1 鑒定為巴氏葡萄球菌(Staphylococcus pateuri),菌株BWLY2X-4 鑒定為甲基營養芽孢桿菌(Bacillus methylotrophicus),BWLY3X-11 鑒定為芽孢桿菌屬細菌(Bacillus sp.)。
2.3 3 株生防菌對象耳豆根結線蟲2齡幼蟲的致死條件優化
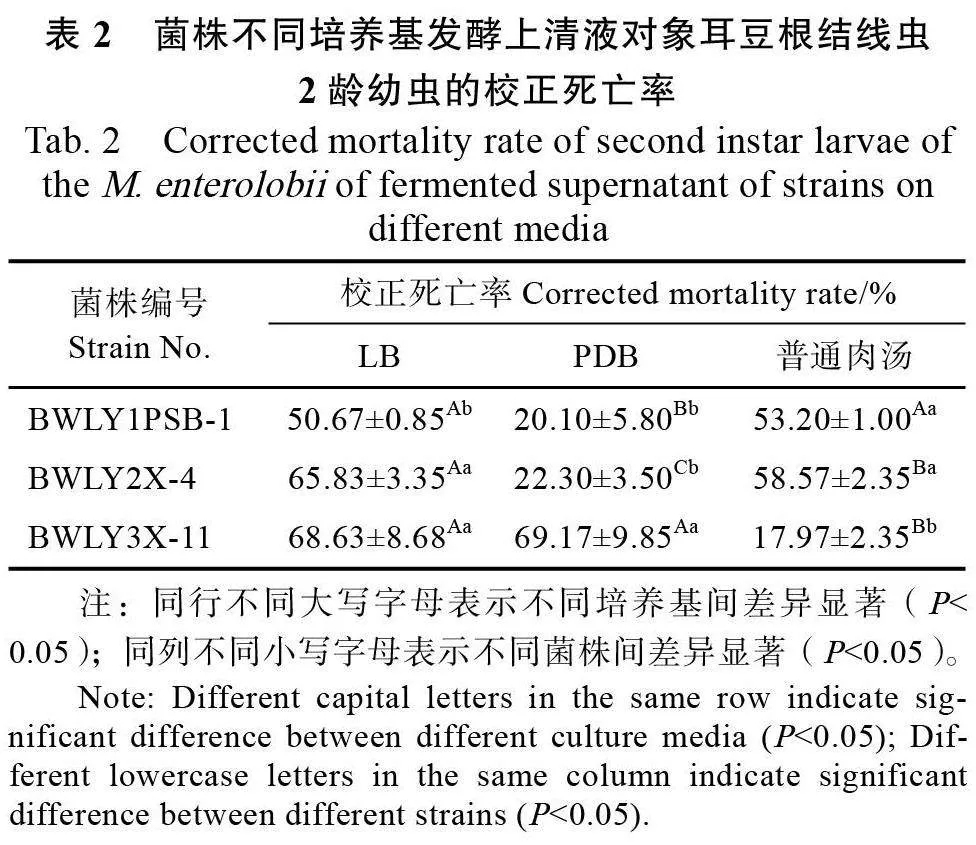
2.3.1 菌株不同培養基發酵上清液對象耳豆根結線蟲的致死效果 菌株BWLY1PSB-1、BWLY2X-4、BWLY3X-11分別在LB、PDB、普通肉湯培養基中培養后對象耳豆根結線蟲2 齡幼蟲的致死率結果見表2。菌株BWLY1PSB-1、BWLY2X-4 的LB、普通肉湯培養基的發酵上清液對線蟲的殺線活性顯著優于PDB 培養基;而BWLY3X-11在LB 和PDB培養基中的殺線蟲活性顯著優于普通肉湯。同時,3株菌株的LB培養基上清液對線蟲的致死率無顯著性差異,因此,選擇LB培養基開展后續的培養時間與處理時間的優化試驗。
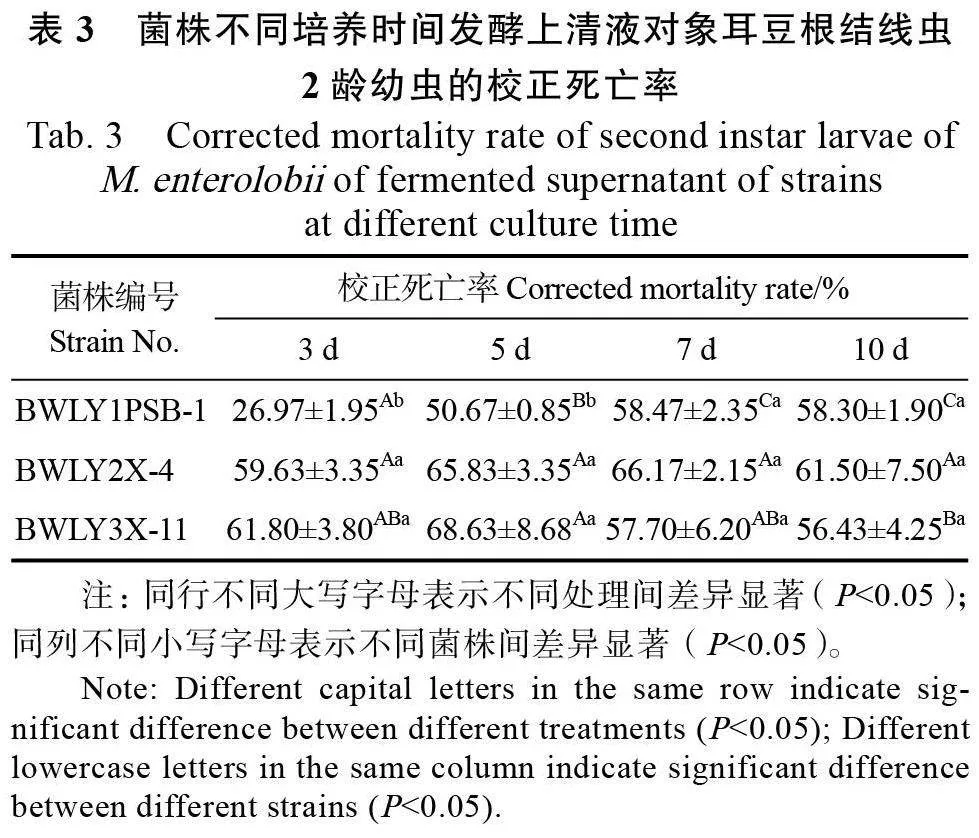
2.3.2 菌株不同培養時間發酵上清液對象耳豆根結線蟲的致死效果 菌株BWLY1PSB-1、BWLY2X-4、BWLY3X-1 在不同培養時間下發酵上清液對象耳豆根結線蟲2齡幼蟲的致死率見表3。菌株BWLY1PSB-1 在第7 天達到最大殺線蟲活性,并保持平穩;菌株BWLY2X-4在第7 天達到峰值,但不同培養時間之間無顯著性差異; 菌株BWLY3X-11 在培養到5d時達到最大殺線蟲活性,但第7天與第10天的發酵上清液的殺線蟲活性會有所下降。3個菌株均培養5d后對線蟲達到較好的致死率,因此選擇培養5 d 的生防菌液開展對線蟲處理時間的優化試驗。
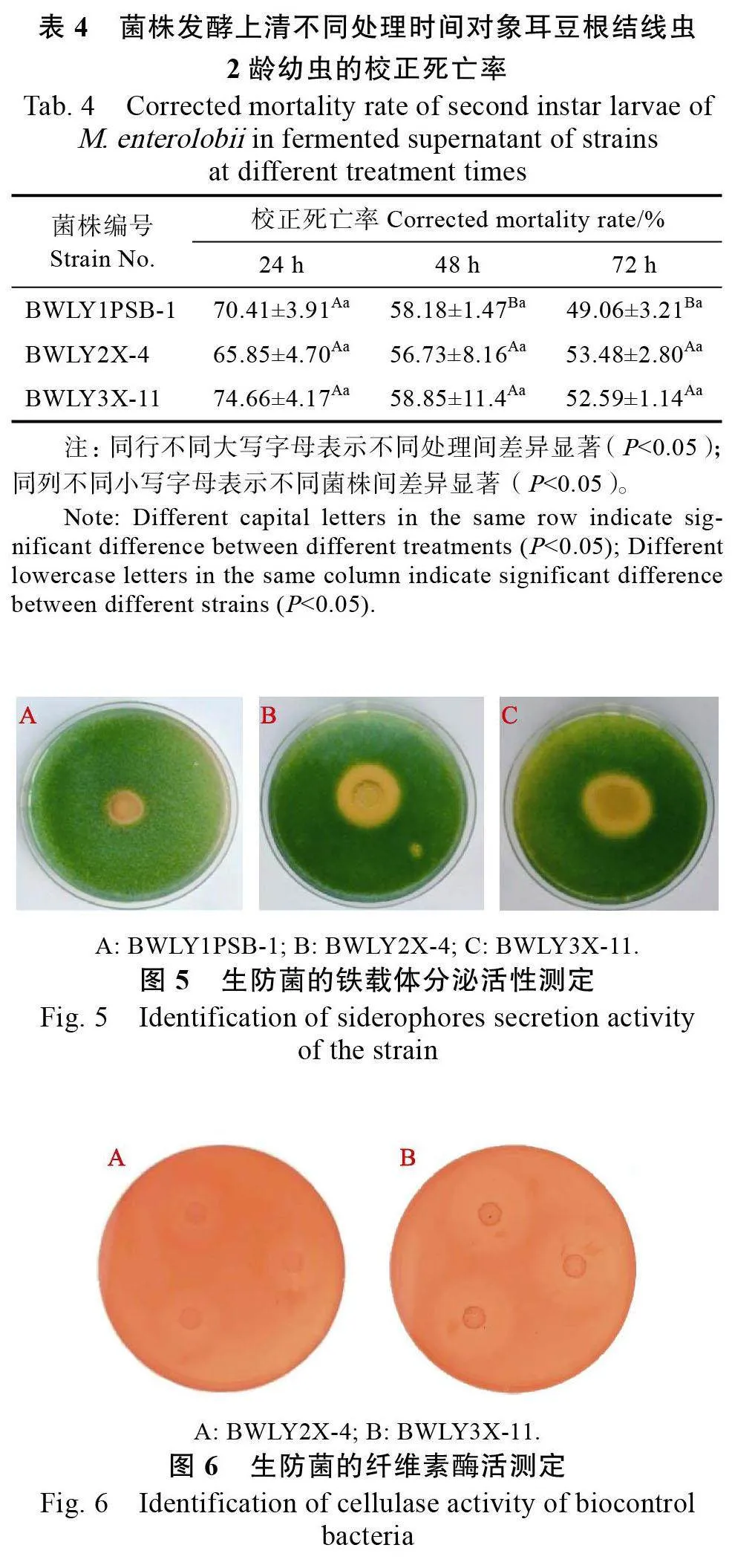
2.3.3 菌株發酵上清液不同處理時間對象耳豆根結線蟲的致死效果 選擇培養5 d 的生防菌液開展對線蟲處理時間的優化試驗,3株生防菌發酵上清液不同處理時間對象耳豆根結線蟲2 齡幼蟲的致死率見表4。3株生防菌的殺線蟲活性在處理24h時均達到最大,隨著處理時間的延長,3 株菌的殺線活性均逐漸下降。
2.4 生防菌株的促生特性評價
研究表明,3株生防菌均具有產IAA 的能力,向菌液中加入Salkowski 試劑黑暗靜置0.5 h 后,與CK 相比混合液產生明顯的顏色變化,通過測定其吸光度,BWLY1PSB-1、BWLY2X-4 和BWLY3X-11 的吸光度分別為0.6828、0.4592、0.5586,將數值代入圖1 中的方程,計算出BWLY1PSB-1、BWLY2X-4 和BWLY3X-11 菌液中的IAA 濃度分別為20.20、13.58、16.53 mg/L,菌株BWLY1PSB-1的產IAA 能力最強。
3 株生防菌均具有分泌鐵載體的能力(圖5)。培養1d后,BWLY2X-4、BWLY3X-11 菌落周圍出現黃色暈圈;培養時間達到3 d 時,BWLY1PSB-1周圍也出現黃色暈圈;而BWLY3X-11 產生黃色暈圈的速度最快,現象更明顯,其分泌鐵載體的潛力更強。
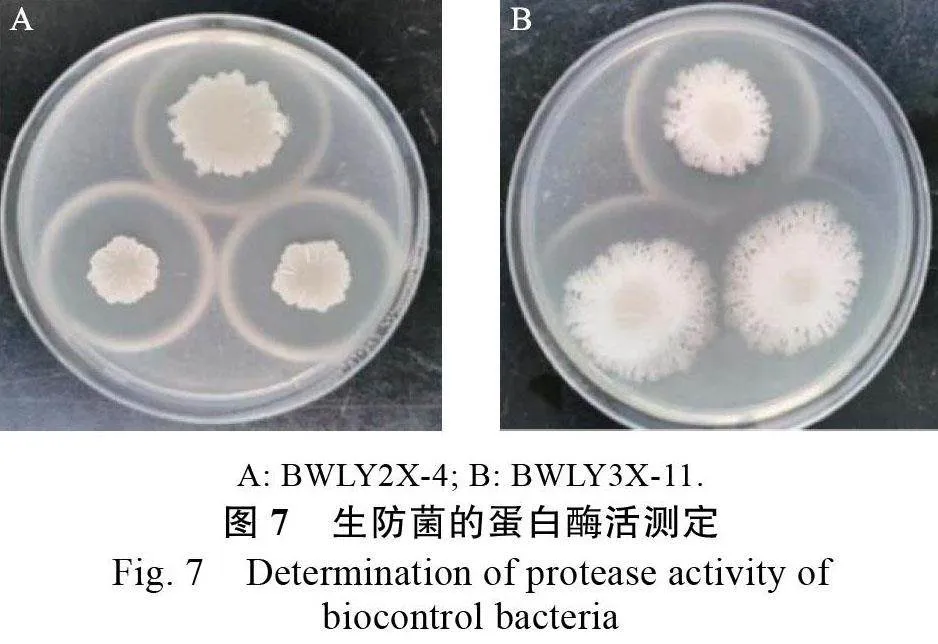
研究表明,菌株BWLY2X-4、BWLY3X-11均具有纖維素酶活性(圖6)和蛋白酶活性(圖7),而BWLY1PSB-1 不具有這2 種水解酶活性,且不能在酪蛋白培養基上生長。
3 討論
目前所采取的病蟲害防治方法中生物防治具有巨大的優勢,其對于環境和人類的損害最小,更加貼合綠色環保的理念。由于成本低,使用簡單,具有殺線蟲活性的微生物的篩選與應用成為防治植物根結線蟲的一大研究熱點[22-23]。姚思敏等[24]發現1 株具有殺線蟲活性的巨大芽孢桿菌(B.megaterium),其盆栽試驗和田間試驗結果均顯示出對擬禾本科根結線蟲具有較好的防治效果,田間試驗的防治效果最高可達56.3%。NGUYEN 等[25]從黑胡椒根際中分離出20 株殺線活性較好的生防菌,經鑒定,其中有14 株屬于芽孢桿菌屬細菌,史鳳玉等[26]從野生大豆中分離出2 株對大豆孢囊線蟲具有良好殺線活性的枯草芽孢桿菌和巨大芽孢桿菌,張立強等[27]在海南尖峰嶺熱帶雨林土壤中分離出1 株蘇云金芽孢桿菌,對松材線蟲和南方根結線蟲具有良好的殺線活性且效果穩定。中國農藥信息網數據顯示,近幾年也有登記芽孢桿菌類的生物農藥,陜西恒田生物農業有限公司2018 年登記了一款以甲基營養型芽孢桿菌LW-6為主要成分的生物農藥,可用于防治番茄根結線蟲,此外還有堅強芽孢桿菌、蠟質芽孢桿菌、殺線蟲芽孢桿菌等,說明生防芽孢桿菌在防治線蟲上的應用具有巨大的潛力。而有關利用葡萄球菌防治根結線蟲的研究較少,袁莉[28]篩選出1 株沃氏葡萄球菌,對擬禾本科根結線蟲具較好的防效。于豐源[29]篩選出1 株殺線活性達91.75%的菌株,經鑒定確定為松鼠葡萄球菌,但葡萄球菌對人體的危害以及是否有應用于實際生產的潛力仍未知,需再進一步研究。
微生物對植物的促生作用包括產鐵載體、分泌植物激素、產水解酶(蛋白酶、淀粉酶等)等途徑,IAA 是調控植物生長的重要信號物質,是促進植物生長的激素,鐵載體又稱為嗜鐵素,是微生物產生的金屬螯合物質,在低鐵環境中,微生物產生的鐵載體能夠還原Fe3+為Fe2+供植物吸收[30-31]。通過對3 株生防菌的促生特性進行測定,發現3 株菌均具有產IAA和鐵載體能力,BWLY2X-4 和BWLY3X-11 還能產生纖維素酶和蛋白酶,具有良好的促生潛力。程鑫宇等[32]通過分離產IAA的根際促生菌并將其用于鹽堿脅迫下的玉米和小麥,發現其對鹽堿脅迫具有較好的緩解作用。朱森林等[33]發現1 株解淀粉芽孢桿菌對香蕉枯萎病4 號生理小種具有較好的防效,同時也能促進香蕉的生長發育,通過測定發現該菌株為高產鐵載體菌株且能分泌IAA。本研究中的3 株生防菌具有殺線活性的同時還具有一定的促生特性,推測其在防治象耳豆根結線蟲的同時還能在一定程度上促進作物的生長發育。
4 結論
本研究通過浸漬法從本實驗室分離的一批細菌中篩選出3 株殺線活性較好的菌株(BWLY1PSB-1、BWLY2X-4 和BWLY3X-11),并對其發酵的培養基、時間以及處理時間進行了優化;通過研究其促生特性發現3 株菌均具有產IAA 和鐵載體的能力,BWLY2X-4、BWLY3X-11 還具有產蛋白酶和纖維素酶的能力,具有一定的促生特性。本研究初步篩選出既有高效防控植物根結線蟲又具促生特性的優良菌株,豐富了植物根結線蟲生物防治的微生物資源,但由于本研究僅進行了室內試驗,仍需開展小區與大田試驗驗證3 株生防菌對線蟲的防控效果及對作物的促生能力。

