睡眠效率相關的皮質醇覺醒反應的變異性及其與特質焦慮和心理彈性的關系



摘 "要""皮質醇覺醒反應(CAR)與個體心理健康的關系仍存在爭議。為此, 本研究引入多天內CAR變異性作為新指標, 以彌補傳統CAR平均量指標因受狀態類因素影響而導致研究結論不一致的問題, 并探究其與特質焦慮和心理彈性的關系。實驗1通過自然睡眠情境降低睡眠效率的變異來降低CAR變異性, 發現自然睡眠日下的CAR變異性與特質焦慮分數之間呈顯著的正相關, 說明穩定環境下較小的CAR變異性伴隨著個體較低的特質焦慮水平。實驗2則通過完全睡眠剝奪的操縱提高CAR變異性, 發現睡眠剝奪前后的CAR變異性與心理彈性呈顯著的正相關。說明變動環境下較大的CAR變異性伴隨著個體較高的心理彈性水平。與之相對, 兩項實驗中的CAR均值均未表現出與特質焦慮或心理彈性的顯著相關。上述結果表明, 在CAR均值外, 還可以考慮CAR變異性作為衡量心理健康更為有效的生理指標。在多天內考慮CAR變異性對于理解個體如何適應日常生活中的壓力和挑戰具有重要意義, 并且可以為促進心理健康和設計有效的干預策略提供新的視角和可能的思路。
關鍵詞""皮質醇覺醒反應, 變異性, 睡眠效率, 特質焦慮, 心理彈性
分類號""B845
1 "引言
皮質醇覺醒反應(Cortisol Awakening Response, CAR)作為應激激素皮質醇晝夜節律活動的一部分, 它是指個體的皮質醇水平在覺醒后的30~45分鐘內出現峰值, 并且在1小時內增加50%至160%"(Clow et al., 2004; Pruessner et al., 1997)。由于了解CAR在心理健康中的作用有助于為心理疾病的診斷和治療提供生物標記物, 研究者們尤其關注CAR與心理健康的關系。有研究強調高水平的CAR可能反映了個體積極的心理特征, 這是由于CAR作為一種資源, 其增加有助于個體應對未來的挑戰或工作(Adam et al., 2006; Shi et al., 2018; Wu et al., 2015;"Xiong et al., 2021)。與之相反, 應激適應理論認為長期的生活壓力和應激刺激可能導致身體逐漸調整以降低過度的生理激活(McEwen amp; Stellar, 1993),"這可能表現為CAR的減少。在這個理論框架下, 低水平的CAR可能被視為對應激適應的一種體現, 反映了身體系統的調整以減輕長期的生理負擔。上述矛盾的觀點在Chida和Steptoe (2009)進行的一項元分析中顯得尤為突出。在一些研究中, 疲勞、倦怠等負向心理特征與CAR的減少有關(Oosterholt et al., 2015; Shea et al., 2007; Therrien et al., 2008); 而在另一些研究中, 積極健康的心理特征同樣也與CAR的減少有關(Endrighi et al., 2011; Steptoe et al., 2007; Wüst et al., 2000); 甚至是對于同一心理健康變量(抑郁), 在一些研究中其與CAR的增加有關, 而在另一些研究中則又與CAR的減少有關(Johnson et al., 2008; Therrien et al., 2008)。此外, 也有許多研究發現CAR和心理健康之間或許并不存在著顯著的關聯(Kallen et al., 2008; Nater et al., 2008; Whitehead et al., 2007; Wu et al., 2017)。
值得注意的是, 在二者關系的探討上, 先前的研究通常將CAR在多天內的平均量作為指標, 探討CAR的大小和心理健康之間的關系。這種分析方法主要基于先前的研究將CAR視作是一種穩定的生物標記物, 它在多天內具有較高的穩定性(Powell amp; Schlotz, 2012; Pruessner et al., 1997)。然而, 隨著研究的不斷推進, 越來越多的因素被發現可能會對CAR產生顯著影響, 例如睡眠時間(Stalder et al., 2016)。有研究發現覺醒時間較早的個體通常會伴隨著更高的CAR (Bowles et al., 2022; Edwards et al., 2001); 也有研究發現較短的睡眠時間會伴隨著較高的CAR (Kumari et al., 2009; Wüst et al., 2000)。此外, 有證據表明睡眠質量也和CAR之間存在著密切的聯系(Lasikiewicz et al., 2008; Moon et al., 2023; Torres et al., 2024)。由此可見, 特定的睡眠特征是影響特定CAR水平的一個重要變量, 多天內CAR的變化可能反映了機體對于應激水平的靈活調節以及對不同睡眠情況的靈活適應。因此, 單純使用平均量指標來標記CAR或許無法捕捉到這種適應性變化, 進而導致研究結論出現偏差。
CAR作為調節壓力反應和體內激素平衡的下丘腦?垂體?腎上腺皮質軸(Hypothalamic-Pituitary-"Adrenal Axis, HPA axis)節律性活動的重要產物之一, 在多天內表現出波動性。例如, 個體的CAR在周末和工作日之間存在顯著差異(Okamura et al., 2010; Schlotz et al., 2004)。Mikolajczak等人(2010)的研究進一步發現, 個體在周末和工作日這兩種不同情境下的較大CAR波動伴隨著更高的主觀幸福感得分以及更低的神經質和壓力知覺得分, 表現出一種積極健康的心理狀態。此外, 上述研究還發現, 周末和工作日下的平均CAR與個體心理健康狀態的關系并不一致。反映個體積極心理狀態的主觀幸福感和反映消極心理狀態的壓力知覺均與平均CAR存在顯著的負相關。以上結果表明, 關注CAR在多天內的波動而非其大小, 可能更有助于建立CAR與心理健康關系的一致性聯系。本研究把這種CAR在多天內出現的波動情況定義為CAR變異性, 具體使用多天內CAR指標的標準差來進行量化。相較于傳統的考慮多天內CAR的平均量, 分析多天CAR變異性, 可以更好地捕捉個體生理反應的動態性和波動性。在多天環境相似且預期壓力水平穩定的情況下, 較小的CAR變異性可能表示HPA軸對環境壓力的適應性良好, 心理狀態較為穩定, 從而反映了良好的心理健康狀況(Packard et al., 2016)。另一方面, 環境和內在壓力的顯著變化要求個體的HPA軸能夠靈活調整皮質醇的釋放以適應這些變化。因此, 在多天環境存在顯著變化的情況下, 較大的CAR變異性可能反映個體的HPA軸展現出對不同壓力水平的靈活適應, 這種適應性是心理彈性和應對能力的標志, 有助于個體長期維持心理健康(Abercrombie et al., 2023; Mikolajczak et al., 2010)。
在反映個體心理健康的諸多變量中, 特質焦慮和心理彈性是其中的兩個重要概念, 它們在個體應對壓力、適應變化和維持心理健康方面發揮著關鍵作用。特質焦慮是指個體傾向于經歷焦慮感的穩定人格特征, 它反映了個體在面對潛在威脅時的持續性和普遍性的應激反應(Spielberger et al., 1983)。心理彈性是指個體在面對逆境時恢復力量的能力, 它涉及到個體在遭受壓力、挑戰或失敗后的適應性和恢復能力(Wu et al., 2013)。特質焦慮和心理彈性從兩個不同的維度反映了個體應對壓力和逆境的能力。特質焦慮強調了個體對壓力的敏感性和可能的負面適應方式, 而心理彈性則突出了個體的恢復力和正面適應策略, 同時探討這兩個變量可以提供一個更為全面的視角, 以理解個體如何在心理層面上應對生活中的挑戰。
綜上所述, 本研究試圖將CAR變異性作為反映應激激素皮質醇晝夜節律活動的指標, 分析CAR變異性與特質焦慮/心理彈性二者之間的關系。CAR容易受到睡眠特征的影響(Stalder et al., 2016), 而睡眠效率是個體的主要睡眠特征之一, 是指個體實際的睡眠時間占總上床時間的比重。相較于其他睡眠特征, 睡眠效率可以更為全面地反映一個人睡眠的有效程度, 并在一定程度上反映個體的睡眠質量(Nelson et al., 2022)。研究表明, 個體在經歷整晚的睡眠剝奪后, 次日清晨的CAR會顯著降低, 并且峰值點會發生后移(Vargas amp; Lopez-"Duran, 2020)。另有研究發現, 當對個體的睡眠時間進行限制以降低睡眠效率時, 次日的CAR反而會增強(Lanlokun et al., 2017)。還有研究指出, 當個體在夜間暴露于低頻噪聲而處于較低的睡眠效率條件下時, 次日的CAR會減弱(Waye et al., 2003)。因此, 睡眠效率可能會通過影響個體次日的CAR, 最終導致多天內的CAR產生變異。鑒于此, 在計算CAR變異性指標時, 有必要考慮睡眠效率變化的影響。由于個體的應激激素皮質醇的晝夜節律總體上表現出穩定性(Bowles et al., 2022; Selmaoui amp; Touitou, 2003), 因此在睡眠效率變化較小的情況下, CAR變異性可能也較小。相反, 如果睡眠效率出現大幅波動, 個體的CAR變異性可能會隨之發生顯著變化。為了檢驗以上假設, 實驗1采用睡眠自然觀測的方法, 通過自然睡眠情境降低睡眠效率的變異來降低CAR變異性。在此情境下, 較小的CAR變異性體現了個體積極心理健康的心理特點, 具體表現為更高的心理彈性得分以及更低的特質焦慮得分。實驗2采用睡眠剝奪的方法, 通過提高睡眠效率的變異進而提高CAR變異性, 在此情境下, 較大的CAR變異性更能體現個體積極健康的心理特點, 個體會伴隨著更高的心理彈性得分以及更低的特質焦慮得分。
2 "實驗1:睡眠自然觀測情境下, CAR變異性及其與特質焦慮/心理彈性的關系
2.1""研究目的
通過自然睡眠情境降低睡眠效率的變異來降低CAR變異性, 并探討其與特質焦慮/心理彈性的關系。
2.2 "方法
2.2.1""被試
由于被試需要在多天內進行多次唾液樣本的采集以評估被試的CAR變異性并與特質焦慮和心理彈性得分之間建立聯系。基于此, 為了確保有足夠的統計功效以檢驗預期的效應, 使用R語言中的“pwr”工具包進行樣本量的計算(Haynes et al., 2021)。先前的研究發現, CAR與反映個體心理健康的變量二者之間存在著中到大程度的效應量(Hardeveld et al., 2014; Kudielka amp; Kirschbaum, 2005; Rickard et al., 2016), 根據前人研究中對于效應量大小的劃分(Cohen, 1988), 將效應量(Cohen’s f2)設定為略微大于中等水平的0.3。顯著性水平α設定為0.05, 統計功效1 ?"β設定為0.8。結果顯示至少需要28名被試以確保檢測相關效應。本實驗通過網絡廣告招募了30名健康的大學生作為付費志愿者。由于未能遵守CAR采集協議的原因(Stalder et al., 2016, 2022), 2名被試的數據被排除, 最終樣本包括28名被試, 其中15名為女性(M = 20.33歲, SD = 1.72歲), 13名為男性(M = 19.69歲, SD = 2.06歲)。盡管最近的研究發現女性的生理周期對CAR的影響并不顯著, 即使存在影響也比較小(Stalder et al., 2022), 但是為了盡量避免女性的不同生理周期對實驗結論造成的可能干擾, 本實驗通過使用問卷調查的方法來確認女性被試均處于黃體期。所有參與研究的被試均未患有精神、神經或睡眠障礙, 未服用精神藥物或糖皮質激素藥物, 也未濫用酒精或其他物質。
本實驗已通過西南大學心理學部倫理委員會審核并獲得批準, 所有研究過程均嚴格遵守倫理規范。在正式實驗開始之前, 每位被試都詳細了解了研究目的、過程、可能的風險和收益, 并自愿參與研究。他們同時知曉可以在任何時候退出研究而不受任何懲罰。實驗共計持續3天, 實驗結束后, 專門負責數據質量檢查的研究人員會對數據進行檢查。在確認數據質量無問題后, 向被試發放全額被試費。
2.2.2""心理健康問卷
特質焦慮量表(Trait Anxiety Inventory, TAI), 該量表用于評估個體的長期、特質性焦慮水平(Spielberger et al., 1983)。本研究采用TAI的中文版本(汪向東 等, 1999), 該量表共由20個項目組成, 覆蓋了焦慮癥狀的各個方面。每個項目采用李克特4點評分, 評分范圍從1 (“幾乎從不”)到4 (“幾乎總是”)。總分越高說明受試者特質焦慮水平可能越高, 本研究中該問卷的克隆巴赫系數α為0.90。
心理彈性量表(Connor-Davidson resilience scale, CD-RISC), 該量表用于評估個體在應對壓力、挑戰和逆境時的適應和恢復能力(Connor amp; Davidson, 2003)。本研究采用CD-RISC量表的中文版本(于肖楠, 張建新, 2007), 該量表共由25個項目組成, 每個項目采用李克特5點評分, 評分范圍從0 (“很不符合”)到4 (“很符合”)。量表得分越高說明心理彈性越好, 本研究中該問卷的克隆巴赫系數α為0.87。
2.2.3""睡眠數據采集與分析
使用Actigraph腕表(Phillips Respironics, Inc.)采集客觀睡眠數據。該設備是一款佩戴在主導手腕上的基于加速度計的裝置, 旨在客觀地監測睡眠?覺醒周期和身體活動水平。數據收集和初步分析是通過ActiLife睡眠分析軟件(版本6.13, MiniMitter/"Philips Respironics)完成的。計算以下睡眠指標: 在床時間(Time in Bed, TIB), 被試嘗試入睡到最終醒來的總時長; 覺醒時長(Wake After Sleep Onset, WASO), 被試在首次入睡后到早晨起床之前, 所有覺醒時期的總時長; 實際睡眠時間(Total Sleep Time, TST), 通過從在床時間(TIB)中減去覺醒時長(WASO)計算得出。最后, 客觀睡眠效率(Sleep Efficiency, SE)根據公式SE = (TST/TIB) × 100%, 計算實際睡眠時間占在床時間的百分比。
參與者的主觀睡眠數據是通過睡眠日志來記錄的, 日志包括以下內容:(1)昨晚閉眼準備睡覺的時間; (2)睡著所需時間; (3)早上醒來的時間。基于這些信息, 計算了以下睡眠指標:總在床時間(Total Bed Time, TBT), 早上醒來的時間減去昨晚閉眼準備睡覺的時間; 實際睡眠時間(Total Sleep Time, TST), 總在床時間減去睡著所需時間。最后, 主觀睡眠效率(Sleep Efficiency, SE)根據公式SE = (TST/TBT) × 100%, 計算實際睡眠時間占總在床時間的百分比。
2.2.4""唾液皮質醇采集與分析
被試在每個采集日內需要完成4個唾液樣本的采集, 采集時間點分別為覺醒后的0、30、45和60分鐘。此外, 在每天樣本采集完成前均不得進食、飲用飲料(包括含有酒精、咖啡因或果汁的飲料)、刷牙漱口或吸煙。使用特定的取樣裝置(Salivette, SARSTEDT, Germany)收集被試的唾液樣本。每次采集時, 被試需要將采集管中的棉球直接倒入口中咀嚼1分鐘, 之后將棉球直接吐回采集管內并蓋好蓋子, 采集全程需要避免手的接觸以防止污染。每次采集完成后, 需要將采集管放入用藥檢測系統(MEMSCap? Medication Event Monitoring System, MWV Switzerland Ltd.)中, 以記錄客觀采集時間。在回收完唾液樣本之后, 所有樣本在分析前被保存在?20"℃的冰箱中。
使用酶聯免疫測定法(ELISA, IBL-Hamburg, Germany)來測定皮質醇濃度, 以評估被試的皮質醇晝夜節律活動。皮質醇數據在分析前, 先進行清洗和極端值的處理, 以滿足統計分析的前提。首先, 將皮質醇數據的單位從ug/dl轉換為nmol/l。由于皮質醇數據通常呈正偏態分布, 對其進行平方根轉換(Miller amp; Plessow, 2013; Schlotz, 2011), 轉換后進行正態性檢驗以確保數據符合正態分布。極端值被定義為距離均值3個標準差之外的數據, 并使用相應的上下5%的百分位數對其進行替換(Schlotz, 2011)。
2.2.5""實驗流程
在正式實驗開始之前, 被試需要與主試約定時間前往實驗室進行面對面會談, 這一設計已被證明可以有效提高被試對樣本采集協定的遵從性(Stalder et al., 2016, 2022)。在會談中主試首先向被試介紹睡眠腕表的佩戴方法以及注意事項。在整個實驗期間, 被試需要在午夜零點前準備睡覺并且保持7~9小時充足且規律的睡眠, 過早/過晚的入睡/起床均被禁止。此外, 被試還需要一直佩戴睡眠腕表于自己的慣用手, 腕表要緊貼手部皮膚, 無特殊情況不得取下, 在實驗結束后由主試進行統一回收。然后, 被試被告知唾液采集的流程與注意事項。被試需要在給定的一周時間內任意的選擇適當的3個工作日進行唾液樣本的采集, 所選的采集日需要盡可能的貼近被試的日常生活狀態, 在采集日前后不得有重大的壓力事件, 以便于控制周末、工作日的差異以及壓力因素對CAR造成的影響(Stalder et al., 2016)。被試在每次采集完唾液樣本之后還需要記錄每次采集的具體時間, 采集時間的準確與否會影響被試最終取得的報酬。會談結束后被試填寫相關的人口統計學以及心理健康問卷。
在正式數據采集期間, 主試會與被試在每個采集日之前約定時間以便于提供和回收實驗材料并確認被試是否明確并遵從了實驗中的注意事項。不符合實驗要求的行為以及意外事件被加以記錄, 并在評估了其對數據質量的影響程度后, 對數據進行剔除或保留。此外, 被試在每天清晨還需要在規定時間(8點)及時填寫由主試定時發送的睡眠日志。
2.2.6""數據分析
所有數據均采用SPSS 27.0軟件進行統計分析。在方差分析之前, 對數據進行正態性和方差齊性檢驗, 考慮到重復測量數據可能違反球形假設, 故對于不滿足球形假設的變量采用格林豪斯?蓋斯勒(Greenhouse-Geisser)矯正對自由度進行了調整, 以修正由于違反假設而帶來的統計推斷偏誤。當方差分析結果顯著時, 進一步采用邦弗朗尼(Bonferroni)方法進行事后多重比較。具體而言, 以采集天數(自然日1、自然日2和自然日3)作為自變量, 采用單因素重復測量方差分析檢驗睡眠效率的日間差異。針對皮質醇原始數據, 以每日采集時間點(0分鐘、30分鐘、45分鐘和60分鐘)和采集天數(自然日1、自然日2和自然日3)作為自變量, 通過重復測量方差分析檢驗采集時間點和日間差異的主效應和交互作用。之后在每日采集的4個時間點中, 使用后三個時間點的平均皮質醇水平相對于第一個時間點皮質醇的增加量計算得出平均增加量(Mnlnc)以及4個時間點皮質醇水平的極差(max?min)作為CAR的每日指標(Stalder et al., 2016), 以采集天數(自然日1、自然日2和自然日3)作為自變量, 通過單因素重復測量方差分析檢驗CAR的日間差異。
最后, 在傳統的均值框架和本研究提出的變異性框架下, 分別探討睡眠效率、CAR指標和特質焦慮/心理彈性之間的關系。在均值框架下, 首先計算3天的睡眠效率均值、CAR均值和特質焦慮/心理彈性之間的積差相關, 以探討三者之間的內在聯系, 并揭示睡眠效率是否會對CAR均值和特質焦慮/心理彈性產生影響。所有變量在計算相關前需要進行正態檢驗, 并對不滿足正態分布的變量進行正態轉換, 以確保數據滿足積差相關分析的前提。由于性別可能會對CAR和心理健康產生影響(Almeida et al., 2009; Hollanders et al., 2017; Vargas et al., 2017), 在進一步控制性別及上述相關分析中發現的可能影響CAR均值和特質焦慮/心理彈性的變量后, 計算了CAR均值和特質焦慮/心理彈性之間的偏相關。
在變異性框架下, 首先計算3天的睡眠效率變異性、CAR變異性和特質焦慮之間的積差相關, 探討三者之間的內在聯系, 并揭示3天的睡眠效率變異性是否會對CAR變異性和特質焦慮/心理彈性產生影響。所有變量同樣需要進行正態檢驗和正態轉換。之后, 在進一步控制性別及上述相關分析中發現的可能影響CAR變異性和特質焦慮/心理彈性的變量后, 計算CAR變異性和特質焦慮/心理彈性之間的偏相關。
2.3 "結果
2.3.1""睡眠效率的日間差異
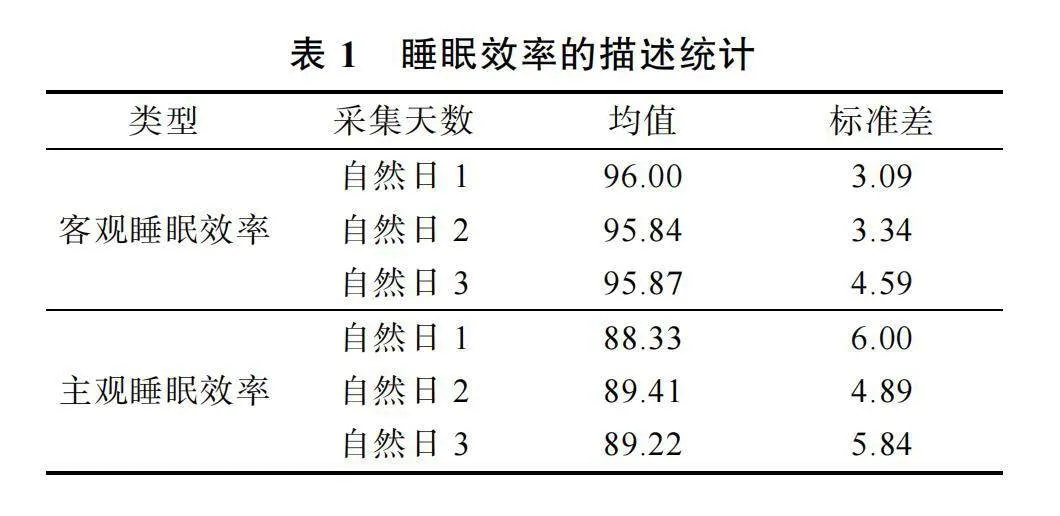
三個自然日的客觀睡眠效率和主觀睡眠效率
的描述性統計結果如表1所示。重復測量方差分析結果發現三個采集日內的客觀睡眠效率之間并不存在顯著差異, F(2, 54) = 0.57, p"= 0.61; 三個采集日內的主觀睡眠效率之間也并無顯著差異, F(2, 54) ="0.03, p"= 0.97。
2.3.2 "CAR的日間差異
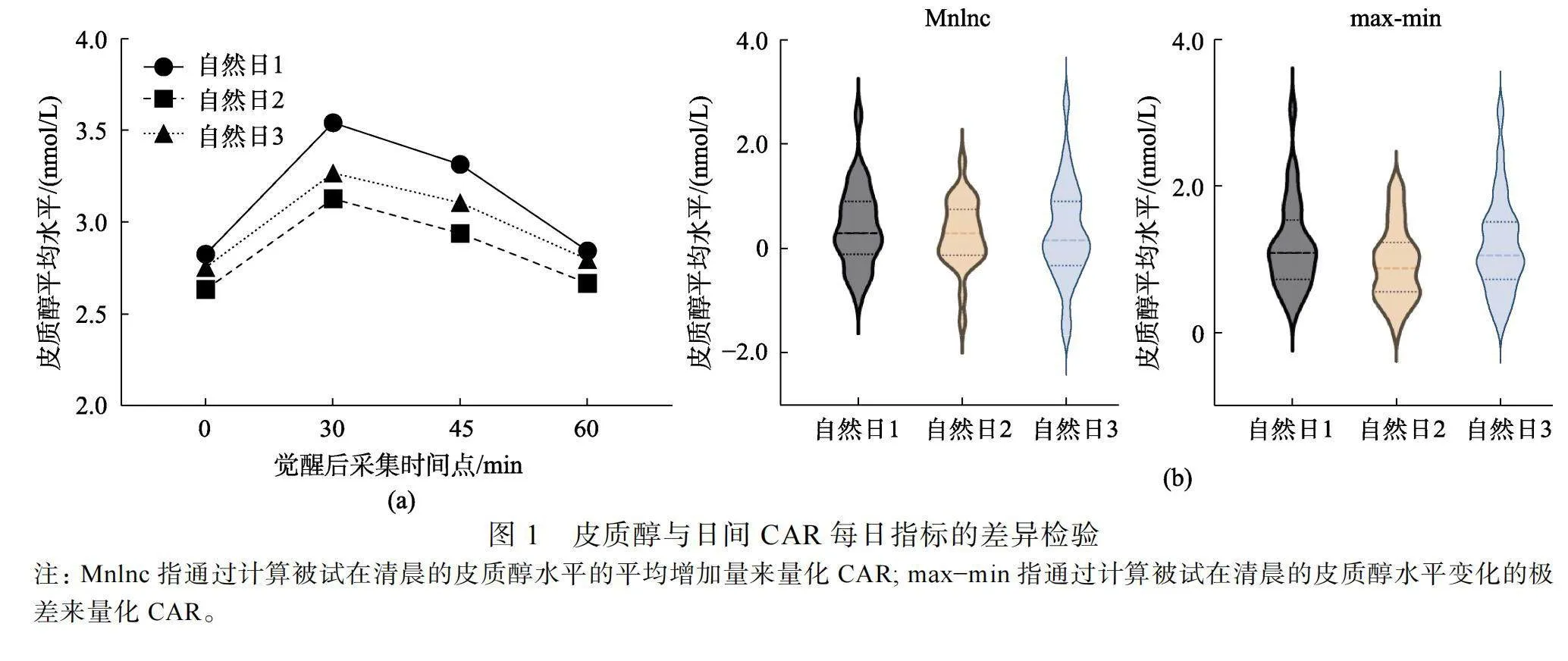
每日采集時間點皮質醇水平見圖1 (a)。重復測量方差分析結果表明, 采集時間點的主效應顯著, F(2.04, 54.98) = 19.81, p"lt; 0.001, η2 = 0.42。這表明42%的觀察到的皮質醇變化的總變異可以由采集時間點來解釋。進一步的事后多重比較結果顯示, 覺醒后30分鐘的皮質醇水平顯著高于覺醒時(p lt; 0.001, 95% CI:"0.26~0.88)、覺醒后45分鐘(p = 0.01, 95%"CI: 0.03~0.35)和覺醒后60分鐘(p lt; 0.001, 95%"CI: 0.29~0.79)。采集日的主效應不顯著F(2, 54) = 1.99, p = 0.15, 采集日和采集時間點的交互作用不顯著, F(3.72, 100.36) = 0.59, p = 0.66。
CAR每日指標(Mnlnc、max?min)在3天自然睡眠日下的差異檢驗結果見圖1 (b), 重復測量方差分析發現兩個每日指標在3個采集日內的差異均不顯著, FMnlnc (5, 54) = 0.24, p = 0.78; Fmax?min (5, 54) = 1.83, p = 0.17。
2.3.3 "均值框架下, 平均睡眠效率、平均CAR和特質焦慮/心理彈性的關系
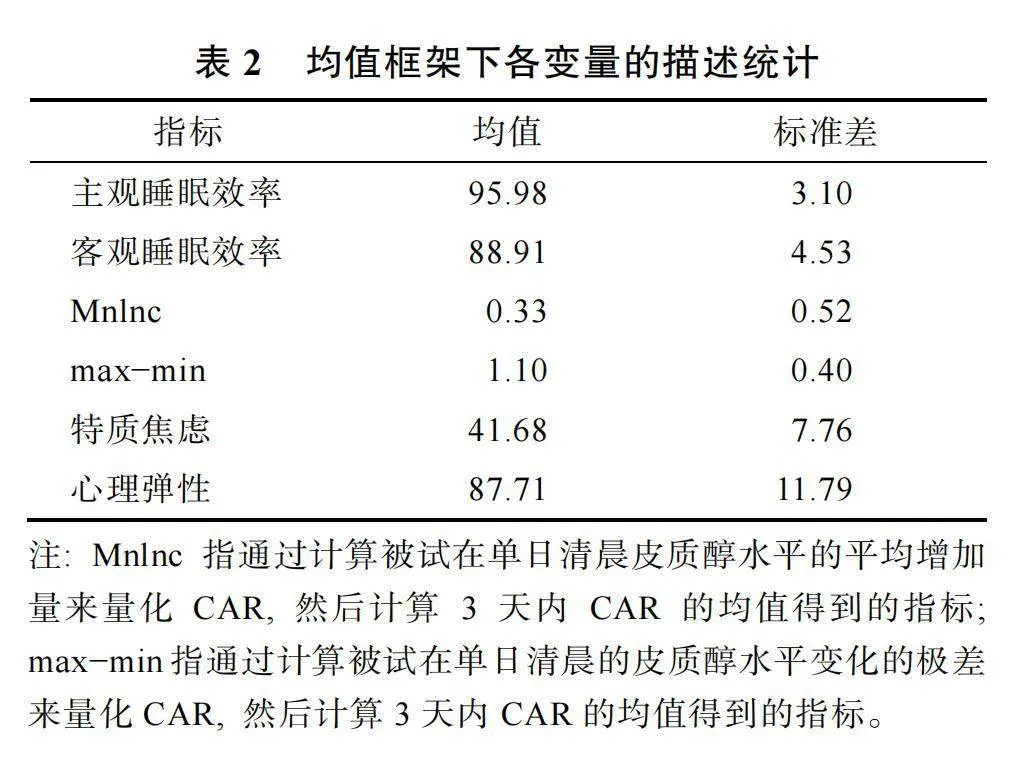
在均值框架下, 平均睡眠效率、平均CAR和心理彈性/特質焦慮, 三個變量的描述統計結果見表2。相關分析結果顯示, 只有平均客觀睡眠效率與心理彈性之間的負相關達到了顯著水平, r"= ?0.37, p"= 0.050。此外, 平均CAR與特質焦慮/心理彈性之間的相關均不顯著。
在進一步控制性別和平均客觀睡眠效率后, CAR均值和特質焦慮/心理彈性之間的偏相關結果見表3。結果顯示, 平均CAR與特質焦慮/心理彈性的偏相關仍不顯著。
2.3.4 "變異性框架下, 睡眠效率變異性、CAR變異性和特質焦慮/心理彈性的關系
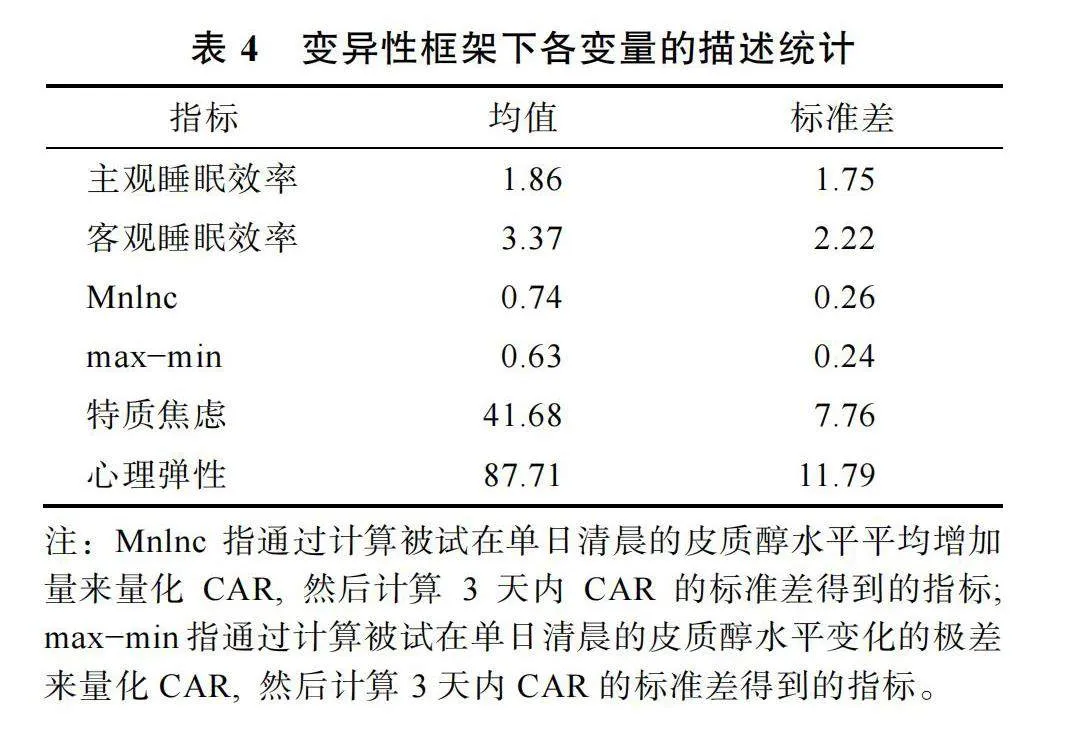
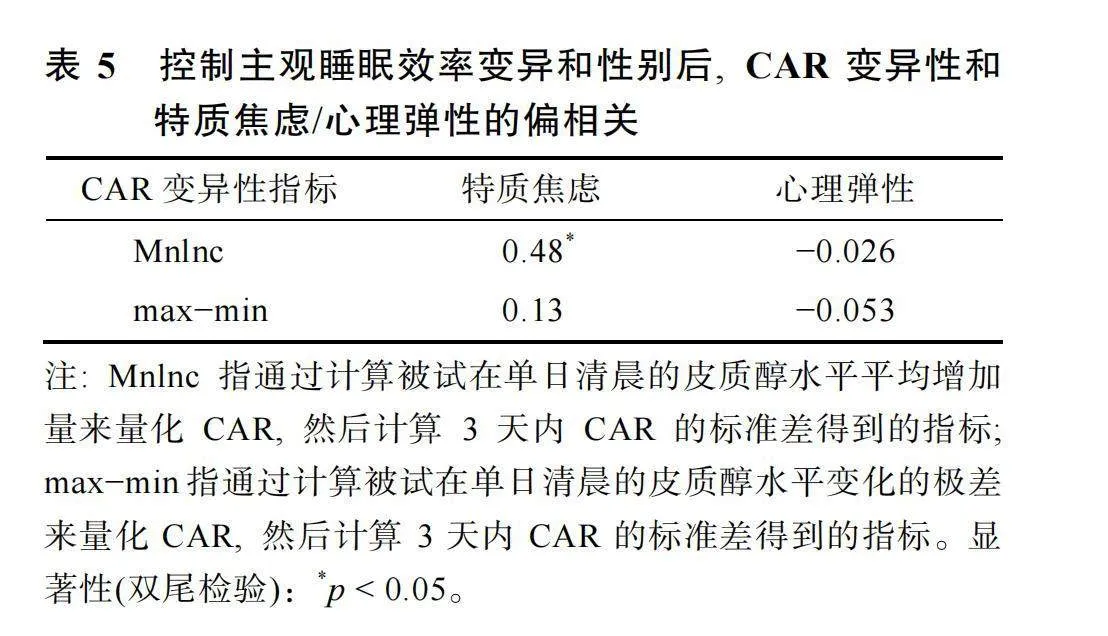
在變異性框架下, 睡眠效率變異性、CAR變異性和心理彈性/特質焦慮, 三個變量的描述統計結果見表4。相關分析結果顯示, 根據Mnlnc計算得出的CAR變異性指標與特質焦慮之間存在顯著的正相關, r"= 0.42, p"= 0.027。這表明, 被試在自然睡眠日下的CAR變異性越小, 個體的特質焦慮水平也越低。此外, 結果還發現, 根據Mnlnc計算得出的CAR變異性指標與主觀睡眠效率變異之間也存在顯著的正相關, r"= 0.39, p"= 0.038。這表明, 被試在3個自然睡眠日下的較小主觀睡眠效率變異會伴隨較小的CAR變異性。
在進一步控制性別和主觀睡眠效率變異的影響后, CAR變異性與特質焦慮/心理健康的偏相關結果如表5所示。結果顯示, 根據Mnlnc計算出的CAR變異性指標與特質焦慮之間的正相關仍然顯著, r"= 0.48, p"= 0.012。CAR變異性和特質焦慮在控制性別和主觀睡眠效率變異后的殘差散點圖見圖2。
2.4 "討論
三個采集日內均出現了相似的CAR反應模式, 即皮質醇水平在覺醒后30分鐘上升至峰值, 并在之后開始逐漸下降, 直至覺醒后60分鐘下降到與剛剛覺醒時無差異的程度。CAR的這種反應模式與前人研究相一致, 覺醒后30分鐘皮質醇水平的上升和隨后的下降可能反映了HPA軸的快速反應和調節機制。這種模式表明, HPA軸對早晨覺醒的適應是快速的, 而一旦完成對晨起挑戰的適應, 皮質醇水平又會回落, 反映出HPA軸對日常節律的調節(Pruessner et al., 1997)。
關于睡眠效率和CAR, 重復測量的方差分析結果發現被試在三個自然睡眠情境下的睡眠效率具有較小的變異, 并且他們在次日清晨的CAR也具有較小的變異性。相關分析的結果進一步表明, 被試在自然睡眠情境下的主觀睡眠效率變異與根據Mnlnc計算得出的CAR變異性之間存在著顯著的正相關。這說明個體在相似的自然睡眠日下的主觀睡眠效率波動幅度越小, CAR變異性也會越小。這可能說明了一種穩定的睡眠模式與HPA軸功能之間的潛在關聯。HPA軸是響應壓力的主要神經內分泌系統, 它通過釋放皮質醇等激素來幫助身體適應壓力。睡眠與HPA軸之間存在生理聯系, 因為睡眠是身體恢復HPA軸活動的關鍵時期。高質量的睡眠可能有助于維持HPA軸的穩態平衡, 而睡眠障礙則可能導致HPA軸功能紊亂(Lo Martire et al., 2024)。因此, 穩定的睡眠效率可能反映了HPA軸的良好調節功能, 這可能進一步表現為CAR的較小波動。
此外, 研究結果發現在均值框架下, 被試的客觀睡眠效率和心理彈性之間存在著顯著的負相關關系。在進一步控制了平均客觀睡眠效率和性別的影響后, 平均CAR和特質焦慮/心理彈性之間的偏相關仍不顯著。盡管實驗1已經對CAR的影響因素進行了相應的控制, 但是CAR還是容易受到其他諸多未知因素的影響而在多天內表現出變異(Hellhammer et al., 2007)。而CAR在多天內的這種變異, 可能使得CAR在平均水平上難以捕捉到與特質焦慮/心理彈性的穩定關聯。
在變異性框架下, 研究結果發現, 無論是否控制協變量, 根據Mnlnc計算出的CAR變異性指標與特質焦慮之間均表現出顯著的正相關。并且在控制了性別和主觀睡眠效率變異的可能干擾之后, CAR變異性與特質焦慮之間正相關的顯著性有所提高, 由原來的r"= 0.42, p"= 0.027轉變為r"= 0.48, p"= 0.012。上述結果進一步拓展了Mikolajczak等人(2010)的發現, 不僅在不同情境下CAR的波動與個體的心理健康狀態之間存在聯系, 在相似的自然睡眠情境下, CAR在多日內的變異與反映個體消極心理健康狀態的特質焦慮得分之間也存在著一定的聯系。此時個體較小的CAR變異性反映了更為健康的心理狀態, 表現為較低的特質焦慮得分。CAR作為應對壓力的生理指標之一, 其變異性可能反映了個體應對環境壓力的能力。較小的CAR變異性表明個體每日覺醒時的生理反應相對穩定, 可能意味著他們能更有效地管理和適應日常生活中的壓力。這種穩定的應對機制與較高的心理健康水平和較低的焦慮水平相關聯(Kuhlman et al., 2020)。除此之外, 穩定的CAR可能反映了個體心理和生理調節機制之間良好的協調能力。當個體能夠有效地管理心理應激, 減少負面情緒和焦慮的影響時, 這種心理狀態的穩定性可能會通過減少生理應激反應的波動來體現, 從而表現為CAR變異性較小(Packard et al., 2016)。
然而, 上述結果僅僅出現在使用Mnlnc作為每日CAR計算指標時, 當使用max?min作為每日CAR指標時, CAR變異性與特質焦慮/心理彈性的相關卻并不顯著。造成這一差別的原因可能在于兩個CAR每日指標背后的生物學意義有所不同。Mnlnc主要反映了個體覺醒后皮質醇水平的整體上升趨勢。這個指標可以視為衡量個體對覺醒這一日常生理過程反應的敏感性和強度的指標。而max?min反映了覺醒后一定時間內皮質醇水平的波動范圍, 即CAR的波動幅度。這個指標提供了關于個體生理反應變異性的信息, 可以視為個體應激系統調節能力和適應性的一個指標(Clow et al., 2004)。這兩個指標可能反映了機體對覺醒過程中壓力反應的不同方面, 揭示了不同的生理調節機制和應對壓力的策略。在實驗1中, 被試處于自然睡眠情境下, Mnlnc作為一個反映CAR整體上升趨勢的指標, 可能更能捕捉到個體在相對穩定的環境中的生理調節能力。這種上升趨勢的一致性可能與個體如何有效管理日常壓力和情緒波動相關, 因此表現出與特質焦慮之間存在著一定的聯系。
除了上述結果之外, 實驗1中并未觀察到CAR變異性和心理彈性之間存在著顯著的相關。造成這一現象的原因可能是因為在相似的自然睡眠情境下, 個體缺乏明顯的外部應激源的刺激, 心理彈性可能并未發揮出明顯的作用, 從而在結果中并未發現心理彈性和CAR變異性之間存在顯著關聯。此外, 有研究發現個體在一天中經歷的壓力事件的差異可能會對CAR產生不同程度的影響(Giglberger et al., 2022; Powell amp; Schlotz, 2012)。這使得CAR變異性在一定程度上可能會受到個體知覺到的日常壓力事件的影響, 而實驗1在此問題上缺乏控制。基于上述問題, 實驗2將進一步加入相關問卷, 以控制日常壓力的可能干擾, 并通過睡眠剝奪的實驗操縱來提高CAR變異性, 進一步分析CAR變異性與特質焦慮/心理彈性的關系。
3 "實驗2:睡眠剝奪情境下, CAR變異性及其與特質焦慮/心理彈性的關系
3.1 "研究目的
采用睡眠剝奪的方法, 降低睡眠效率的穩定性以提高CAR的變異性, 并探討其與特質焦慮/心理彈性的關系。
3.2 "方法
3.2.1""被試
實驗2同樣使用R語言中的“pwr”工具包進行被試量的計算, 參數設定同實驗1 (Cohen's f"2 = 0.3、α = 0.05、1 ? β = 0.8)。結合計算結果以及可能存在的樣本流失, 實驗2通過網絡廣告招募42名健康大學生作為付費志愿者。由于未能遵守CAR采集協議的原因(Stalder et al., 2016, 2022), 2名被試的數據被排除, 最終樣本包括40名被試, 其中20名為女性(M = 20.60歲, SD = 1.60歲), 20名為男性(M = 20.90歲, SD = 1.80歲)。通過問卷調查確認女性參與者處于黃體期。所有參與研究的個體均未患有精神、神經或睡眠障礙, 未服用精神藥物或糖皮質激素藥物, 也未濫用酒精或其他物質。
3.2.2""心理健康問卷
日常應激問卷(Daily Stress Inventory, DSI):該問卷用于測量個體在日常生活中(24小時內)的壓力水平(Brantley et al., 1987)。DSI一共包含58個項目, 每一個項目對應一個日常壓力事件。該問卷要求被試判斷24小時內是否經歷過這些壓力事件, 如果沒有出現則標記為0。對出現過的壓力事件按照不同水平進行評分, 評分范圍由1 (“出現了但并沒有壓力”)到7 (“引起讓人驚恐的壓力”)。最終, 通過將所有應激事件的總分除以應激事件的總數來計算個體在24小時內經歷的應激事件的平均強度。得分越高, 反映個體在24小時內的應激水平越高。
實驗2使用的其他問卷同實驗1。
3.2.3""睡眠剝奪
使用完全睡眠剝奪(Total Sleep Deprivation, TSD)操縱睡眠效率, 創設與自然睡眠情境完全不同的特殊實驗情境。完全睡眠剝奪是指個體在一定時間內完全沒有睡眠的狀態。在這種條件下, 個體被阻止進入任何形式的睡眠, 包括所有睡眠階段和快速眼動(REM)睡眠。
本實驗已通過西南大學心理學部倫理委員會審核并獲得批準。在正式實驗開始之前, 每位被試都詳細了解了研究目的、過程、可能的風險和收益, 并自愿參與研究。他們同時知曉, 可以在任何時候退出研究而不受任何懲罰。實驗結束后, 專門負責數據質量檢查的研究人員會對數據進行檢查。在確認數據質量無問題后, 向被試發放全額被試費。
3.2.4""唾液皮質醇的分析
實驗2采用液相色譜?質譜(LC-MS)技術來定量分析被試的唾液樣本中的皮質醇水平。該技術因其高度的靈敏度和特異性而被選用, 特別適用于檢測生物樣本中的低濃度激素(Gr?schl, 2008)。
唾液樣本在分析前, 經過離心處理(5000 rpm, 4"℃, 10分鐘), 通過吸取樣本上清液并使用濾膜進行過濾以去除大分子雜質。分析使用的液相色譜系統配備了一個反相色譜柱。流動相由水相和有機相組成, 梯度洗脫以優化分離效率。質譜檢測采用電噴霧離子化(ESI)源, 以正離子模式操作。皮質醇的離子監測(MRM)轉換設置為特定的前體離子和產物離子, 以確保分析的特異性和靈敏度。質譜參數, 如碰撞能量和離子源溫度, 經過優化以獲得最佳的信號強度。皮質醇水平采用外標法進行定量, 通過比較樣品中皮質醇的響應與已知濃度標準曲線的響應進行。數據處理和定量分析使用特定的質譜軟件進行。
3.2.5""實驗流程
在實驗2中, 被試在前兩個采集日的實驗流程基本同實驗1, 唯一的不同之處在于被試還需要在每晚10點填寫由主試定時發送的日常應激問卷(DSI)。此外, 在參與完全睡眠剝奪實驗之前, 主試會與被試協商時間, 并且告知他們在參與剝奪實驗的當天, 白天不得睡覺或者打盹, 并且要嚴格佩戴睡眠腕表不得隨意取下。實驗于約定日期的晚上10點開始, 被試需要在此之前前往實驗室并完成一整晚的睡眠剝奪, 剝奪全程均用遮光窗簾對自然光進行完全遮蔽, 實驗室內只保留恒定功率的LED燈光。實驗全程均有兩名主試參與以確保被試沒有睡覺或打盹, 倘若主試發現被試正在打盹, 要迅速將其叫醒。在實驗過程中, 被試需要始終保持情緒的平穩, 激烈刺激的活動以及含有酒精、咖啡因的飲品的飲用被禁止。在次日清晨的7點到8點之間, 被試被要求不得進食、飲用飲料、刷牙漱口或吸煙。并在8點、8點30、8點45和9點四個時間點, 由主試提醒進行唾液樣本的采集, 并在采集完成后, 對唾液樣本與睡眠腕表進行統一的回收和保存。
3.2.6""數據分析
所有數據均采用SPSS 27.0軟件進行統計分析。
與實驗1相同, 在方差分析前對數據進行檢驗以滿足統計分析前提, 對于不滿足球形假設的變量使用格林豪斯?蓋斯勒矯正對自由度進行調整。在方差分析結果顯著后, 進一步采用邦弗朗尼方法進行事后多重比較。具體而言, 以每日采集時間點(0分鐘、30分鐘、45分鐘和60分鐘)和采集天數(自然日1、自然日2和剝奪日)作為自變量, 通過重復測量方差分析采集時間點和日間差異的主效應和交互作用。之后同樣使用平均增加量(Mnlnc)以及極差(max?min)作為CAR的每日指標, 以采集天數(自然日1、自然日2和剝奪日)作為自變量, 通過單因素方差分析CAR的日間差異。在實驗2中, CAR的變異性被計算為前兩個正常睡眠日下CAR的均值與睡眠剝奪后的CAR計算得出的標準差。
最后, 同樣是在均值和變異性兩個框架下, 計算控制日常壓力和性別的影響后, CAR指標和特質焦慮/心理彈性之間的關系。具體而言, 在均值框架下, 用前兩個自然睡眠日下的日常壓力均值作為反映個體平均日常壓力水平的指標。計算控制平均日常壓力和性別的影響后, CAR均值和特質焦慮/心理彈性之間的偏相關。在變異性框架下, 用前兩個自然睡眠日下的日常壓力的標準差作為反映個體日常壓力變異的指標。計算控制日常壓力變異和性別的影響后, CAR變異性和特質焦慮/心理彈性之間的偏相關。
3.3 "結果
3.3.1 "CAR的日間差異
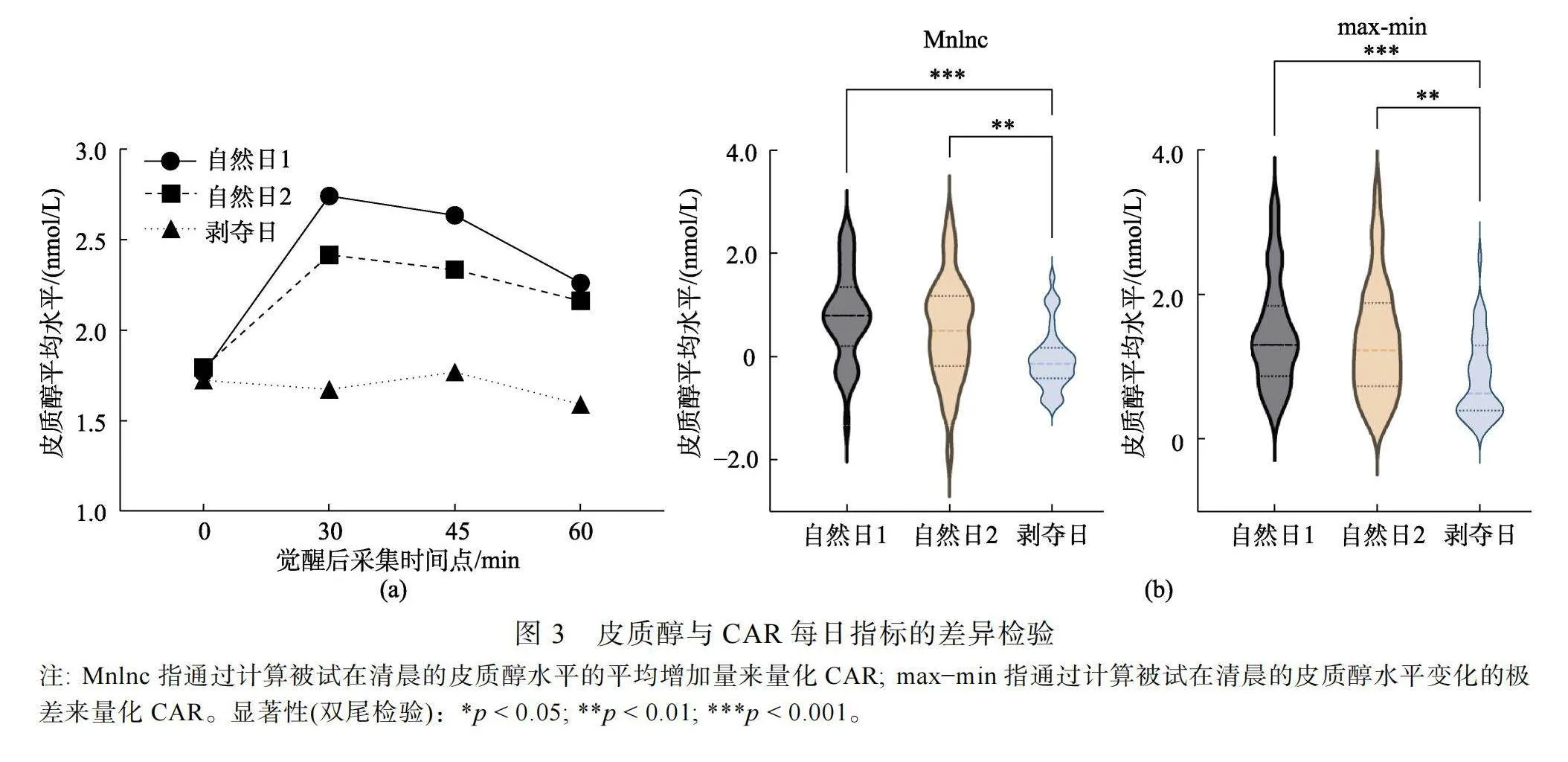
每個采集時間點的皮質醇水平見圖3 (a)。采集時間點和采集日的交互作用顯著, F(4.51, 171.43) = 7.08, p"lt; 0.001, η2"= 0.16。這說明皮質醇變化的總變異中有16%是由采集時間點和采集日的交互影響所解釋的。進一步的簡單效應分析表明, 在自然日1和自然日2下, 被試在覺醒后30分鐘左右, 皮質醇水平達到峰值之后開始逐漸下降。然而在經歷了完全睡眠剝奪之后, 4個采集時間點之間的差異均未達到顯著水平。CAR的每日指標(Mnlnc、max?min)在3天內的差異檢驗結果見圖3(b)。結果發現兩個CAR每日指標的采集日主效應均顯著, FMnlnc"(2, 76) = 12.09, p"lt; 0.001, η2"= 0.24; Fmax?min (2, 76) = 10.84, p"lt; 0.001, η2"= 0.22。上述結果表明, Mnlnc和max?min的變化在不同的采集日之間顯示出相當的變異性, 并且這些變異有較大的一部分可以由采集日的變化所解釋。進一步的多重比較結果表明, CAR在前兩個采集日之間并無顯著差異, 并且前兩個采集日的CAR都要顯著高于睡眠剝奪后的第三個采集日。
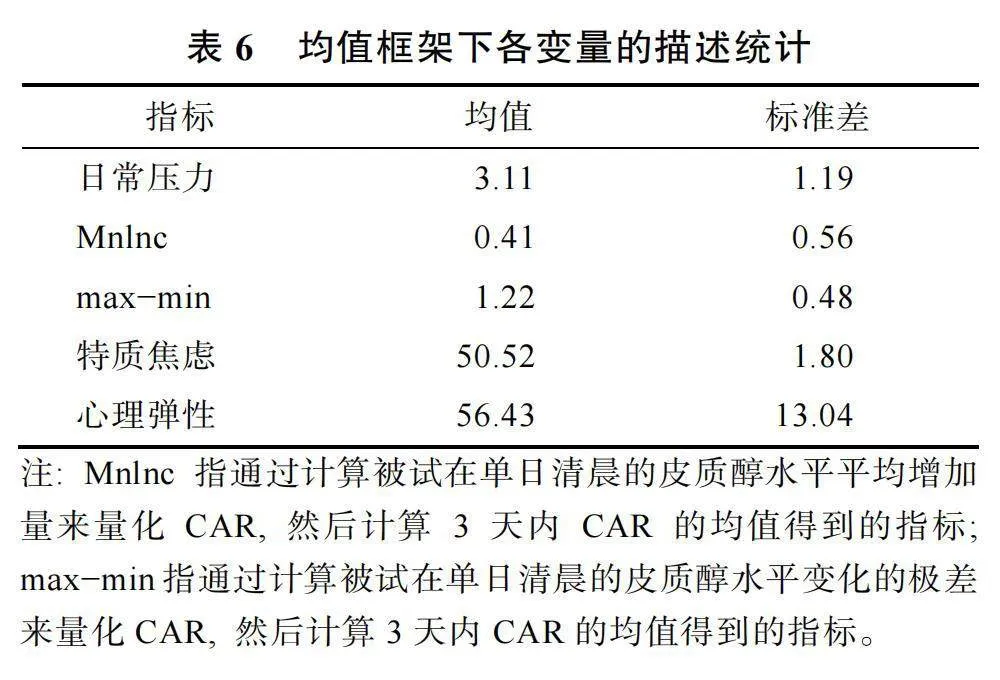
3.3.2""均值框架下, 平均日常壓力、平均CAR和特質焦慮/心理彈性的關系
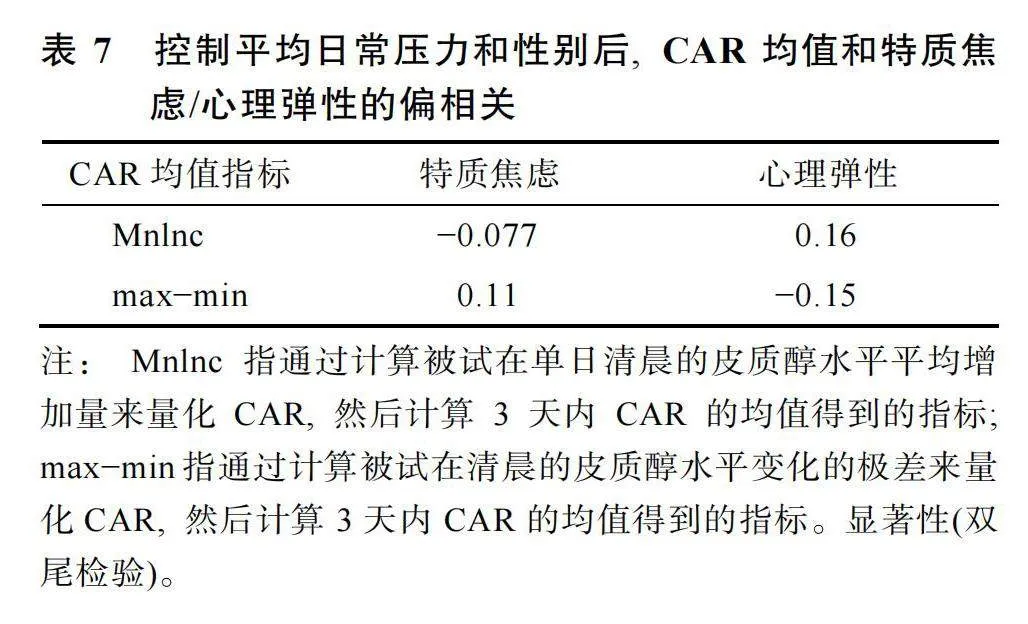
在均值框架下, 平均日常壓力、平均CAR和特質焦慮/心理彈性, 三個變量的描述統計結果見表6。在控制平均日常壓力和性別的影響后, 平均CAR和特質焦慮/心理彈性之間的偏相關不顯著, 結果見表7。
3.3.3""變異性框架下, 日常壓力變異性、CAR變異性和特質焦慮/心理彈性的關系
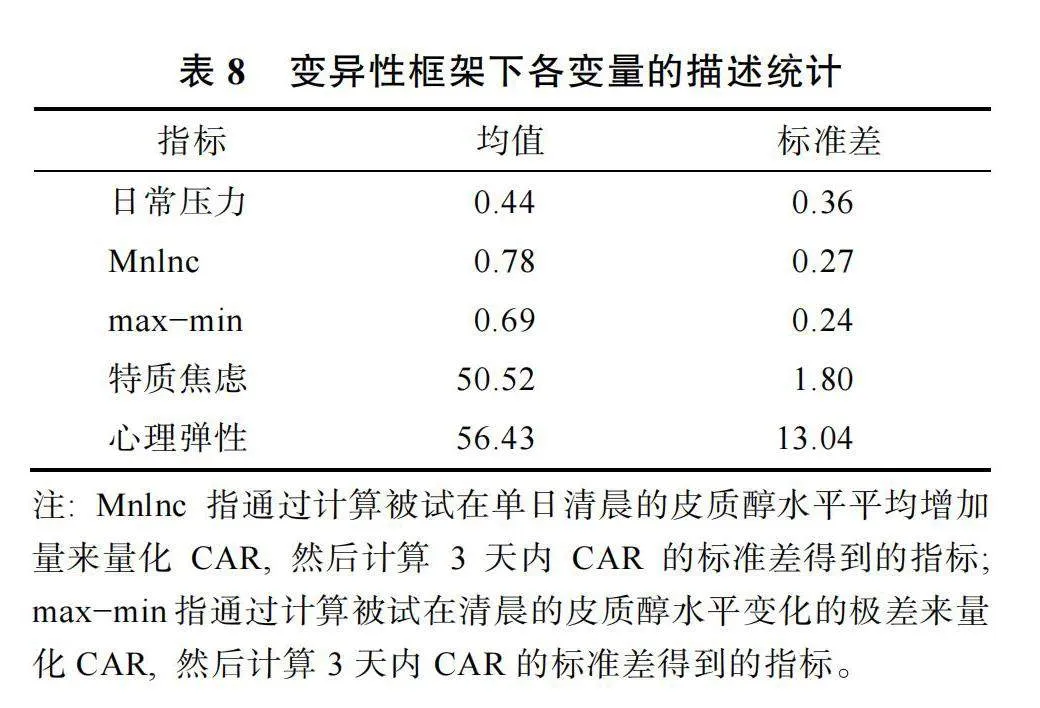
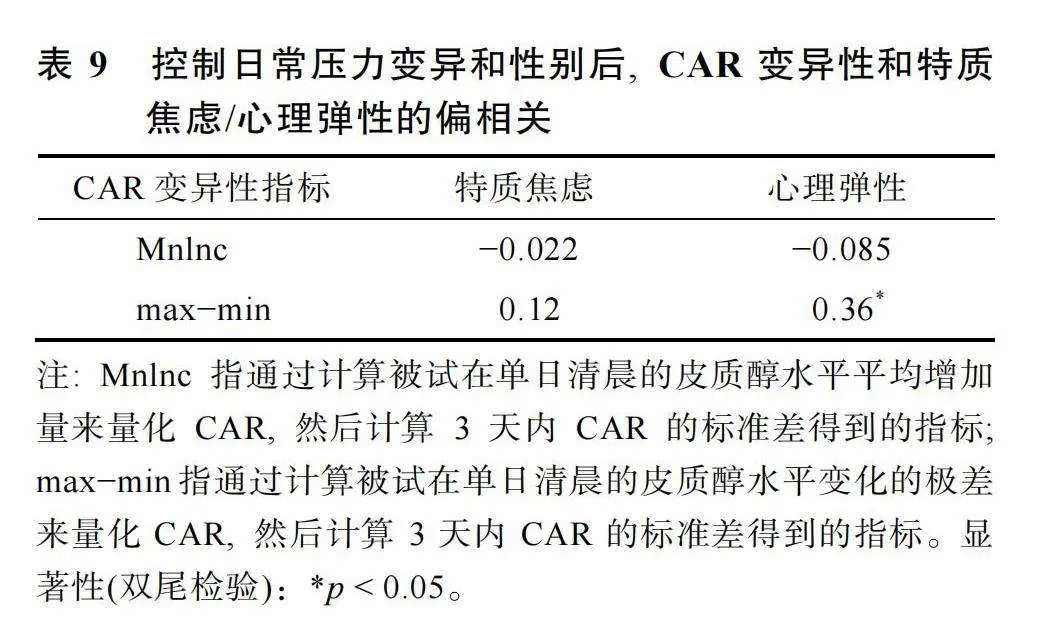
在變異性框架下, 日常壓力變異性、CAR變異性和特質焦慮心理彈性, 三個變量的描述統計結果見表8。在進一步控制日常壓力變異和性別的影響后, CAR變異性和特質焦慮/心理彈性的偏相關結果見表9。此時根據max?min計算出的CAR變異性指標與心理彈性之間呈顯著的正相關, r"= 0.36, p"="0.026。上述變量在控制協變量之后的殘差散點圖見圖4。
3.4""討論
實驗2發現睡眠剝奪導致次日CAR的顯著降低, 這與前人的研究發現相一致(Minkel et al., 2012)。長時間的覺醒和睡眠剝奪可能減弱HPA軸對于覺醒刺激的反應, 導致覺醒時皮質醇的釋放減少, 即CAR的鈍化。這種效應可能是因為HPA軸經歷了過度激活而進入一種相對抑制的狀態, 從而在短期內降低了其對于覺醒刺激的敏感性(Vargas amp; Lopez-Duran, 2020)。
相關分析結果表明, 在控制性別和日常壓力變異的影響后, 個體在經歷睡眠剝奪后的CAR變異性與心理彈性水平呈顯著正相關。該結果進一步豐富了Mikolajczak等人(2010)的發現, 不僅在周末和工作日的不同情境下, 較大的CAR波動反映了個體健康的心理狀態, 在自然睡眠和完全睡眠剝奪的不同情境下, CAR的較大變異同樣與個體的健康心理狀態存在著一定的聯系。在睡眠剝奪前后的不同情境, CAR變異性越大, 反映個體健康心理狀態的心理彈性得分越高。心理彈性強調個體在應對壓力、挑戰和逆境時的適應和恢復能力(Connor amp; Davidson, 2003)。具有高心理彈性的個體更能有效地應對壓力情境, 如睡眠剝奪, 并通過積極的適應性機制維持生理和心理健康。在這種情況下, CAR的較大變異性可能反映個體在面對睡眠剝奪這一應激源時, 能夠通過調節自身的生理反應來進行迅速的適應和恢復。然而與假設不同的是, 在實驗2中并未觀察到CAR變異性指標和特質焦慮得分二者之間存在顯著的相關。雖然特質焦慮和心理彈性二者都是相對穩定的特質指標, 但它們在面對重大應激源挑戰下的作用機制可能有所不同。高心理彈性的個體通常能夠更快地適應和恢復生理平衡, 這種適應性機制在面對重大應激源挑戰時顯得尤為重要(Liu et al., 2018)。而特質焦慮主要反映的是個體對長期環境壓力和威脅的知覺傾向(Alemany-"Arrebola et al., 2020)。在面對重大挑戰時, 特質焦慮可能對這種急性生理變化的敏感性較低, 因此未表現出與CAR變異性的顯著相關。
不同于實驗1的發現, 上述相關僅僅在使用max?min計算每日CAR時出現。相反, 在使用Mnlnc時, CAR的變異性與心理彈性/特質焦慮之間并未顯示出顯著的相關關系。造成這一差異的原因可能同樣源于這兩個指標背后不同的生物學含義。Mnlnc主要反映的是個體覺醒后皮質醇水平的整體上升趨勢, 而max?min則反映了個體覺醒后一定時間內皮質醇水平的波動幅度。在實驗2中, 被試處于完全睡眠剝奪的極端應激情境下, max?min作為反映CAR波動幅度的指標, 更可能直接反映個體對于極端變化的生理反應強度和調節范圍。而完全睡眠剝奪作為一種極端的應激源, 可以激發個體極為強烈的生理和心理反應, 并進而導致次日CAR的波動幅度增大。這種增加的波動幅度可能與個體在應對極端應激源時所展現的心理適應性和恢復能力相關(Clow et al., 2010), 并最終表現為CAR變異性與心理彈性之間存在的顯著正相關。
除了上述結果之外, 與實驗1相似, 在均值框架下使用平均CAR作為指標進行計算時, 無論如何控制協變量, 其與特質焦慮和心理彈性量的相關均不顯著。這一結果進一步強調了在評估與特質焦慮和心理彈性之間的關系時, 相較于CAR變異性, 使用CAR平均量具有局限性。因為CAR很容易受到其他諸多因素的影響, 包括心理壓力、睡眠質量、時間壓力、生物節律、甚至采樣方法等(Stalder et al., 2016), 所以僅僅計算CAR的平均量可能忽略了這些因素在不同時間下對個體CAR所產生的不同影響。相較之下, 分析CAR變異性則可以提供更為全面的信息。首先, CAR變異性可能更敏感地反映了個體對于不同應激源的生理反應。CAR變異性能夠捕捉到日間HPA軸反應模式的微妙差異, 為理解心理狀態對生理過程的影響提供了更豐富的信息。其次, CAR變異性的分析可能更好地反映了個體適應和應對環境壓力的能力。例如, 在睡眠剝奪后CAR變異性的增加可能表示個體在努力調節其生理狀態以適應壓力。最后, CAR變異性與特質焦慮和心理彈性之間的關系表明, 它可能是一個更全面的衡量個體心理健康狀態的生理指標, 可以提供關于個體如何在不同時間和不同壓力下調節其生理反應的重要信息。
4 "總討論
本研究通過對具有相似睡眠效率的自然睡眠情境下進行觀測(實驗1), 以及完全睡眠剝奪的實驗操縱創設了具有顯著睡眠差異的實驗情境(實驗2), 分別探討了CAR變異性與心理彈性和特質焦慮的關系。結果發現, 在相似的自然睡眠情境下, CAR變異性較小, 并且CAR變異性和特質焦慮之間存在著顯著的正相關; 而在睡眠剝奪前后的不同睡眠情境下, CAR變異性較大, 并且CAR變異性和心理彈性之間存在著顯著的正相關。與上述結果相對的是, 當使用多天CAR的平均量作為指標時, 不論睡眠情境是否相似, 其與心理彈性和特質焦慮之間均不存在顯著的相關關系。上述結果基本支持假設, 即在CAR均值外, 還可以考慮CAR變異性作為衡量心理健康更為有效的生理指標。
CAR自提出以來, 已然成為心理生理學和睡眠研究領域的一個重要指標, 用于評估個體對壓力的反應和晝夜節律的調節。盡管目前研究者們針對CAR已經展開了豐富的研究并取得了顯著進展, 但是目前仍有一些關鍵問題尚未得到有效解決。首先, 關于CAR這一生理反應背后究竟反映了怎樣的心理含義, 越來越多的證據表明CAR可能是個體為應對即將到來的日常挑戰和壓力的一種生理準備(Wu et al., 2015; Xiong et al., 2021), 但是在這一問題上目前仍然存在爭議(Fries et al., 2009)。其次, 盡管CAR已被用作評估個體健康狀態的生物標志物, 但是其與具體健康結果(如心理健康障礙、心血管疾病)之間的關系還存在爭議(Chida amp; Steptoe, 2009)。尤其是CAR的增加或減少如何反映特定健康風險, 以及如何利用CAR進行早期預警和干預, 至今仍是研究的熱點。針對上述問題, 本研究通過對比自然睡眠和睡眠剝奪情境下的CAR, 發現CAR不單單是一個靜態的生理標志物, 而是一個能夠靈活適應環境壓力變化的動態指標。睡眠剝奪導致了CAR的顯著降低, 但這種變化在高心理彈性的個體中表現為更大的CAR變異性, 顯示出個體對極端壓力的適應能力。此外, 本研究進一步細化了CAR與心理健康之間的關系。傳統研究通常將CAR水平與心理健康直接關聯, 但本研究發現, 不同情境下CAR的變化模式可能更為復雜。例如, 在自然睡眠情境下, 較小的CAR變化可能與較低的特質焦慮相關; 而在睡眠剝奪前后的不同情境下, 則是CAR的較大變化更能反映個體的心理彈性。這提示研究者在探討CAR意義的同時, 有必要結合采集時的具體情境, 對研究結果做出更為謹慎地解釋。最后, 本研究通過探索CAR在不同情境下的反應模式, 為CAR作為心理健康評估工具提供了新的視角。尤其是在極端壓力情境下(如睡眠剝奪), CAR的變異性可能可以作為評估個體心理彈性的重要指標。
盡管此前的研究已經發現睡眠與CAR之間存在著一定聯系(Edwards et al., 2001; Kumari et al., 2009; Lasikiewicz et al., 2008; Wüst et al., 2000), 但是睡眠究竟是如何與CAR相聯系的, 在這一問題上目前仍存在爭議。對此, 本研究通過兩項實驗進一步探討了自然睡眠以及睡眠剝奪前后的睡眠效率波動對CAR變異性的影響。首先, 本研究發現在自然睡眠情境下, 個體的主觀睡眠效率變異與CAR變異性之間存在著顯著的正相關。并且睡眠剝奪后的CAR相較于自然睡眠情境, 存在著顯著的變化。這些發現不僅強調了睡眠對于維持機體正常的生理應激反應的重要性, 也揭示了睡眠與人體應激系統之間存在著復雜的交互作用。其次, 本研究強調了改善睡眠質量在維持個體生理和心理健康中的重要性。通過揭示主觀睡眠效率變化和CAR變異性之間的內在聯系, 本研究為設計針對性的睡眠干預措施提供了理論思路, 即未來可能可以通過改善個體的睡眠質量, 降低主觀睡眠效率的日間變異來優化日間的生理應激反應, 進而促進機體的整體健康。總體而言, 本研究不僅豐富了對睡眠與日間生理調節之間復雜聯系的認識, 也為睡眠領域提供了新的干預思路。
在心理健康指標的選取上, 本研究選擇了特質焦慮和心理彈性作為反映個體心理健康狀態的兩個核心指標。特質焦慮反映了個體在面對潛在威脅時的持續性和普遍性的應激反應, 是一個穩定的個性特征(Spielberger et al., 1983)。心理彈性則描述了個體在面對逆境時的恢復力和適應能力(Masten, 2001)。同時考慮特質焦慮和心理彈性, 提供了一個更為全面的研究框架, 以此來理解個體如何從生理和心理兩個層面應對壓力。這種多維度的測量方法可以幫助更好地識別那些在應對日常生活壓力時可能需要額外支持的個體。此外, 本研究通過探索CAR變異性與特質焦慮和心理彈性之間的關系, 展示了如何利用生理指標來評估和理解個體的心理健康狀態。這為未來研究提供了一個有價值的參考, 表明整合生理和心理數據可以深化對個體健康狀態的理解。綜上所述, 本研究通過結合特質焦慮和心理彈性這兩個心理健康指標, 不僅加深了對個體應對壓力機制的理解, 也為心理健康干預提供了新的思路, 具有重要的理論和實踐意義。
本研究也存在著一定的局限性。首先, 本研究中的兩項實驗均使用了3天的CAR樣本來計算CAR變異性。而3天內的CAR測量可能受到個體生活事件、突發因素等多種無關因素的影響, 這些因素的短期變化可能會對CAR變異性產生較大影響。未來的研究可以考慮擴展測量時間跨度、增加測量頻次, 以獲得更全面和深入的理解。其次, 本研究中的兩項實驗樣本量相對較小。實驗1最終納入分析的被試量僅達到了事先樣本量計算的最低限度, 而實驗2最終納入分析的被試量也只是稍高于最低限度。并且兩項實驗的被試均為大學生群體, 這一特定群體和較小的樣本量可能導致本研究在統計檢驗力和外部效度方面存在一定局限性。未來的研究可以進一步擴大樣本量以及被試群體, 以獲取更為可靠的研究結論。
總的來說, 本研究提供了一個探討CAR和心理健康之間關系的新的分析思路, 相較于傳統對于平均量的分析, 考慮多天內CAR變異性, 探討其與心理健康的關系, 提供了一種更為全面和細致的方法來理解生理和心理健康之間的復雜動態關系。這種方法有助于揭示更多關于個體如何適應日常生活中的壓力和挑戰的信息。
參 "考""文 "獻
Abercrombie, H. C., Barnes, A. L., Nord, E. C., Finley, A. J., Higgins, E. T., Grupe, D. W., … Schaefer, S. M. (2023). Inverse association between stress induced cortisol elevations"and negative emotional reactivity to stress in humans. Stress, 26(1), 2174780.
Adam, E. K., Hawkley, L. C., Kudielka, B. M., amp; Cacioppo, J. T. (2006). Day-to-day dynamics of experience?cortisol associations in a population-based sample of older adults. Proceedings of the National Academy of Sciences of the United States of America, 103(45), 17058?17063.
Alemany-Arrebola, I., Rojas-Ruiz, G., Granda-Vera, J., amp; Mingorance-Estrada, á. C. (2020). Influence of COVID-19 on the perception of academic self-efficacy, state anxiety, and trait anxiety in college students. Frontiers in Psychology,"11, 570017.
Almeida, D. M., Piazza, J. R., amp; Stawski, R. S. (2009). Interindividual differences and intraindividual variability in the cortisol awakening response: An examination of age and gender. Psychology and Aging, 24(4), 819?827.
Bowles, N. P., Thosar, S. S., Butler, M. P., Clemons, N. A., Robinson, L. D., Ordaz, O. H., ... Shea, S. A. (2022). The circadian system modulates the cortisol awakening response"in humans. Frontiers in Neuroscience, 16, 995452.
Brantley, P. J., Waggoner, C. D., Jones, G. N., amp; Rappaport, N. B. (1987). A daily stress inventory: Development, reliability, and validity. Journal of Behavioral Medicine, 10(1), 61?74.
Chida, Y., amp; Steptoe, A. (2009). Cortisol awakening response and psychosocial factors: A systematic review and meta-analysis. Biological Psychology, 80(3), 265?278.
Clow, A., Hucklebridge, F., Stalder, T., Evans, P., amp; Thorn, L. (2010). The cortisol awakening response: More than a measure of HPA axis function. Neuroscience and Biobehavioral Reviews, 35(1), 97?103.
Clow, A., Thorn, L., Evans, P., amp; Hucklebridge, F. (2004). The awakening cortisol response: Methodological issues and significance. Stress, 7(1), 29?37.
Cohen, J. (1988). Statistical power analysis for the behavioral sciences"(2nd ed.). Routledge.
Connor, K. M., amp; Davidson, J. R. (2003). Development of a new resilience scale: The Connor-Davidson Resilience Scale (CD-RISC). Depression and Anxiety, 18(2), 76?82.
Edwards, S., Evans, P., Hucklebridge, F., amp; Clow, A. (2001). Association between time of awakening and diurnal cortisol secretory activity. Psychoneuroendocrinology, 26(6), 613?622.
Endrighi, R., Hamer, M., amp; Steptoe, A. (2011). Associations of trait optimism with diurnal neuroendocrine activity, cortisol responses to mental stress, and subjective stress measures in healthy men and women. Psychosomatic Medicine, 73(8), 672?678.
Fries, E., Dettenborn, L., amp; Kirschbaum, C. (2009). The cortisol awakening response (CAR): Facts and future directions. International Journal of Psychophysiology, 72(1),"67?73.
Giglberger, M., Peter, H. L., Kraus, E., Kreuzpointner, L., Z?nkert, S., Henze, G. I., ... Wüst, S. (2022). Daily life stress and the cortisol awakening response over a 13-months stress period: Findings from the LawSTRESS project. Psychoneuroendocrinology, 141, 105771.
Gr?schl, M. (2008). Current status of salivary hormone analysis. Clinical Chemistry, 54(11), 1759?1769.
Hardeveld, F., Spijker, J., Vreeburg, S. A., Graaf, R. D., Hendriks, S. M., Licht, C. M., ... Beekman, A. T. (2014). Increased cortisol awakening response was associated with time to recurrence of major depressive disorder. Psychoneuroendocrinology, 50, 62?71.
Haynes, A., Lenz, A., Stalder, O., amp; Limacher, A. (2021). Presize: An R-package for precision-based sample size calculation in clinical research. Journal of Open Source Software, 6(60), 3118.
Hellhammer, J., Fries, E., Schweisthal, O. W., Schlotz, W., Stone, A. A., amp; Hagemann, D. (2007). Several daily measurements are necessary to reliably assess the cortisol rise after awakening: State- and trait components. Psychoneuroendocrinology, 32(1), 80?86.
Hollanders, J. J., van der Voorn, B., Rotteveel, J., amp; Finken, M. J. J. (2017). Is HPA axis reactivity in childhood gender-"specific? A systematic review. Biology of Sex Differences, 8(1), 23.
Johnson, D. M., Delahanty, D. L., amp; Pinna, K. (2008). The cortisol awakening response as a function of PTSD severity and abuse chronicity in sheltered battered women. Journal of Anxiety Disorders, 22(5), 793?800.
Kallen, V. L., Tulen, J. H., Utens, E. M., Treffers, P. D., De Jong, F. H., amp; Ferdinand, R. F. (2008). Associations between HPA axis functioning and level of anxiety in children and adolescents with an anxiety disorder. Depression and Anxiety, 25(2), 131?141.
Kudielka, B. M., amp; Kirschbaum, C. (2005). Sex differences in HPA axis responses to stress: A review. Biological Psychology, 69(1), 113?132.
Kuhlman, K. R., Chiang, J. J., Bower, J. E., Irwin, M. R., Seeman, T. E., McCreath, H. E., ... Fuligni, A. J. (2020). Sleep problems in adolescence are prospectively linked to later depressive symptoms via the cortisol awakening response. Development and Psychopathology, 32(3), 997?"1006.
Kumari, M., Badrick, E., Ferrie, J., Perski, A., Marmot, M., amp; Chandola, T. (2009). Self-reported sleep duration and sleep disturbance are independently associated with cortisol secretion in the Whitehall II study. The Journal of Clinical Endocrinology and Metabolism, 94(12), 4801?4809.
Lanlokun, O., Yarnell, A., Grillakis, A., amp; Quartana, P. (2017). 0159 laboratory-based sleep restriction enhances the cortisol awakening response in healthy adults. Sleep, 40(1), A59?A59.
Lasikiewicz, N., Hendrickx, H., Talbot, D., amp; Dye, L. (2008). Exploration of basal diurnal salivary cortisol profiles in middle-aged adults: Associations with sleep quality and metabolic parameters. Psychoneuroendocrinology, 33(2), 143?151.
Liu, H., Zhang, C., Ji, Y., amp; Yang, L. (2018). Biological and psychological perspectives of resilience: Is it possible to improve stress resistance? Frontiers in Human Neuroscience, 12, 326.
Lo Martire, V., Berteotti, C., Zoccoli, G., amp; Bastianini, S. (2024). Improving sleep to improve stress resilience. Current Sleep Medicine Reports, 10(1), 23?33.
Masten, A. S. (2001). Ordinary magic: Resilience processes in development. American Psychologist, 56(3), 227?238.
McEwen, B. S., amp; Stellar, E. (1993). Stress and the individual. Mechanisms leading to disease. Archives of Internal Medicine, 153(18), 2093?2101.
Mikolajczak, M., Quoidbach, J., Vanootighem, V., Lambert, F., Lahaye, M., Fillée, C., amp; de Timary, P. (2010). Cortisol awakening response (CAR)'s flexibility leads to larger and more consistent associations with psychological factors than CAR magnitude. Psychoneuroendocrinology, 35(5), 752?757.
Miller, R., amp; Plessow, F. (2013). Transformation techniques for cross-sectional and longitudinal endocrine data: Application"to salivary cortisol concentrations. Psychoneuroendocrinology,"38(6), 941?946.
Minkel, J. D., Banks, S., Htaik, O., Moreta, M. C., Jones, C. W., McGlinchey, E. L., Simpson, N. S., amp; Dinges, D. F. (2012). Sleep deprivation and stressors: Evidence for elevated negative affect in response to mild stressors when sleep deprived. Emotion, 12(5), 1015?"1020.
Moon, Y., Lee, E., Lee, S., Son, G. I., Byeon, H., Shin, H. R., amp; Bolortsetseg, B. (2023). Changes in cortisol awakening responses (CAR) in menopausal women through short-term marine healing retreat program with specific factors affecting each CAR index. PLOS ONE, 18(4), e0284627.
Nater, U. M., Maloney, E., Boneva, R. S., Gurbaxani, B. M., Lin, J. M., Jones, J. F., Reeves, W. C., amp; Heim, C. (2008). Attenuated morning salivary cortisol concentrations in a population-based study of persons with chronic fatigue syndrome and well controls. The Journal of Clinical Endocrinology and Metabolism, 93(3), 703?709.
Nelson, K. L., Davis, J. E., amp; Corbett, C. F. (2022). Sleep quality: An evolutionary concept analysis. Nursing Forum, 57(1), 144?151.
Okamura, H., Tsuda, A., amp; Matsuishi, T. (2010). Perceived happiness and cortisol awakening response on workdays and weekends. The Japanese Journal of Health Psychology, 23(2), 11?21.
Oosterholt, B. G., Maes, J. H. R., Van der Linden, D., Verbraak, M. J. P. M., amp; Kompier, M. A. J. (2015). Burnout and cortisol: Evidence for a lower cortisol awakening response in both clinical and non-clinical burnout. Journal of Psychosomatic Research, 78(5), 445?451.
Packard, A. E., Egan, A. E., amp; Ulrich-Lai, Y. M. (2016). HPA axis interactions with behavioral systems. Comprehensive Physiology, 6(4), 1897?1934.
Powell, D. J., amp; Schlotz, W. (2012). Daily life stress and the cortisol awakening response: Testing the anticipation hypothesis. PLOS ONE, 7(12), e52067.
Pruessner, J. C., Wolf, O. T., Hellhammer, D. H., Buske-"Kirschbaum, A., von Auer, K., Jobst, S., Kaspers, F., amp; Kirschbaum, C. (1997). Free cortisol levels after awakening: A reliable biological marker for the assessment of adrenocortical activity. Life Sciences, 61(26), 2539?2549.
Rickard, N. S., Chin, T. -C., amp; Vella-Brodrick, D. A. (2016). Cortisol awakening response as an index of mental health and well-being in adolescents. Journal of Happiness Studies, 17(6), 2555?2568.
Schlotz, W. (2011). Ambulatory psychoneuroendocrinology: Assessing salivary cortisol and other hormones in daily life. In Mehl, Matthias and Conner, Tamlin S. (Eds.), Handbook of research methods for studying daily life"(pp. 193?209). New York, US. Guilford Press.
Schlotz, W., Hellhammer, J., Schulz, P., amp; Stone, A. A. (2004). Perceived work overload and chronic worrying predict weekend-weekday differences in the cortisol awakening response. Psychosomatic Medicine, 66(2), 207?214.
Selmaoui, B., amp; Touitou, Y. (2003). Reproducibility of the circadian rhythms of serum cortisol and melatonin in healthy subjects: A study of three different 24-h cycles over six weeks. Life Sciences, 73(26), 3339?3349.
Shea, A. K., Streiner, D. L., Fleming, A., Kamath, M. V., Broad, K., amp; Steiner, M. (2007). The effect of depression, anxiety and early life trauma on the cortisol awakening response during pregnancy: Preliminary results. Psychoneuroendocrinology, 32(8?10), 1013?1020.
Shi, X., Sun, X., Yao, Z., Yuan, Y., Wu, J., amp; Clow, A. (2018). The cortisol awakening response predicts response inhibition in the afternoon of the same day. Psychoneuroendocrinology,"89, 23?29.
Spielberger, C. D., Gorsuch, R. L., Lushene, R., Vagg, P. R., amp; Jacobs, G. A. (1983). Manual for the State-Trait Anxiety Inventory. Palo Alto, CA: Consulting Psychologists Press.
Stalder, T., Kirschbaum, C., Kudielka, B. M., Adam, E. K., Pruessner, J. C., Wüst, S., ... Clow, A. (2016). Assessment of the cortisol awakening response: Expert consensus guidelines. Psychoneuroendocrinology, 63, 414?432.
Stalder, T., Lupien, S. J., Kudielka, B. M., Adam, E. K., Pruessner, J. C., Wüst, S., ... Clow, A. (2022). Evaluation and update of the expert consensus guidelines for the assessment of the cortisol awakening response (CAR). Psychoneuroendocrinology, 146, 105946.
Steptoe, A., Gibson, E. L., Hamer, M., amp; Wardle, J. (2007). Neuroendocrine and cardiovascular correlates of positive affect measured by ecological momentary assessment and by questionnaire. Psychoneuroendocrinology, 32(1), 56?64.
Therrien, F., Drapeau, V., Lupien, S. J., Beaulieu, S., Doré, J., Tremblay, A., amp; Richard, D. (2008). Awakening cortisol response in relation to psychosocial profiles and eating behaviors. Physiology amp; Behavior, 93(1?2), 282?288.
Torres, L. H. S. F., Medeiros, Y. K. M., de Sousa, G. M., Vargas, H. Q., de Menezes Galv?o, A. C., de Almeida, R. N., ... Galv?o-Coelho, N. L. (2024). Use of sleep quality questionary and cortisol awakening response as complementary tools for the evaluation of major depression progression. Current Psychology, 43(22), 19820?19829.
Vargas, I., amp; Lopez-Duran, N. (2020). The cortisol awakening response after sleep deprivation: Is the cortisol awakening response a \"response\" to awakening or a circadian process? Journal of Health Psychology, 25(7), 900?912.
Vargas, I., Mayer, S., amp; Lopez-Duran, N. (2017). The cortisol awakening response and depressive symptomatology: The moderating role of sleep and gender. Stress and Health: Journal of the International Society for the Investigation of Stress, 33(3), 199?210.
Wang, X. D., Wang, X. L., amp; Ma, H. (1999). Handbook of mental health assessment scales"(Suppl., pp. 205?209). Beijing, China: Chinese Journal of Mental Health.
[汪向東, 王希林, 馬弘. (1999). 心理衛生評定量表手冊"(增訂版, pp. 205?209). 北京: 中國心理衛生雜志社.]
Waye, K. P., Clow, A., Edwards, S., Hucklebridge, F., amp; Rylander, R. (2003). Effects of nighttime low frequency noise on the cortisol response to awakening and subjective sleep quality. Life Sciences, 72(8), 863?875.
Whitehead, D. L., Perkins-Porras, L., Strike, P. C., Magid, K., amp; Steptoe, A. (2007). Cortisol awakening response is elevated in acute coronary syndrome patients with type-D personality. Journal of Psychosomatic Research, 62(4), 419?425.
Wu, G., Feder, A., Cohen, H., Kim, J. J., Calderon, S., Charney, D. S., amp; Mathé, A. A. (2013). Understanding resilience. Frontiers in Behavioral Neuroscience, 7, 10.
Wu, J., Zhang, S., Li, W., Qin, S., He, Y., Yang, Z., … Zhang, K. (2015). Cortisol awakening response predicts intrinsic functional connectivity of the medial prefrontal cortex in the afternoon of the same day. NeuroImage, 122, 158?165.
Wu, W. -T., Li, W. -J., Liao, H. -Y., amp; Liou, S. -H. (2017). 0015 The significance and application of salivary biomarkers of stress, cortisol awakening response, in occupational psychology. Occupational and Environmental Medicine, 74(Suppl 1), A3.
Wüst, S., Federenko, I., Hellhammer, D. H., amp; Kirschbaum, C. (2000). Genetic factors, perceived chronic stress, and the free cortisol response to awakening. Psychoneuroendocrinology, 25(7), 707?720.
Xiong, B., Chen, C., Tian, Y., Zhang, S., Liu, C., Evans, T. M., … Qin, S. (2021). Brain preparedness: The proactive role of the cortisol awakening response in hippocampal-"prefrontal functional interactions. Progress in Neurobiology, 205, 102127.
Yu, X., amp; Zhang, J. (2007). A comparison between the Chinese version of Ego-Resiliency Scale and Connor-Davidson Resilience Scale. Journal of Psychological Science, 30(5), 1169?1171.
[于肖楠, 張建新. (2007). 自我韌性量表與Connor-Davidson韌性量表的應用比較. 心理科學, 30(5), 1169?1171.]
Variability in cortisol awakening response related to sleep efficiency and its relationship with trait anxiety and psychological resilience
YANG Zijian1,2, ZHAO Xiaolin1,2, GUO Kaige1,2, LUO Jiahao1,2, DU Tengfei1,2,ZHANG Yajie1,2, HU Yueqin3, YANG Juan1,2
(1"Faculty of Psychology, Southwest University, Chongqing 400715,"China)(2"Key Laboratory of Cognition and Personality, Ministry of Education, Chongqing"400715,"China)(3"Faculty of Psychology, Beijing Normal University, Beijing 100875, China)
Abstract
Cortisol awakening response (CAR) is closely associated with individual mental health. Traditional studies have used the mean value of CAR over several days to explore this relationship. However, their conclusions have been highly inconsistent due to the influence of state-dependent factors, such as sleep. Therefore, this study introduces CAR variability across multiple days as a novel measure to quantify CAR and investigates its relationship with mental health while regarding trait anxiety and psychological resilience as key variables under natural sleep observation and sleep deprivation manipulation scenarios. This study hypothesized that under the natural sleep condition, a smaller CAR variability reflects positive mental health characteristics, specifically higher psychological resilience scores and lower trait anxiety scores, while under the sleep deprivation condition, a greater CAR variability reflects positive mental health characteristics.
Two experiments were conducted to test these hypotheses. In Experiment 1, the CAR variability of 28 participants was reduced by decreasing sleep efficiency variability under natural sleep conditions. In Experiment 2, 40 participants experienced a full night of sleep deprivation following 2 natural sleep days to increase their CAR variability. All participants wore a sleep wristwatch to assess their sleep efficiency during the experimental period and provided 4 saliva samples at awakening and at 30, 45, and 60 minutes post-awakening to assess their CAR. The trait anxiety inventory and the Connor?Davidson resilience scale were used as key variables reflecting individual mental health. The relationship between CAR variability over multiple days and trait anxiety/psychological resilience was then examined.
Experiment 1 found a significant positive correlation between the variability of participants’ subjective sleep efficiency over three days and their CAR variability. Additionally, a significant positive correlation was observed between CAR variability and trait anxiety scores over the three days, indicating that a smaller CAR variability in a stable environment is associated with lower levels of trait anxiety. Experiment 2 found no significant differences in CAR during the first two natural sleep days. However, on the third day, following a full night of sleep deprivation, CAR showed a marked blunting, with post-deprivation CAR levels being significantly lower than those recorded on the preceding two natural sleep days. Experiment 2 also found a significant positive correlation between CAR variability following sleep deprivation and psychological resilience,"and this significant correlation was independent of daily stress factors. Therefore, a higher CAR variability in a changing environment is associated with higher levels of psychological resilience. When using the traditional CAR mean as a measure to explore its relationship with trait anxiety and psychological resilience, no significant correlations were found in either experiment.
These results suggest that in addition to mean CAR, CAR variability can be regarded as an effective physiological indicator for measuring mental health. Smaller CAR variability in stable environments is associated with lower levels of trait anxiety, while greater CAR variability in more variable environments is associated with higher levels of psychological resilience. This study emphasizes the importance of considering CAR variability over multiple days to understand how individuals adapt to daily stressors and challenges, thus providing new perspectives and potential approaches for promoting mental health and designing effective intervention strategies in the future.
Keywords "cortisol awakening response (CAR), variability, sleep efficiency, trait anxiety, psychological resilience

