苗藥地錦草對肝纖維化模型大鼠的改善作用及機制研究



關鍵詞地錦草;肝纖維化;TNF-α/NF-κB信號通路;苗藥
肝纖維化(hepaticfibrosis,HF)是指在各種致病因素的作用下使肝臟受到損傷,從而激活靜止狀態的肝星狀細胞(hepaticstellatecell,HSC),使HSC大量增殖、轉化以及細胞外基質(extracellularmatrix,ECM)過度沉積和異常分布,最后形成纖維瘢痕的一種病理過程[1]。HF是眾多慢性重癥肝病的共同病理基礎,如果不加以防治會進一步發展為肝硬化,甚至肝癌[2―3]。研究指出,雖然HF是可逆的,但目前沒有批準的可用于抗HF的藥物[4];另有研究指出,肝臟疾病相關的死亡率會隨著HF的加劇而呈指數增長[2]。因此,對HF進行有效干預顯得尤為重要。
地錦草為大戟科植物地錦EuphorbiahumifusaWilld.或斑地錦EuphorbiamaculataL.的干燥全草,歸肝、胃、大腸經,具有清熱解毒、涼血止血、活血化瘀、利濕退黃的功效[5]。地錦草始載于《嘉裕本草》,為我國貴州苗族常用藥[5],又被稱為“地瓣草”(興義)、“斑鳩窩”(貴陽)”、“倒欠草”(銅仁)。在國醫大師周仲瑛的用藥案例中,地錦草常被用于治療HF和肝硬化[6]。地錦草的主要有效成分包括黃酮類、萜類、香豆素類等,具有抗腫瘤、降血脂、抗氧化、護肝等多種藥理作用[7]。有研究發現,地錦草及其提取物可明顯改善肝損傷小鼠的肝功能,初步證實了其對小鼠急性肝損傷的保護作用[8],但其是否可以緩解HF尚不明確。腫瘤壞死因子α(tumornecrosisfactor-α,TNF-α)/核因子κB(nuclearfactor-κB,NF-κB)信號通路的激活能誘導多種促炎介質的轉錄,刺激HSC轉化與ECM的過度沉積,從而促進HF的發生發展[9]。本研究擬從TNF-α/NF-κB信號通路出發,初步探討地錦草對HF大鼠的改善作用及機制,旨在為挖掘HF的潛在治療藥物奠定基礎。
1 材料
1.1 主要儀器
本研究所用主要儀器包括DYCZ-24DN型垂直電泳槽(北京六一儀器廠)、SH-523型化學發光成像系統(杭州申花科技有限公司)、L00686CeBlot?L1型快速濕轉儀(金斯瑞生物科技股份有限公司)、H1-16KR型臺式高速冷凍離心機(湖南可成儀器設備有限公司)、MultiskanFC型酶標儀(美國ThermoFisherScientific公司)、ND-100型超微量紫外-可見光分光光度計(杭州米歐儀器有限公司)、Chemray240型全自動生化分析儀(深圳雷杜生命科學股份有限公司)、QuantStudio6型實時熒光定量-聚合酶鏈式反應(PCR)儀(美國ABI公司)、Fi3型生物顯微鏡(尼康株式會社)。
1.2 主要藥品與試劑
本研究所用主要藥品與試劑包括地錦草(地錦)配方顆粒(神威藥業集團有限公司,批號230325Q,規格為1g配方顆粒相當于中藥飲片3.5g),水飛薊賓膠囊(天津天士力圣特制藥有限公司,批號35070805,規格35mg),小鼠源甘油醛-3-磷酸脫氫酶(GAPDH)單抗、兔源NF-κBp65多抗、兔源核因子κB抑制蛋白α(inhibitor-κbindingproteinα,IκBα)多抗、兔源轉化生長因子β1(transforminggrowthfactor-β1,TGF-β1)多抗(武漢三鷹生物技術有限公司,批號分別為10028230、00162675、10268-1-AP、21898-1-AP),α-兔源平滑肌肌動蛋白(α-smoothmuscleactin,α-SMA)單抗(英國Abcam公司,批號1000229-37),兔源TNF-α多抗(上海碧云天生物技術股份有限公司,批號AF8208),兔源磷酸化NF-κBp65(p-NF-κBp65)多抗(江蘇親科生物研究中心有限公司,批號4c61978),反轉錄試劑盒、總RNA提取試劑、高靈敏性染料法定量PCR檢測試劑盒(南京諾唯贊生物科技股份有限公司,批號分別為7E731J3、7E1141H4、7E0962H4),丙氨酸轉氨酶(alaninetransaminase,ALT)、天冬氨酸轉氨酶(aspartatetransaminase,AST)測定試劑盒(深圳雷杜生命科學股份有限公司,批號分別為20221130、20221103),羥脯氨酸(hydroxyproline,HYP)測定試劑盒(南京建成生物工程研究所有限公司,批號20230218),TNF-α、白細胞介素17(interleukin-17,IL-17)、IL-1β、IL-6酶聯免疫吸附測定(ELISA)試劑盒(江蘇酶免實業有限公司,批號均為202407),兔源α-SMA多抗(武漢塞維爾生物科技有限公司,批號AC240103198),Poly-HRP標記的羊抗鼠/兔二抗(廈門通靈生物醫藥科技股份有限公司,批號20709024D)。
1.3 實驗動物
本研究所用動物為SPF級健康SD大鼠,共38只,雄性,6~8周齡,體重(200±20)g,由貴州中醫藥大學動物研究所提供,動物生產許可證號為SCXK(黔)2021-0003。所有動物飼養于貴州中醫藥大學動物研究所,實驗期間大鼠自由進食與飲水。本研究嚴格遵循“3R”原則,動物處理嚴格按照《實驗動物管理條例》進行。
2 方法
2.1 分組、造模與給藥
大鼠適應性飼養1周后,按隨機數字表法將38只大鼠分為對照組(n=7),模型組(n=7),地錦草低、中、高劑量組(n=6)和水飛薊賓組(陽性對照,n=6)。除對照組外,其余各組大鼠均腹腔注射3mL/kg的四氯化碳(CCl4)和橄欖油(2∶3,V/V)溶液以制備HF模型,每周注射2次(每周一、四上午分別注射1次),連續8周[10];對照組大鼠腹腔注射等體積生理鹽水和橄欖油(2∶3,V/V)溶液。造模結束后,隨機處死對照組和模型組大鼠各1只,通過蘇木精-伊紅(HE)和Masson染色觀察大鼠的肝組織病理變化。根據Metavir分期評分系統——HF分期評分標準,以HF分期≥2期表示HF模型制備成功[11]。
根據2020年版《中國藥典》(一版)中地錦草推薦劑量與國醫大師周仲瑛教授在治療HF及肝硬化中地錦草的使用劑量[6],確定該藥的成人劑量為0.214g/kg,再通過體表面積法換算得到大鼠的臨床等效劑量為1.35g/kg,故地錦草低、中、高劑量組大鼠分別給予0.5、1、2倍臨床等效劑量地錦草,即0.675、1.35、2.70g/kg。水飛薊賓的成人劑量為3mg/kg,根據體表面積法換算后得到大鼠的臨床等效劑量為18.9mg/kg。造模成功后,各給藥組大鼠灌胃相應藥物,對照組和模型組大鼠灌胃等體積生理鹽水,灌胃體積均為10mL/kg,每天1次,連續30d。
2.2 動物取材與處理
末次給藥后,各組大鼠禁食不禁水12h,稱重,然后腹腔注射鹽酸替來他明鹽酸唑拉西泮(50mg/kg)麻醉大鼠,再于腹主動脈取血,室溫靜置2h后,離心得血清,置于-80℃暫存。取血結束后,用頸椎脫臼法處死大鼠,取完整肝臟,稱重;另取大鼠新鮮的肝右葉組織,一部分用4%多聚甲醛溶液固定,另一部分置于-80℃冰箱中保存,備用。
2.3 大鼠肝指數計算
根據大鼠取材前體重和取材后肝臟濕重計算肝指數:肝指數(%)=取材后肝臟濕重(g)/大鼠取材前體重(g)×100%。
2.4 大鼠血清中炎癥因子指標水平測定
取“2.2”項下各組大鼠血清適量,常規解凍后,按照ELISA試劑盒說明書操作,使用酶標儀檢測大鼠血清中TNF-α、IL-17、IL-1β、IL-6水平。
2.5 大鼠血清中肝功能指標及HYP水平測定
取“2.2”項下各組大鼠血清適量,常規解凍后,按照試劑盒說明書操作,使用全自動生化分析儀檢測大鼠血清中ALT、AST、HYP水平。
2.6 大鼠肝組織病理觀察
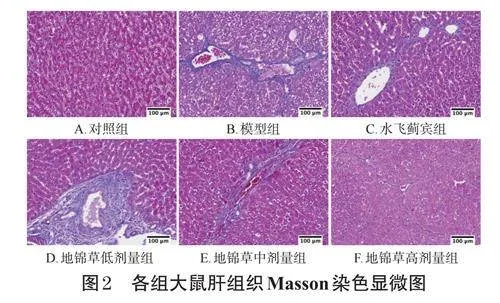
取“2.2”項下于4%多聚甲醛溶液中固定24h的大鼠肝組織,制備石蠟切片(厚度3μm),行HE和Masson染色后,封片,采用熒光顯微鏡于白光下觀察大鼠的肝組織病理變化。應用ImageProPlus6.0軟件對Masson染色照片進行陽性染色(呈藍色)面積測算,并計算陽性染色百分比[陽性染色百分比(%)=陽性染色面積/總面積×100%],以此為指標評價HF程度。
2.7 大鼠肝組織中TGF-β1、α-SMA表達測定
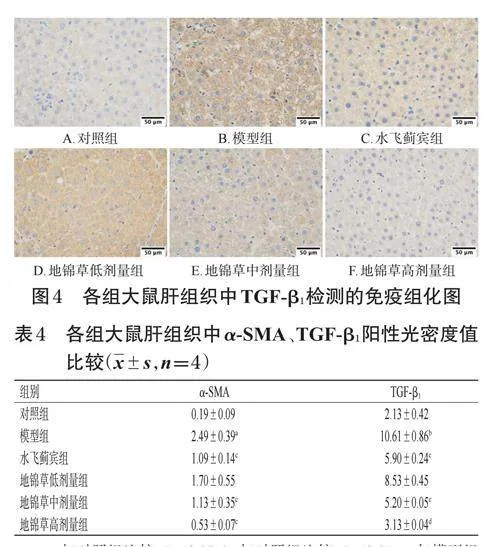
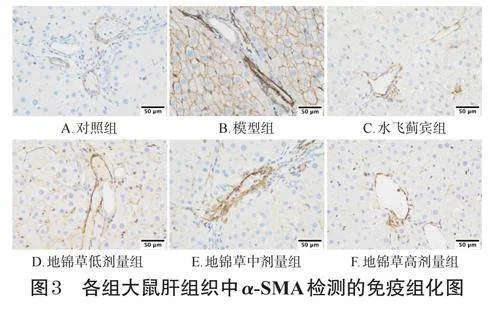
采用免疫組化法測定。取“2.2”項下凍存的大鼠肝組織(每組選4只大鼠的肝組織),經組織脫水、透明、浸蠟、包埋、切片與烤片、脫蠟、抗原修復、阻斷內源性過氧化物酶、血清封閉等常規操作后,加入TGF-β1、α-SMA一抗(稀釋比例分別為1∶100、1∶200),于4℃濕盒孵育15h。沖洗后,加相應二抗,于37℃孵育30min,再次沖洗后,加入DBA顯色液,常規進行復染、脫水、封片,最后采用生物顯微鏡拍照。采用ImageProPlus6.0軟件對免疫組化照片進行陽性光密度分析(陽性染色呈棕黃色),以陽性光密度值大小來反映蛋白的表達水平。
2.8 大鼠肝組織中TNF-α、NF-κBp65mRNA表達檢測
采用qRT-PCR法檢測。取“2.2”項下凍存的大鼠肝組織(每只大鼠約100mg),采用Trizol法提取肝組織中總RNA,測定總RNA濃度后,將其逆轉錄成cDNA,并以cDNA為模板進行PCR擴增。PCR反應程序如下:95℃預變性10min;95℃變性15s,60℃退火60s,95℃延伸15s,循環40次。擴增體系如下(20μL):cDNA模板4μL,SYBRGreenMasterMix10μL,上、下游引物各0.4μL,50×ROXReferenceDye20.4μL,H2O4.8μL。以GAPDH為內參,采用2-ΔΔCt法計算肝組織中TNF-α、NF-κBp65mRNA的相對表達量。引物由北京擎科生物科技股份有限公司設計并合成,引物序列及產物長度見表1。
2.9 大鼠肝組織中α-SMA及TNF-α/NF-κB信號通路相關蛋白表達測定
采用Westernblot法測定。取“2.2”項下凍存的大鼠肝組織(每組選3只大鼠的肝組織),提取組織中總蛋白,采用BCA法測定總蛋白濃度。將蛋白變性后,取蛋白40μg上樣進行電泳(恒壓180V,電泳時間40min),轉膜13min至聚偏二氟乙烯(PVDF)膜上。電轉移后,用含5%脫脂奶粉的TBST(磷酸化蛋白用1%BSA)浸泡PVDF膜,室溫搖床封閉2h;加入α-SMA、TNF-α、NF-κBp65、p-NF-κBp65、IκBα、GAPDH一抗(稀釋比例分別為1∶30000、1∶1000、1∶5000、1∶1000、1∶10000、1∶10000),于4℃孵育過夜;洗膜后,加入相應二抗(稀釋比例為1∶10000),室溫孵育2h。洗膜后進行曝光顯色,利用ImageProPlus6.0軟件分析條帶灰度值。以目標蛋白與內參蛋白(GAPDH)條帶灰度值的比值表示目標蛋白的表達水平,以p-NF-κBp65與NF-κBp65灰度值比值表示NF-κBp65蛋白的磷酸化水平。
2.10 統計學方法
使用SPSS29.0軟件對數據進行統計分析。符合正態分布的定量資料以x±s表示,多組間比較采用單因素方差分析,方差齊性時組間兩兩比較采用LSD-t檢驗,方差不齊性時組間兩兩比較采用Tamhane’sT2檢驗;不符合正態分布的定量資料以M(P25,P75)表示,組間比較采用Kruskal-WallisH檢驗。檢驗水準α=0.05。
3 結果
3.1 地錦草對HF大鼠肝指數的影響
對照組、模型組、水飛薊賓組和地錦草低、中、高劑量組大鼠的肝指數分別為(3.18±0.20)%、(4.07±0.17)%、(3.47±0.14)%、(3.59±0.21)%、(3.36±0.06)%、(3.30±0.14)%。與對照組比較,模型組大鼠的肝指數顯著升高(P<0.01);與模型組比較,各給藥組大鼠的肝指數均顯著降低(P<0.01)。
3.2 地錦草對HF大鼠血清中炎癥因子水平的影響
與對照組比較,模型組大鼠血清中TNF-α、IL-17、IL-1β、IL-6水平均顯著升高(P<0.01)。與模型組比較,各給藥組大鼠血清中上述指標水平均顯著降低(P<0.01)。結果見表2。
3.3 地錦草對HF大鼠血清中肝功能指標及HYP水平的影響
與對照組比較,模型組大鼠血清中ALT、AST、HYP水平均顯著升高(P<0.01)。與模型組比較,各給藥組大鼠血清中上述指標水平均顯著降低(P<0.05或P<0.01)。結果見表3。
3.4 地錦草對HF大鼠肝組織病理的影響
3.4.1 HE染色情況
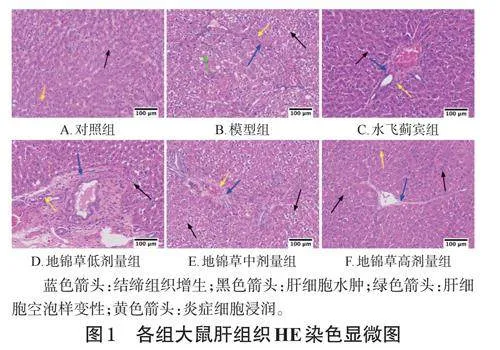
對照組大鼠肝組織結構完整,肝細胞排列不規則,未見明顯結締組織增生,間質內可見零散炎癥細胞浸潤。與對照組比較,模型組大鼠肝細胞排列更不規則,肝細胞水腫伴明顯胞漿疏松化,肝細胞實質內有少量空泡樣變性,匯管區可見大量結締組織增生,間質內可見少量炎癥細胞浸潤。與模型組比較,各給藥組大鼠肝組織在炎癥細胞浸潤、肝細胞水腫等方面均有不同程度改善。結果見圖1。
3.4.2 Masson染色情況
對照組大鼠肝組織未見結締組織增生,可見少量藍色膠原纖維。模型組大鼠肝組織藍色膠原纖維明顯增多,纖維間隔變粗。與模型組比較,各給藥組大鼠肝組織藍色膠原纖維明顯變細,纖維間隔變窄。與對照組[(0.06±0.01)%]比較,模型組大鼠陽性染色百分比[(2.44±0.68)%]顯著升高(P<0.01);與模型組比較,水飛薊賓組和地錦草高劑量組大鼠陽性染色百分比[分別為(0.65±0.17)%、(0.34±0.14)%]均顯著降低(P<0.05),但地錦草低、中劑量組大鼠陽性染色百分比[分別為(2.37±1.97)%、(1.69±0.25)%]差異均無統計學意義(P>0.05)。結果見圖2。
3.5 地錦草對HF大鼠肝組織中α-SMA、TGF-β1表達的影響
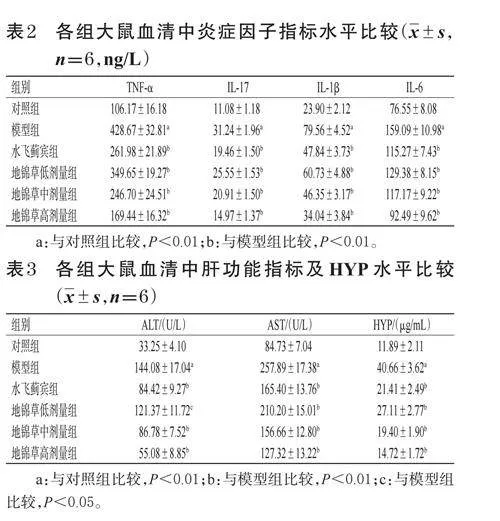
對照組大鼠肝組織中α-SMA檢測可見少量著色,主要分布在小動、靜脈血管壁,其余未見明顯廣泛表達;TGF-β1檢測可見少量表達,主要分布在肝細胞中。模型組大鼠肝組織中α-SMA檢測可見大片區高表達,主要分布在膠原纖維增生處及匯管區;TGF-β1檢測可見大片區高表達,顏色為深棕褐色,并出現顆粒狀改變。各給藥組大鼠肝組織中α-SMA、TGF-β1表達有不同程度減輕。與對照組比較,模型組大鼠肝組織中α-SMA、TGF-β1陽性光密度值均顯著升高(P<0.05或P<0.01);與模型組比較,水飛薊賓組和地錦草中、高劑量組大鼠肝組織中α-SMA、TGF-β1陽性光密度值均顯著降低(P<0.05或P<0.01)。結果見圖3、圖4和表4。
3.6 地錦草對HF大鼠肝組織中TNF-α、NF-κBp65mRNA表達的影響
與對照組比較,模型組大鼠肝組織中TNF-α、NF-κBp65mRNA相對表達量均顯著升高(P<0.01);與模型組比較,地錦草高劑量組大鼠肝組織中TNF-αmRNA相對表達量以及各給藥組大鼠肝組織中NF-κBp65mRNA相對表達量均顯著降低(P<0.01)。結果見表5。
3.7 地錦草對HF大鼠肝組織中α-SMA及TNF-α/NF-κB信號通路相關蛋白表達的影響
與對照組比較,模型組大鼠肝組織中α-SMA、TNF-α蛋白表達水平及NF-κBp65蛋白的磷酸化水平均顯著升高(P<0.01),IκBα蛋白表達水平顯著降低(P<0.01)。與模型組比較,各給藥組大鼠上述指標均顯著改善(P<0.05或P<0.01)。結果見圖5、表6。
4 討論
中醫學認為,肝臟從正常到HF乃至肝硬化是漸進發展的,不同階段對應的中醫病證不盡相同。中醫古籍雖無HF記載,但考究文獻,HF符合“肝積”“脅痛”“積聚”等病證的特征[12]。《靈樞·百病始生篇》記載“腸外有寒,汁沫與血相搏,則并合凝聚不得散,而積成矣”,因寒氣、水飲、痰飲、瘀血共同凝聚,積最基本的病理因素為“濕”和“瘀”。肝藏血,主疏泄,若因濕熱或外邪阻滯氣機,濕困氣阻熱擾而釀毒,則肝絡瘀阻,積聚已成,血行不暢[13]。若濕、熱、瘀、毒相互作用,互相影響,滯留蘊結在肝,肝脈瘀滯則肝運轉失司,則可形成肝積。“濕-熱-毒-郁-瘀-虛”是慢性肝病到HF的病機演化過程,有研究認為,“濕、熱、瘀、毒”四者相互聯系,相互轉化與兼雜,并且提出“濕熱瘀毒是HF形成和加重的始動因素和關鍵環節”假說[13],而地錦草的功效十分契合“濕熱瘀毒”理論的治療方向。
腹腔注射CCl4是構建HF大鼠模型的經典方法。CCl4可以激活庫普弗細胞,導致TNF-α、IL-1、IL-6等多種細胞因子和生長因子高表達,進而誘導肝損傷和HF[14]。本研究結果顯示,經地錦草干預后,HF大鼠血清中TNF-α、IL-17、IL-1β、IL-6水平顯著降低,表明地錦草具有抑制炎癥水平的作用。本研究病理結果顯示,經地錦草干預后,HF大鼠肝組織的炎癥細胞浸潤、肝細胞水腫情況均明顯好轉,且藍色膠原纖維明顯變少、變細,纖維間隔縮小,因此筆者推測地錦草具有恢復受損肝細胞、緩解HF進程的作用。HYP是膠原組織的主要成分之一,是反映膠原組織代謝和纖維化程度的重要指標[15]。本研究結果顯示,經地錦草干預后,HF大鼠血清中HPY水平降低,表明地錦草有減少膠原沉積的作用;此外,HF大鼠血清中ATL、AST水平降低,說明地錦草可恢復肝功能,緩解肝損傷。NF-κB是一種異二聚體,該家族有p50、p52、p65(RelA)、RelB和c-rel5種蛋白。NF-κB激活經典途徑是由TNF-α、IL-1等誘導的,該途徑依賴于NF-κB抑制因子激酶介導的IκBα磷酸化,導致其降解,從而使p50/p65NF-κB二聚體進入細胞核并激活基因轉錄[16]。炎癥常被認為是纖維化的重要環節,而NF-κB是炎癥反應的關鍵轉錄調節因子,可參與控制炎癥過程中許多基因的表達[16]。NF-κB通路可誘導多種促炎介質的轉錄、HSC的激活和增殖,阻斷細胞因子誘導的HSC凋亡效應[9],激活多條信號通路來調控細胞生長,誘導組織纖維化[17]。通過抑制NF-κB信號通路的激活可以達到減輕HF和炎癥的目的[18―19]。本研究結果顯示,經地錦草干預后,模型大鼠肝組織中TNF-α、α-SMA、TGF-β1蛋白表達以及TNF-α、NF-κBp65mRNA表達和NF-κBp65蛋白磷酸化水平均不同程度下調/下降,而IκBα蛋白表達水平顯著上調。這表明地錦草可通過降低炎癥水平,抑制NF-κBp65磷酸化,來抑制NF-κB信號通路的激活。
綜上所述,地錦草可能通過抑制TNF-α/NF-κB信號通路激活來緩解大鼠HF,但其具體作用機制有待進一步研究。

