細胞因子調節垂體M tT/S細胞中人生長激素基因啟動子的活性
龔鳳英 鄧潔英 朱惠娟 潘 慧 張殿喜
(中國醫學科學院北京協和醫院內分泌科衛生部內分泌重點實驗室,北京 100730)
細胞因子調節垂體M tT/S細胞中人生長激素基因啟動子的活性
龔鳳英 鄧潔英 朱惠娟 潘 慧 張殿喜
(中國醫學科學院北京協和醫院內分泌科衛生部內分泌重點實驗室,北京 100730)
目的:探討細胞因子白介素-11(IL-11)、睫狀神經營養因子(CNTF)和轉化生長因子(TGF-β)對大鼠垂體MtT/S細胞中人生長激素(hGH)基因啟動子活性的影響及其與垂體特異性轉錄因子Pit-1蛋白的關系。方法:采用熒光素酶報告基因的方法。首先建立含hGH基因啟動子(-484~30 bp)和熒光素酶融合基因的穩定轉化MtT/S細胞系,然后用細胞因子刺激,檢測細胞培養液和細胞裂解液中GH的含量,反映它們對GH分泌和合成的影響;檢測MtT/S細胞內熒光素酶的變化,說明細胞因子對hGH基因啟動子活性的作用。將Pit-1蛋白表達質粒(pcDNA-pit-1-cDNA)單獨轉染或與Pit-1反義寡核苷酸(Pit-1OND)共轉染于穩定轉化的M tT/S細胞中,觀察加入細胞因子后熒光素酶的變化,探討細胞因子的作用與Pit-1蛋白的關系。結果:IL-11(20 nmol/L)、CNTF(10 nmol/L)能刺激大鼠垂體MtT/S細胞中GH的分泌和合成,增強MtT/S細胞中熒光素酶的表達,分別增加到對照組的134%、122%。TGF-β(5nmol/L)能減少GH的分泌和合成,抑制熒光素酶的表達到對照組的72%。Pit-1蛋白過表達和表達被抑制對細胞因子的調節作用沒有影響。結論:IL-11、CNTF和TGF-β通過調節大鼠垂體MtT/S細胞中hGH基因啟動子活性影響GH的合成,Pit-1蛋白可能不參與這一調節作用。
細胞因子;生長激素基因啟動子;MtT/S細胞;Pit-1蛋白
近年來研究發現,垂體前葉細胞分泌的生長激素(Grow th hormone,GH)作為一種應激激素,在感染、炎癥等應激過程中分泌增加,與下丘腦-垂體-腎上腺軸分泌的腎上腺皮質激素釋放激素、腎上腺皮質激素等共同調節免疫功能,維持機體內環境的穩定。越來越多的研究表明,免疫細胞分泌的多種細胞因子如 IL-1、IL-2、IL-6、腫瘤壞死因子 α(TNF-α)、白細胞抑制因子(LIF)等均能調節垂體激素的分泌[1]。在原代培養的人和大鼠的正常或垂體瘤細胞以及M tT/S、A tT-20、TtT/GF 等垂體瘤細胞系中,IL-11、睫狀神經營養因子(CNTF)能刺激GH、催乳素(PRL)和促腎上腺皮質激素(ACTH)的分泌[2,3],轉化生長因子(TGF-β)能抑制GH、PRL的分泌[4]。我們最近的研究也發現,干擾素γ、IL-1和IL-6不僅能調節大鼠垂體GH3細胞中生長激素(GH)的分泌,還能調節GH的合成[5,6]。
Pit-1蛋白是垂體特異性轉錄因子,是POU蛋白家族(Pit-1、Oct-1和Unc86)成員之一,生長激素釋放激素(Growth hormone releasing hormone,GHRH)通過激活細胞內cAMP-蛋白激酶A信號轉導途徑促進垂體特異性核轉錄因子Pit-1蛋白的表達,后者與GH基因啟動子上-131~-106 bp、-93~-66 bp的兩個Pit-1位點結合,促進生長激素基因的轉錄[7]。
本實驗采用熒光素酶報告基因的方法,研究IL-11、CNTF和TGF-β對大鼠垂體MtT/S細胞中hGH基因啟動子活性的影響,并探討Pit-1蛋白在其中的作用,以期對GH基因表達調控的機制有進一步的認識。
1 材料與方法
1.1 質粒及質粒構建 pGL3-484-Luc2(簡稱484-Luc2)是含有熒光素酶編碼基因和人生長激素(hGH)基因啟動子-484~+30 bp序列的表達質粒,熒光素酶的表達受hGH基因啟動子的控制,可通過測定熒光素酶的活性,反映某些因素對基因啟動子活性的影響。pGL3-380-Luc2(380-Luc2),pGL3-250-Luc2(250-Luc2),pGL3-132-Luc2(132-Luc2)和pGL3-66-Luc2(66-Luc2)是分別含有hGH基因啟動子從-380 bp,-250 bp,-132 bp,-66 bp至+30 bp序列的質粒,pGL3-484-Luc1(484-Luc1)質粒含hGH基因啟動子-484~2 bp的序列。這些質粒的構建在我們以前的文獻中有詳細描述[5]。pcDNA3.1(+)為含新霉素抗性基因的質粒,pSV-β-Gal為內對照質粒,pGL3-Basic-Luc為無啟動子、無增強子、含熒光素酶報告基因的空白質粒,均為Promega公司產品。
1.2 穩定轉化MtT/S細胞系的建立 M tT/S細胞(美國ATCC公司)為大鼠垂體瘤細胞株,培養條件為完全DMEM(Dulbecco'smodified Eaglemedium,pH 7.3,美國Gibco BRL公司)培養液,3~4天換一次培養液。
采用脂質體轉染法。將生長狀態良好的MtT/S細胞以8×105個/孔接種于6孔培養板中,待細胞完全貼壁并生長至底面積的50%~60%時,換為OPTI-MEM減血清培養液(Gibco BRL公司),同時配制A、B兩液:A液為250μl OPTI-MEM 培養液和3μl陽離子脂質體DMRIE-C轉染試劑 (Gibco BRL公司);B液為250μlOPTI-MEM培養液和轉染質粒[包括2.0μg熒光素酶表達質粒pGL3-480-Luc和0.4μg新霉素抗性基因表達質粒pcDNA3.1(+),比例為5∶1],小心混合A 、B兩液,室溫放置30分鐘,加入上述M tT/S細胞中,37℃轉染5小時,更換為完全DMEM培養液繼續培養48小時。收集細胞,重新接種于60 mm培養皿中,并加入 300μg/L Geneticin G418(Gibco BRL公司),以篩選含新霉素抗性基因的單克隆。約2~3周后,獲得數十個單克隆,重新接種,二次克隆篩選。最后獲得8個穩定表達熒光素酶并帶有新霉素抗性基因的M tT/S細胞克隆,稱為穩定轉化MtT/S細胞。選擇其中的4個MtT/S細胞克隆用于本實驗,并始終用含 300μg/L G418的DMEM培養。
1.3 細胞因子刺激實驗 將生長良好的穩定轉化M tT/S細胞以3×105個/孔接種于24孔培養板中。24小時后,將細胞分為對照組和實驗組,對照組不作任何處理,實驗組分別加入一定濃度的IL-11、CNTF、TGF-β(美國 Calbiochem 公司),繼續培養 4小時后,收集培養液,用于GH測定。裂解細胞,檢測熒光素酶活性。
1.4 瞬時轉染實驗 將生長良好的穩定轉化MtT/S細胞以5×105個/孔接種于12孔培養板中,經與前述相似的轉染前處理后,將細胞分為對照組和實驗組,對照組轉染1.5μg pGL3-Basic-Luc空白質粒,實驗組單獨轉染1.0μg pcDNA3.1-Pit-1-cDNA或與0.5μgPit-1OND共轉染(用pGL3-Basic-Luc調節轉染時質粒DNA的總量,保證每孔所轉DAN總量相同)。轉染5小時后,更換成無血清DMEM培養液,繼續培養34小時,再次更換為無血清DMEM培養液,并加入細胞因子,作用4小時后,裂解細胞,檢測熒光素酶活性。
1.5 熒光素酶活性的測定和大鼠GH(rGH)的測定
按照熒光素酶檢測試劑盒(Promega公司)的操作說明,將細胞裂解,取20μl細胞裂解液至熒光測定管中,加入100μl熒光素酶反應底物,立即在化學發光儀上,檢測發光值,檢測時間為20秒。
按照大鼠GH酶免疫測定(EIA)試劑盒(英國Amersham公司)的操作說明,測定每一孔細胞培養液和裂解液的rGH濃度,每個標本重復測定2次,批內和批間差異分別為6.8%和10.2%。
2 結果
2.1 細胞因子對MtT/S細胞GH分泌和合成的影響 本實驗中,濃度為20 nmol/L IL-11和10 nmol/L CNTF刺激穩定轉化M tT/S細胞后,細胞培養液中的GH含量明顯增加,分別為對照組的151%和148%(圖1,P<0.001),同時MtT/S細胞裂解液中的GH含量也有輕度增加,分別增加到對照組的112%和115%。將細胞培養液和細胞裂解液中的GH含量相加(表示GH的合成),發現IL-11和CNTF均能增加GH合成到對照組的 146%和144%(圖1,P<0.001)。與此相反,濃度為5 nmol/L的TGF-β卻使MtT/S細胞培養液中的GH的含量顯著減少,為對照組的65%(圖1,P<0.001),同樣細胞裂解液中的GH也輕度減少,減少到對照組的85%。將二者相加后,表明 TGF-β能把GH合成抑制到對照組的64%(圖1,P<0.001)。
2.2 細胞因子對穩定轉化M tT/S細胞中熒光素酶表達的影響 濃度為20 nmol/L的IL-11和10 nmol/L的CNTF可促進MtT/S細胞中熒光素酶的表達,分別為對照組的134%和122%(圖2,P<0.001);濃度為5 nmol/L的TGF-β卻抑制MtT/S細胞中熒光素酶的表達,抑制到對照組的72%(圖2,P<0.001)。
2.3 細胞因子影響hGH基因啟動子活性與Pit-1蛋白的關系 本實驗中,將人Pit-1蛋白表達質粒pcDNA3.1-Pit-1-cDNA轉染于穩定轉化的MtT/S細胞后,觀察到Pit-1蛋白的過表達,使M tT/S細胞中熒光素酶的表達增加24%和27%(圖3,柱2與柱1,P<0.001;圖4,柱2與柱1,P<0.01),而加入Pit-1反義寡核苷酸Pit-1OND將Pit-1蛋白的表達抑制后,Pit-1的促進作用則消失。進一步地,我們將Pit-1蛋白表達質粒轉染于穩定轉化的MtT/S細胞的同時加入IL-11或CNTF,細胞中熒光素酶的活性比單獨加細胞因子時進一步增高,分別增加了37%和20%(圖3,柱5與柱4,P<0.01),分別是無Pit-1蛋白過表達對照組的161%和144%(圖3,柱5和柱1,P<0.001)。當加入Pit-1 OND將Pit-1蛋白的表達抑制后,IL-11和CNTF對hGH基因啟動子活性的促進作用依然存在(圖3,柱6與柱1,P<0.001)。
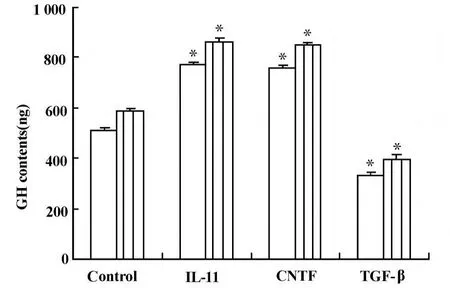
圖1 細胞因子對M tT/S細胞中GH分泌和合成的影響Fig.1 The effect of cytokines on GH secretion and synthesisin stableM tT/S cells
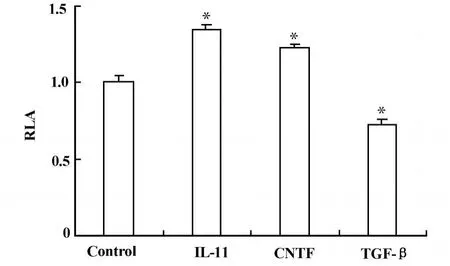
圖2 細胞因子對M tT/S細胞中熒光素酶表達的影響Fig.2 The effect of cytokines on the hGH gene promoter activities in stableM tT/S cells
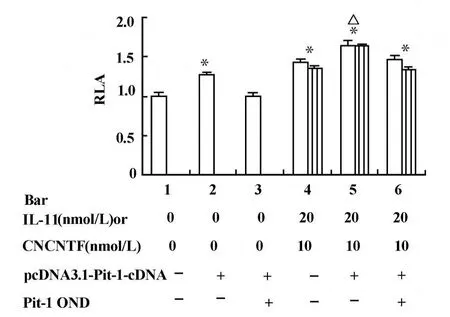
圖3 IL-11和CNTF促進hGH基因啟動子活性與Pit-1蛋白的關系Fig.3 The relationship between Pit-1 protein and the stimu latory effects of IL-11 and CNTF
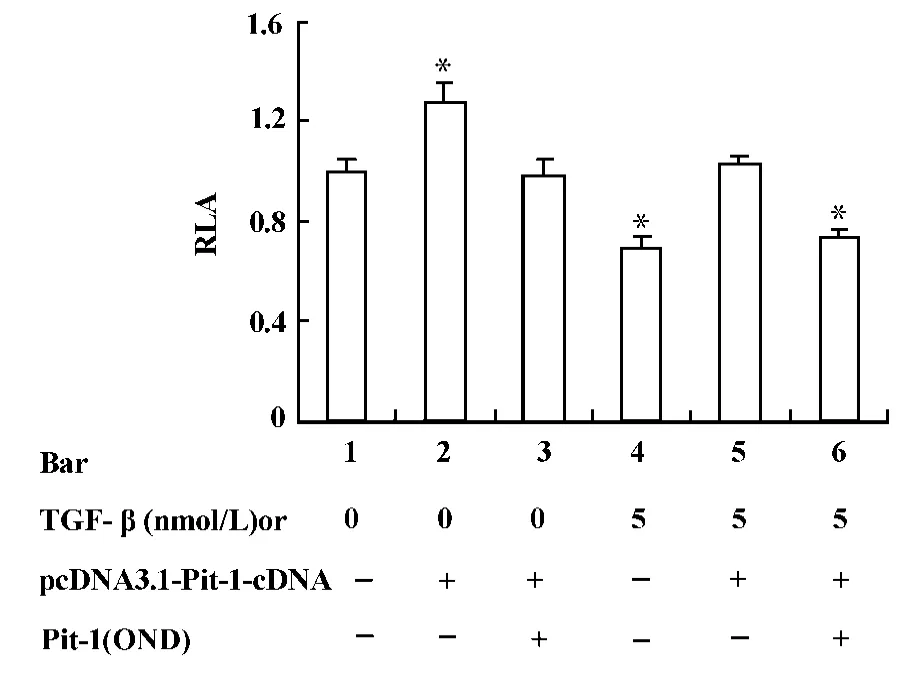
圖4 TGF-β抑制 hGH基因啟動子活性與 Pit-1蛋白的關系Fig.4 The relationship between Pit-1 protein and the inhibitory effect of TGF-β
在穩定轉化的MtT/S細胞中,轉染Pit-1蛋白表達質粒并加入TGF-β后,細胞中熒光素酶的活性是對照組的102%(圖4,柱5與柱1,P>0.05),當加入Pit-1OND抑制Pit-1蛋白的表達后,TGF-β的抑制作用重新又出現(圖4,柱6與柱1,P<0.01)。
3 討論
GH在應激調節過程中分泌增加的調節機制一直是目前該領域的研究熱點。本研究成功地建立了帶有新霉素抗性基因(用于細胞克隆篩選)和表達熒光素酶的穩定轉染M tT/S細胞株。在這一穩定轉染MtT/S細胞中,由于穩定整合有hGH基因啟動子序列和熒光素酶的融合基因,所以熒光素酶的表達受hGH基因啟動子的控制。也就是說任何因素對hGH基因啟動子的影響可以通過檢測細胞內熒光素酶的活性加以反應。本研究采用體外培養穩定轉染MtT/S細胞的方法,在細胞和分子水平研究了免疫細胞分泌的細胞因子IL-11、CNTF和TGF-β對GH分泌、合成以及hGH基因啟動子活性的影響。結果表明,IL-11和CNTF促進GH的分泌和合成,而TGF-β抑制GH的分泌和合成。Perez Catro等[2,3]和Auernhammer等[8]在原代培養的人和大鼠垂體細胞以及垂體瘤細胞系中,觀察到IL-11和CNTF刺激GH、PRL和ACTH的分泌。用RT-PCR的方法還發現,IL-11和CNTF能促進ACTH mRNA和GH mRNA的表達。Tan等[9]采用同樣的方法也發現,TGF-β不僅能抑制大鼠垂體細胞中PRL的基礎分泌,還能抑制甲狀腺激素釋放激素(TRH)刺激的PRL分泌,抑制PRLmRNA的表達。這些研究均表明,免疫細胞分泌的 IL-11、CNTF和TGF-β是多效性的細胞因子,除了通過經典的免疫通路調節機體的免疫和炎癥反應外,還能調節垂體分泌的應激激素GH等的分泌和合成,從另外一個途徑調節機體的免疫功能。但這些細胞因子調節GH合成的機制如何,目前文獻上還沒有肯定的報道。本研究采用熒光素酶報告基因的方法,首次報道IL-11和CNTF通過促進hGH基因啟動子的活性促進GH基因轉錄,從而促進GH的合成;而TGF-β則通過抑制hGH基因啟動子的活性抑制GH基因轉錄,抑制GH的合成。
Pit-1蛋白是垂體特異性轉錄因子,在GHRH促進GH基因表達的過程中,通過與GH基因啟動子上的兩個Pit-1位點結合,增加GH基因的轉錄。本實驗用Pit-1蛋白過表達和表達被抑制的方法研究也發現,Pit-1蛋白對hGH基因的基礎轉錄具有重要的調節作用。為了進一步探討Pit-1蛋白是否參與細胞因子對hGH基因轉錄的調節,本實驗將Pit-1蛋白表達質粒單獨轉染或與Pit-1反義寡核苷酸共轉染于穩定轉染M tT/S細胞中,然后加入細胞因子,結果發現Pit-1蛋白可能不參與 IL-11和CNTF所誘導的、TGF-β所抑制的hGH基因轉錄。這與我們以前研究的細胞因子 IL-1α、IL-6、IFN-γ對GH3細胞中hGH基因表達影響的結果相似[5,6]。Delidow等[10]也報道,TGF-β抑制大鼠垂體細胞中PRL基因和GH基因的轉錄與垂體特異性的轉錄因子Pit-1蛋白無關。上述資料提示,細胞因子對大鼠垂體MtT/S細胞中GH基因的轉錄調控機制可能與GHRH調節GH基因表達的機制不同。
M tT/S細胞系是1990年由日本學者Inoue等[11]從大鼠垂體瘤組織建立的。研究發現,MtT/S細胞具有正常GH分泌細胞的超微結構,包括發育良好的粗面內質網、高爾基復合體和豐富的GH免疫反應陽性的分泌顆粒[11]。該細胞能夠表達包括GH、糖皮質激素,鹽皮質激素和甲狀腺激素在內的多種激素的受體。進一步研究發現,GHRH能夠劑量依賴性地促進M tT/S細胞中生長激素的分泌[12]。Iwasaki等[13]采用體外培養M tT/S細胞的方法發現,甲狀腺激素和雌激素能夠直接刺激MtT/S細胞中GH基因啟動子的活性,而鹽皮質激素則抑制基礎GH的表達。我們前期的研究也發現,IL-1β和IL-6不僅能促進大鼠垂體MtT/S細胞中生長激素(GH)的分泌,還能調節促進GH的合成[14,15]。由于MtT/S細胞具有多種GH分泌細胞的特點,而且能表達IL-6、LIF、胰島素樣生長因子-1(IGF-1)等受體,并對多種激素和細胞因子具有良好的反應性,所以,近年來,MtT/S細胞像GH3細胞一樣被廣泛用來研究GH激素基因轉錄調控的分子和細胞機制。對比本實驗和我們以前的研究結果,發現MtT/S細胞和GH3細胞對同一細胞因子具有一致的反應性[5,6,14,15]。
熒光素酶報告基因方法用于基因轉錄調控的研究,具有簡便易行、定量測定、重復性較好的特點。細胞內熒光素酶的表達受其上游啟動子活性的影響,可通過檢測熒光素酶的活性,反映某些因素對基因啟動子活性的影響。有瞬時轉染和穩定轉染兩種方法。瞬時轉染熒光素酶報告基因的方法是用轉染試劑將熒光素酶表達質粒暫時導入到培養細胞核內,其獨立于細胞基因組染色體外,不隨DNA復制而復制,隨著細胞增生傳代,表達熒光素酶的細胞逐漸減少,所以這一方法不能用于連續長期實驗,而且實驗的重復性和準確性也因必須重新轉染而受到限制。穩定轉染熒光素酶報告基因方法,利用DNA復制時同源重組的原理,將熒光素酶表達質粒穩定整合于細胞基因組的細胞克隆篩選出來,并建立成穩定轉化的細胞系。該質粒DNA隨細胞基因組DNA復制而復制,可以代代相傳并穩定表達熒光素酶,這樣就大大簡化了實驗操作,而且重復性和準確性均較好。在本實驗和以前的轉染實驗中,我們也觀察到了瞬時轉染的局限性和穩定轉染的優越性。Hexdall等和Blanton等[16,17]在Hela細胞和豬肌細胞中對兩種轉染方法進行比較后,也得出了相似的結論。本研究成功地建立了帶有新霉素抗性基因(用于細胞克隆篩選)并表達熒光素酶的穩定轉化M tT/S細胞系,為今后GH激素基因轉錄調控機制的研究提供了良好的實驗工具。
綜上所述,本研究表明,細胞因子 IL-11、CNTF和TGF-β通過調節大鼠垂體M tT/S細胞中hGH基因啟動子活性影響GH的合成,IL-11和CNTF起促進作用,TGF-β則起抑制作用。垂體特異性轉錄因子Pit-1蛋白可能不參與這一調節過程。
1 Nagai Y,OgasawaraH,Taketa Yetal.Expression of inflammatory-related factors in porcine anterior pituitary-derived cell line[J].Vet Immunol Immunopathol,2008;124(3-4):201-208.
2 PerezCastro C,CarbiaNagashima A,Paez Pereda Metal.Effects of the gp130 cytokines ciliary neurotropic factor(CNTF)and interleukin-11 on pituitary cells:CNTF receptorson human pituitary adenomasand stimulation ofprolactin andGH secretion in normal ratanteriorpituitary aggregate cultures[J].JEndocrinol,2001;169(3):539-547.
3 Perez Castro C,Nagashima A C,Pereda M Petal.The gp130 cytokines interleukin-11 and ciliary neurotropic factor regulate through specific receptors the function and growth of lactosomatotropic and folliculostellate pituitary cell lines[J].Endocrinology,2000;141(5):1746-1753.
4 Coya R,Alvarez CV,Perez Fetal.Effectsof TGF-β1 on prolactin synthesisand secretion:An in-vitro study[J].JNeuroendocrinol,1999;11(5):351-360.
5 Gong F Y,Deng JY,Shi Y F.The regulatorymechanism by which interleukin-6 stimulatesGH-geneexpression in ratGH3cells[J].JEndocrinol,2006;190:397-406.
6 Gong F Y,Deng JY,Shi Y F.Stimulatory effect of interleukin-1beta on growth hormonegene expression and growth hormone release from ratGH3cells[J].Neuroendocrinology,2005;81:217-228.
7 McElvaineA T,KorytkoA I,KilenSMetal.Pituitary-specificexpression and Pit-1 regulation of the rat growth hormone-releasing hormone receptor gene[J].MolEndocrinol,2007;21:1969-1983.
8 AuernhammerC J,Melmed S.Interleukin-11 stimulates proopiomelanocortin gene expression and adrenocorticotropin secretion in corticotroph cells:Evidence for a redundantcytokine network in thehypothalamo-pituitary-adrenal axis[J].Endocrinology,1999;140(4):1559-1566.
9 Tan SK,Wang F F,Pu H Fetal.Differential effect of age on transforming growth factor-β1 inhibition of prolactin gene expression versus secretion in rat anterior pituitary cells[J].Endocrinology,1997;138(3):878-885.
10 Delidow B C,BillisW M,Agarwal Petal.Inhibition of prolactin gene transcription by transforming growth factor-βin GH3cells[J].Mol Endocrinol,1991;5(11):1716-1722.
11 InoueK,HattoriM,Sakai Tetal.Establishment of a series of pituitary clonal cell lines differing inmorphology,hormone secretion,and response to estrogen[J].Endocrinology,1990;126:2313-2320.
12 Nogam iH,Hiraoka Y,Inoue Ketal.Regulation of 5'-promoter activity of the rat growth hormone and growth hormone-releasing hormone receptor genes in theM tT/Sand MtT/E cells[J].Neuroendocrinology,2006;84(1):31-41.
13 IwasakiY,Morishita M,AsaiMetal.Effects of hormones targeting nuclear receptorson transcriptional regulation of the growth hormone gene in the MtT/S rat somatotrope cell line[J].Neuroendocrinology,2004;79:229-236.
14 Gong FY,Deng JY,ShiY F.Mek and p38MAPK-dependantpathways are involoved in the positiveeffectof interleukin-6 on human growth hormonegene expression in rat MtT/S somatotroph cells[J].Chin Med Sci J,2008;23(2):73-80.
15 Gong F Y,Deng JY,Shi Y F.Effect of interleukin-1βon growth hormonegeneexpression and its possiblemolecularmechanism in ratMtT/S somatotroph cells[J].ChinMed Sci J,2008;23(4):375-382.
16 Hexdall L,Zheng C F.Stable luciferase reporter cell lines for signal transduction pathway readout using GAL4 fusion transactivators[J].Biotechniques,2001;30(5):1134-1138.
17 Blanton JR Jr,BidwellCA,Sanders DAetal.Plasmid transfection and retroviral transduction of porcine muscle cells for cell-mediated gene transfer[J].JAnim Sci,2000;78(4):909-918.
[收稿2009-11-02 修回2009-12-07]
(編輯 許四平)
Cytokines regulate the promoter activitiesof human grow th hormonegene in rat pituitary M tT/S cells
GONGFeng-Ying,DENGJie-Ying,ZHUHui-Juan,PANHui,ZHANGDian-Xi.DepartmentofEndocrinology,KeyLaboratoryofEndocrinologyofMinistryofHealth,PekingUnionMedicalCollegeHospital,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100730,China
Objective:To study the effectof interleukin-11(IL-11),ciliary neurotropic factor(CNTF)and transform ing grow th factor-β(TGF-β)on the hGH gene promoter activity in ratpituitaryM tT/S cells and the interaction with pituitary-specific transcription factor Pit-1.Methods:Stab le transformedMtT/S cell linewhich containshGH gene promoter-484-30 bp and luciferase reportergene firstly established,then the concentration of GH in themedium and lysate ofMtT/S cells and luciferase activities in M tT/S cellsweremeasured after treatment these cellsw ith the above cytokines,the effects of cytokines on secretion and synthesis of GH,and the promoter activity of the hGH gene were observed.Results:The Results showed that IL-11(20 nmol/L),CNTF(10 nmol/L)and TGF-β(5 nmol/L)regu lated secretion and synthesis of GH,and the luciferase expression in stable transformed MtT/S cells.IL-11 and CNTF had the stimulatory effect,whereas TGF-βhad the inhibitory effect.Neitheroverexpression of Pit-1 nor inhibiting Pit-1 exp ression affected the regulatory roleof these cytokines.Conclusion:IL-11,CNTF and TGF-βregulate theGH p roduction in pituitaryMtT/S cell line by regulating the hGH gene promoter activity.Pit-1 may notbe involved in these actions.
Cytokine;hGH gene promoter;MtT/S cells;Pit-1 protein
R335.+1
A
1000-484X(2010)02-0146-05
龔鳳英(1967年-),女,副研究員,碩士生導師,主要從事神經-內分泌-免疫網絡的研究,E-mail:fygong5074@yahoo.com.cn;
及指導教師:鄧潔英(1939年-),女,研究員,博士生導師,主要從事神經-內分泌-免疫網絡的研究。
·臨床免疫學·

