CALHM1與阿爾茨海默病
孫素霞 李文軍 鄒 飛
(南方醫科大學公共衛生與熱帶醫學學院,廣東 廣州 510515)
阿爾茨海默病(Alzheimer′s disease,AD)作為老年性癡呆的主要類型,是老年人常見的中樞神經系統退行性疾病,臨床表現為持續性、進行性的記憶、認知障礙。顯著的病理特征是以 β-淀粉樣蛋白(amyloid-β,Aβ)為核心成分的老年斑(senile plaques,SP)和以異常過度磷酸化的 tau蛋白為核心成分的神經纖維纏結(neurofibrillary tangles,NFTs)〔1,2〕。 AD的病因復雜,涉及遺傳、環境、代謝、病毒感染等多種因素,其中遺傳因素是主要原因之一。目前已確定與AD相關的基因有 4種,分別是淀粉樣前體蛋白(amyloid precursor protein,APP)基因、早老素 1(presenilin 1,PS1)基因、早老素 2(presenilin 2,PS2)基因和載脂蛋白 E(apolipoprotein E,ApoE)基因。基于分子生物學及遺傳學的研究表明,上述 4種基因只能解釋AD中 50%與其相關,提示還有其他與 AD相關的基因〔3,4〕。最近發現一種新的基因-鈣平衡調節基因 1(calcium homeostasis modulator 1,CALHM1),該基因可通過調控細胞內 Ca2+濃度來調節 Aβ的生成,從而促進 AD的發生〔5〕。本文主要闡述 CALHM1基因的特性及其與 AD發生之間的關系。
1 CALHM1特性
Dreses-Werringloer等利用 TissueInfo方法篩選到位于海馬區、與 AD發生相關的基因 -FAM26C,并為其命名為 CALHM1。CALHM1基因定位于 10號染色體 q24.33位點,編碼一個開放閱讀框架(open reading frame,ORF)、包含四個疏水區和兩個N端糖基化(分別位于 N74和 N140位點)序列。CALHM1基因表達的糖基化蛋白主要表達于成人腦組織中,其他組織器官表達量非常低或未檢出。免疫熒光檢測結果顯示 CALHM1蛋白主要定位于內質網膜和細胞膜〔5〕。
CALHM1蛋白單體不能構成功能性的離子通道,但可在細胞內以非還原狀態形成二聚體和三聚體,進而構成離子通道的孔徑。CALHM1蛋白與 N-甲基 D-門冬氨酸(N-methy-D-aspatrate,NMDA)受體非常相似,通過比較他們的序列,發現二者都包含一個高度保守的、位于C端第二個疏水區的N72位點,該位點發生突變后,CALHM1蛋白形成的通道對Ca2+的通透性將會被抑制。在爪蟾卵母細胞中發現CALHM1蛋白形成的通道可滲透 Na+,在中國倉鼠卵巢細胞(CHO)中發現,CALHM1蛋白形成一種構成性的Ca2+選擇性陽離子通道,這些結果表明CALHM1是一種與其他 Ca2+通道不同的、新型的 Ca2+通道〔5〕。
2 CALHM1可調控胞質中Ca2+濃度
在結構上 CALHM1與 NMDA受體存在許多相似性,二者都包含三次跨膜區和一個回流環,這些結構可幫助他們形成離子通道的孔徑。因為部分 NMDA受體是一種膜蛋白,可介導Ca2+通過細胞膜,調節胞內 Ca2+濃度,所以推測 CALHM1也可能形成細胞質膜和內質網膜上的 Ca2+通道,控制胞質中 Ca2+的水平,Dreses-Werringloer等研究的結果證明該假設存在〔5〕。過表達胞內 CALHM1蛋白可促進胞外Ca2+流入胞內,通過使用相關通道工具藥的研究結果顯示,通過 CALHM1的胞外Ca2+內流不能被已知的鈣通道的阻斷劑(如:Nifedipine,SNX-482,DTL等)所阻斷,但能被非特異性的鈣通道阻斷劑(Co2+,Ni2+)所阻斷;證明 CALHM1可在細胞膜上形成離子通道介導Ca2+內流,而且 CALHM1所形成的離子通道有別于以前所知的電壓門控鈣離子通道(voltage gated Ca2+channel,VGCC)和鈣池調控鈣離子進入(store-operated Ca2+entry,SOCE)〔5,6〕。
3 細胞內Ca2+濃度與 AD發生之間的關系
早在 1987年,就有研究認為細胞內 Ca2+穩態失衡與AD發生之間存在一定關系〔7〕。隨著研究的深入,多數學者認為細胞內Ca2+穩態失衡主要通過兩個方面促進AD的發生,一方面Ca2+穩態失衡可影響與 AD發生密切相關的 Aβ的產生和代謝,另一方面Ca2+穩態失衡可影響tau蛋白的產生和代謝;反之,這些與AD發生相關的病理蛋白的過度積聚又可促進細胞內Ca2+穩態的進一步失衡,進而促進神經元功能的進一步紊亂和神經元的退行性疾病,誘導 AD的發生。隨后研究進一步證實了該假設,如 PS1/PS2基因的突變可影響內質網中 Ca2+的釋放和胞外 Ca2+通過鈣池操縱性鈣通道(store-operated channels,SOC)進入細胞內,從而誘導家族性AD(familial AD,FAD)的發生〔8〕。盡管缺乏 AD病人腦細胞中確實存在 Ca2+穩態失衡的直接證據,但病人尸體的檢驗結果證明腦細胞中鈣依賴的蛋白酶含量顯著增加〔9〕。
4 CALHM1與胞內 Ca2+濃度及 AD發生之間的關系
隨著 AD病因的研究,細胞內 Ca2+穩態失衡誘導Aβ增加的假說得到了越來越多的證據,該假說認為,AD是一種由于基因缺陷直接或間接改變APP基因表達或其酶解過程從而影響Aβ聚集穩定性的病理綜合征,Aβ產生與清除之間的平衡逐漸改變,聚集態的 Aβ積累形成 SP和過度磷酸化 tau蛋白為核心的 NFTs〔10〕。在已發現的 4個 AD基因中,APP、PS1、PS2的變異都導致 Aβ生成增加〔11,12〕,載脂蛋白(Apo)E4則影響 Aβ的沉積。細胞中 Ca2+濃度也可顯著影響 APP的加工過程,促進Aβ的生成〔13〕。在 N2a細胞中過表達 CALHM1可顯著抑制細胞外 Aβ的產生,同時增加 sAPPα的含量,但不影響 APP。
對晚發型 AD(LOAD)病人和正常人的基因多態性研究發現〔5〕,CALHM1基因的單核苷酸序列存在兩個非同義突變rs2986017(+394 C/T;P86L)和rs17853566(+927 C/A;H264N),其中 rs17853566多態性是指氨基酸序列中的第 86位點的脯氨酸被亮氨酸所取代,導致CALHM1蛋白功能丟失,減少細胞膜對 Ca2+的滲透性,胞內 Ca2+濃度下降,進而影響 APP的加工過程,促進Aβ的產生和聚集,最終誘導AD的發生。病例對照研究結果顯示,若有一個CALHM1副本可使 AD的發病率由 20%增加到 44%,若是有兩個 CALHM1副本則發生AD的可能性增加為 77%。其中 rs17853566多態性在 AD病人與對照組間差異沒有顯著性。
相對于細胞外和內質網等鈣庫,胞質中Ca2+濃度相對較低,胞質中 Ca2+濃度的穩定受控于胞膜上的 VGCC、SOCE、CALHM1和 Ca-ATP酶通道和內質網膜上的鈣泵(SERCA)、蘭尼定受體(RyR)、三磷酸肌醇受體(IP3R)介導的受體調控的鈣通道(receptor operated calcium channel,ROC)和 CALHM1;PS蛋白發生突變后可增加 IP3R和RyR介導的內質網中Ca2+釋放,并抑制 SERCA將胞質中 Ca2+泵入內質網,從而升高胞質中Ca2+濃度;CALHM1基因發生突變后功能丟失,引起內質網中Ca2+的被動釋放,同樣升高胞質中 Ca2+濃度。胞質中 Ca2+濃度的升高可促進 β-淀粉酶和 γ-淀粉酶對APP的剪切過程,從而增加 Aβ的生成。反之,若CALHM1基因為發生突變,Ca2+可正常通過 CALHM1通道,從而促進 α-淀粉酶對 APP的剪切過程,減少 Aβ的生成。因此,細胞內 Ca2+穩態失衡可影響 Aβ的產生和代謝,提示細胞內Ca2+穩態失衡可能是AD的病因之一〔13〕(圖 1所示)。但也有文獻報道,CALHM1基因的多態性與 AD發生之間不存在相互關系〔14~16〕。
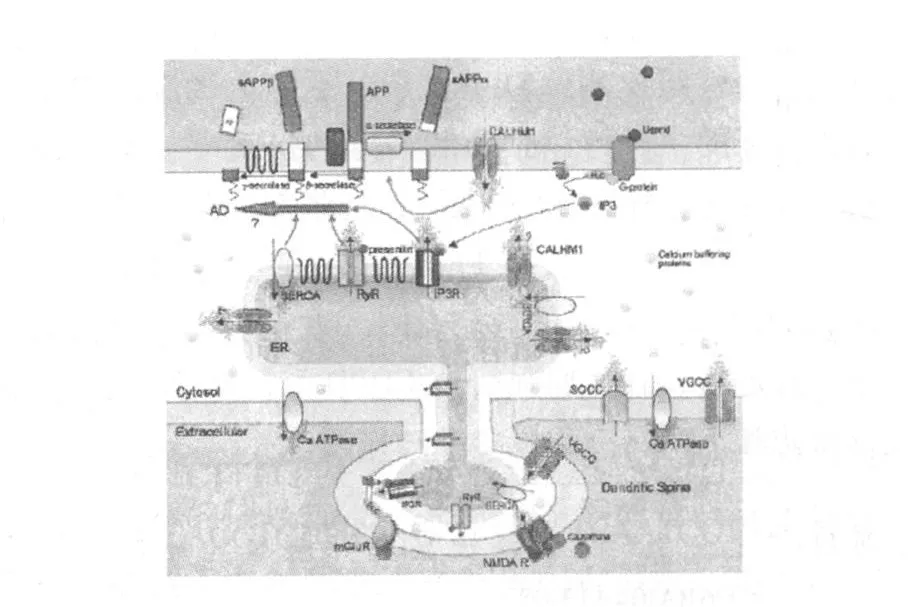
圖1 鈣信號通路〔13〕
5 結 語
CALHM1是表達于成人腦組織細胞膜和內質網膜、分子特性尚未完全清楚、構成性的Ca2+選擇性陽離子通道。與NMDA受體具有許多相似性,可調節胞質中 Ca2+濃度,但與VGCC和SOCE等通道明顯不同。CALHM1發生突變(P86L)后可通過改變胞內 Ca2+濃度調節Aβ的產生和聚集,從而增加 AD發生的危險性。這些結果為腦神經系統中Ca2+穩態失衡和APP代謝異常參與 AD的病理生理過程提供更多的證據,也提示 CALHM1是否可作為一種潛在的、診斷和治療AD的分子靶點。
1 Mattson MP.Pathways towards and away from Alzheimer′s disease〔J〕.Nature,2004;430(7000):631-9.
2 Hardy J,Selkoe D J.The amyloid hypothesisof Alzheimer′s disease:progress and problems on the road to therapeutics〔J〕.Science,2002;297(5800):353-6.
3 Serretti A,Olgiati P,De Ronchi D.Genetics of Alzheimer′s disease.A rapidly evolving field〔J〕.J Alzheimers Dis,2007;12(1):73-92.
4 Cacabelos R,Fernandez-Novoa L,Lombardi V,et al.Molecular genetics of Alzheimer′s diseaseand aging〔J〕.Methods Find Exp Clin Pharmacol,2005(Suppl A);27:1-573.
5 Dreses-Werringloer U,Lambert JC,Vingtdeux V,et al.A Polymorphism in c ALHM1 influences Ca2+Homeostasis,Aβ Levels,and alzheimer′s disease risk〔J〕.Cell,2008;133(27):1149-61.
6 Tanzi RE,Bertram L.Alzheimer′s disease:the latest suspect〔J〕.Nature,2008;454(7205):706-8.
7 Khachaturian ZS.Hypothesis on theregulation of cytosol calcium concentration and the aging brain〔J〕.Neurobiol Aging,1987;8(4):345-6.
8 LaFerla FM.Calcium dyshomeostasis and intracellular signalling in Alzheimer′s disease〔J〕.Nat Rev Neurosci,2002;3(11):862-72.
9 Green KN,Smith IF,Laferla FM.Role of calcium in the pathogenesis of Alzheimer′s disease and transgenic models〔J〕.Subcell Biochem,2007;45:507-21.
10 Bertram L,McQueen MB,Mullin K,et al.Systematic meta-analyses of Alzheimer disease genetic association studies:the AlzGene database〔J〕.Nat Genet,2007;39(1):17-23.
11 Citron M,Westaway D,Xia W,et al.Mutant presenilins of Alzheimer′s disease increase production of 42-residue amyloid beta-protein in both transfected cells and transgenic mice〔J〕.Nat Med,1997;3(1):67-72.
12 Scheuner D,Eckman C,Jensen M,et al.Secreted amyloid beta-protein similar to that in the senile plaques of Alzheimer′s disease is increased in vivo by the presenilin 1 and 2 and APPmutations linked to familial Alzheimer#s disease〔J〕.Nat Med,1996;2(8):864-70.
13 Green KN,Laferlal FM.Linking calcium to Abeta and Alzheimer′s disease〔J〕.Neuron,2008;59(2):190-4.
14 Sleegers K,Brouwers N,Bettens K,et al.No association between CALHM1 and risk for Alzheimer dementia in a Belgian population〔J〕.Hum Mutat,2009;30(4):570-4.
15 Minster RL,Demirci FY,DeKosky ST,et al.No association between CALHM1 variation and risk of Alzheimer disease〔J〕.Hum Mutat,2009;30(4):566-9.
16 Bertram L,Schjeide BM,Hooli B,et al.No association between CALHM1 and Alzheimer′s disease risk〔J〕.Cell,2008;135(6):993-4.

