雷帕霉素階梯用藥方案在異基因大鼠皮瓣移植模型中的療效觀察
肖博 李揚 付蘇 劉蓓 郭樹忠
嚴重燒創傷后遺留的組織缺損較難修復,自體 組織移植后形態、功能均不佳。復合組織異體移植(composite tissue allotransplantation,CTA)是修復此類缺損的有效方式。CTA是包含多種組織類型的異基因移植。迄今,已有數十例手移植和十多例顏面移植成功應用于臨床[1-4],極大改善了患者的生活質量。然而,復合組織一般包含諸如皮膚、肌肉、神經、骨、軟骨、脂肪等多種組織成分,引起的宿主免疫排斥反應復雜而強烈,需要的免疫抑制劑用量超過一般器官移植所需的量。長期、大量應用免疫抑制劑后會對受者產生諸如抵抗力下降、臟器損傷、惡性腫瘤發生率增加等副作用,對機體損傷很大。因此,尋找能夠有效減少抗排斥反應藥物用量的方法是CTA能否廣泛應用的關鍵。異基因移植后排斥反應在移植后早期很強,逐漸減弱,因此術后免疫抑制劑的用量也從大到小,形成階梯用藥。雷帕霉素是一種低毒的新型免疫抑制劑,我們應用大鼠下腹部皮瓣異基因移植模型進行雷帕霉素階梯用藥療效觀察,現報道如下。
1 材料與方法
1.1 實驗動物及試劑
雄性Lewis(RT11)和 Brown Norway(簡稱 BN,RT1n)近交系大鼠,8~l0周齡,體質量0.20~0.25 kg。均購自北京Vital River公司,購買后由第四軍醫大學實驗動物研究中心專業人員負責飼養,飼養條件為清潔級。雷帕霉素原藥購自華北制藥廠,用生理鹽水溶解制成質量濃度為1 g/L溶液-20℃保存。
1.2 模型制作及分組
以BN鼠為供體,Lewis鼠為受體,以股動、靜脈為蒂進行同種異體下腹部游離皮瓣移植。采用戊巴比妥鈉麻醉,劑量為50 mg/kg,腹腔注射給藥,術中必要時追加1/4量。手術過程簡述如下:在大鼠下腹部設計4 cm×4 cm大小皮瓣切取范圍。皮瓣的切割深度在腹肌肌膜表面。分離出腹壁淺動靜脈及股動靜脈,而后在腹壁淺動靜脈發出點遠端結扎并剪斷大鼠股動靜脈,在大鼠腹股溝韌帶外切斷股動靜脈,皮瓣游離完成。相同范圍切除供體皮膚組織,小心解剖股動靜脈。供體股動靜脈和受體股動靜脈采用端端吻合。動靜脈吻合完成后,依層縫合肉膜和皮膚,移植手術完成。根據不同雷帕霉素用藥方案分為4組:Ⅰ 組(n=5),不使用任何藥物;Ⅱ 組(n=5),雷帕霉素 2 mg·kg-1·d-1;Ⅲ組(n=5),雷帕霉素 4 mg·kg-1·d-1;Ⅳ組(n=8),雷帕霉素術后1~2周 4 mg·kg-1·d-1,術后第 3 周改為2 mg·kg-1·d-1,第 4 周起 1 mg·kg-1·d-1。3 個給藥組均采取腹腔注射的方式給藥,用藥直至皮瓣發生排斥反應壞死或至術后60 d(觀察終點)。
1.3 大體觀察
術后每天觀察皮瓣變化,觀察的排斥反應征象包括紅斑、皮膚質地變硬、表皮脫屑和皮瓣發黑壞死。以皮瓣組織完全壞死記為排斥反應終點。
1.4 組織病理學檢查
術后7 d對各組皮瓣組織進行皮膚活組織檢查(以下簡稱活檢),術后15、30 d對Ⅱ、Ⅲ、Ⅳ組皮瓣組織進行皮膚活檢,各組動物在每個時間點選取3只進行取材活檢。取材方法為:給予動物半量麻醉,剪開一側皮瓣邊緣縫線,每次剪去1 cm×0.5 cm皮瓣組織,電凝止血后將皮瓣組織重新縫合于受體皮膚。所取組織用10%甲醛溶液固定,然后儲存于70%的乙醇中,切片,HE染色,進行病理學檢查。參考Banff 07標準[5],對組織切片進行病理學分級。0級,沒有或極少炎癥細胞浸潤;1級,輕微血管周圍炎,表皮不受累;2級,中等程度炎癥細胞浸潤,有或沒有表皮及皮膚附屬器受累[限于棘層細胞水腫或發生胞吐(exocytosis)現象];3級,真皮層嚴重的炎癥細胞浸潤,表皮受累包括表皮凋亡、角化不良、角質溶解(keratolysis)等;4級,壞死性急性排斥反應,表現為表皮或皮膚其他結構壞死。
1.5 統計學方法
移植皮瓣存活數據制成Kaplan-Meier生存曲線,組間比較應用對數秩檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 移植皮瓣存活情況和大體觀察
各組移植皮瓣存活曲線見圖1。
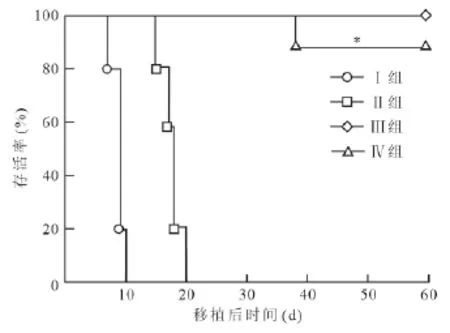
圖1 各組移植皮瓣存活情況
Ⅳ組與Ⅱ組移植皮瓣存活率差異有統計學意義(P<0.05),但Ⅳ組與Ⅲ組間差異無統計學意義(P>0.05)。
Ⅰ組排斥反應進展迅速,移植皮瓣排斥反應過程表現為顏色逐漸蒼白,皮瓣腫脹逐漸加重,最終因微血管血栓、阻塞至皮瓣組織發黑壞死(見圖2A)。Ⅱ組給藥后皮瓣無明顯腫脹,顏色質地正常。術后10 d左右出現表皮脫屑,繼而出現皮瓣發紅,質地變硬,表皮脫落,直至皮瓣于術后16~20 d壞死(見圖2B)。Ⅲ組直至術后60 d,5例受體均未出現排斥反應征象。Ⅳ組為階梯用藥組,除1例于術后30 d開始發生急性排斥反應(見圖2C),術后38 d皮瓣壞死外,其余7例直至觀察終點均未出現排斥反應征象。Ⅲ組和Ⅳ組存活至觀察終點的受體移植皮瓣組織變化情況為:術后皮瓣無明顯腫脹過程,顏色正常,質地柔軟;術后20 d左右開始,皮瓣表面毛發開始脫落,同時新的表皮組織形成;術后30 d左右,這一過程完成(見圖2D),形成新的表皮組織。術后50 d左右,新的毛發開始長出。這些結果提示,持續應用較小劑量的雷帕霉素(2 mg·kg-1·d-1)不能使移植物長期存活。當藥量增加到 4 mg·kg-1·d-1后,移植物可獲得長期存活。而與大劑量(4 mg·kg-1·d-1)用藥方式相比,階梯用藥方式可以達到相同的抗排斥反應效果。
2.2 皮瓣組織移植病理學變化
術后7 d,Ⅰ組組織鏡下可見真皮層大量單個核細胞浸潤,表皮細胞稍腫脹,依據Banff 07標準,評為3級(見圖2E,I);Ⅱ、Ⅲ、Ⅳ組皮膚組織未見異常,評為0級。術后15 d,Ⅱ組可見真皮層內中等量的單個核細胞浸潤,毛囊周圍炎細胞浸潤,表皮未受累,評為2級(圖2F,J);Ⅲ、Ⅳ組皮膚組織未見異常,評為0級。術后30 d,Ⅳ組中有1例樣本組織真皮層有大量單個核細胞浸潤,真皮淺層可見帶狀炎細胞浸潤,表皮組織已被排斥,評為4級(見圖2G,K),Ⅳ組其他樣本組織及Ⅲ組樣本皮膚組織未見異常,評為0級(見圖2H,L)。
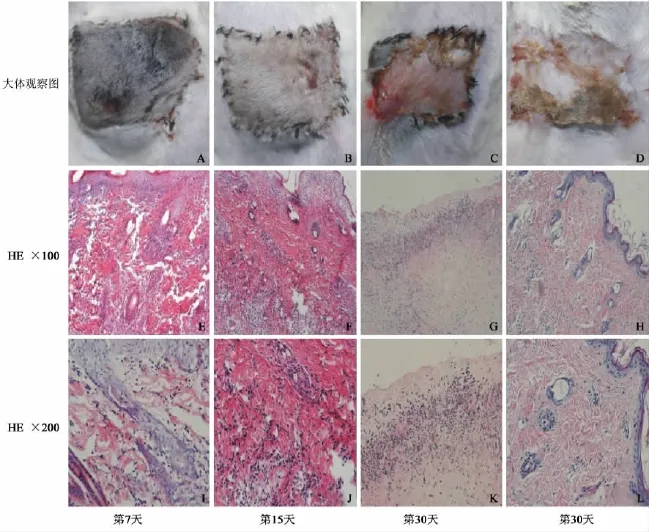
圖2 各組發生排斥反應病理學表現
3 討論
對含皮膚組織的異體復合組織移植排斥反應的研究需要相應的動物模型。大鼠因其大小適中,價格相對便宜,成為此類模型的主要動物之一。使用大鼠建立的CTA實驗模型有下肢移植模型[6]、全/半側顏面移植模型等[7]。大鼠下腹部游離皮瓣包含了皮膚、肌肉、皮下脂肪等多種組織成分,其手術過程簡單,操作方便快捷,且包含CTA中免疫原性最強的皮膚組織,是研究CTA的良好模型[8]。我們選擇近交系BN和Lewis大鼠分別作為供體和受體,近交系動物是指通過持續20代以上的近親繁殖,基因已高度純合化的動物品系。應用近交系動物可以使動物實驗的結果正確、可靠、有規律性、重復性好,從而精確判定實驗結果、得出正確的結論。這些優點在涉及免疫反應的實驗中顯得更加重要。
雷帕霉素是一種新型大環內酯類免疫抑制劑,通過阻斷IL-2受體信號,阻斷T淋巴細胞及其他細胞由G1期至S期的進程,從而發揮免疫抑制效應。從目前臨床應用來看,雷帕霉素是一種療效好、低毒和無腎毒性的新型免疫抑制劑。理論上雷帕霉素藥效是環孢素的40~100倍,同時它的腎毒性卻顯著降低[9]。移植后,雷帕霉素用量一般呈逐漸減少趨勢,即階梯用藥方案。這樣可以在保證移植物不被排斥的前提下減少藥物的副作用。在CTA后應用雷帕霉素的階梯用藥方案尚未見報道。在本實驗中,我們應用雷帕霉素作單藥物階梯用藥治療。術后 4 周,藥物劑量維持在 1 mg·kg-1·d-1,除 1 例因排斥反應皮瓣壞死外,其余受體均未發生排斥反應。這一結果與大劑量持續給藥的方式相比差異無統計學意義,證實了這一方案的有效性。
異基因移植后的組織和器官免疫抑制用藥分為誘導、維持、處理急性排斥反應3個階段。誘導階段為移植后初期,這一時期發生的排斥反應強烈。臨床上誘導階段用藥品種眾多,一般為他克莫司、嗎替麥考酚酯和潑尼松三聯用藥。在單藥物治療的動物模型中,誘導階段的用藥量較大。在大鼠顏面移植模型中,環孢素的用量為術后1周內16 mg/kg,逐周遞減,從第4周起維持在2 mg/kg[10]。在本實驗中,我們應用雷帕霉素作單藥物治療,前兩周保持在4 mg/kg,第3周減半,第4周后維持在1 mg/kg,為初始用量的1/4,即可保持大多數(7/8)受體不發生急性排斥反應。然而,相較于其他器官移植后的雷帕霉素用量(0.2 ~1.0 mg·kg-1·d-1),1 mg·kg-1·d-1的藥物用量還是較高。其原因可能在于皮膚組織具有強抗原性[11]。可能的原因有:(1)皮膚組織中有特異性抗原呈遞細胞(朗格漢斯細胞)存在。實驗證實,皮膚組織中朗格漢斯細胞的密度與皮膚抗原性密切相關[12-16]。(2)皮膚組織特異性的結構。真皮由膠原和氨基聚糖構成,這些結構包含了大量的淋巴黏附分子,因此可以聚集大量免疫反應。
本實驗證實雷帕霉素階梯用藥方案與較大劑量持續給藥相比,有相同的抑制排斥反應效果,這一結果為應用這一模型進一步研究CTA的免疫抑制和免疫耐受奠定了基礎。
志謝第四軍醫大學西京醫院晏松齡教授在本研究病理學方面給予指導,謹致謝意
1 Whitaker IS,Duggan EM,Alloway RR,et al.Composite tissue allotransplantation:a review of relevant immunological issues for plastic surgeons[J].J Plast Reconstr Aesthet Surg,2008,61(5):481-492.
2 Devauchelle B,Badet L,Lengelé B,et al.First human face allograft:early report[J].Lancet,2006,368(9531):203-209.
3 Guo S,Han Y,Zhang X,et al.Human facial allotransplantation:a 2-year follow-up study[J].Lancet,2008,372(9639):631-638.
4 Lantieri L,Meningaud JP,Grimbert P,et al.Repair of the lower and middle parts of the face by composite tissue allotransplantation in a patient with massive plexiform neurofibroma:a 1-year follow-up study[J].Lancet,2008,372(9639):639-645.
5 Cendales LC,Kanitakis J,Schneeberger S,et al.The Banff 2007 working classification of skin-containing composite tissue allograft pathology[J].Am J Transplant,2008,8(7):1396-1400.
6 Ozer K,Oke R,Gurunluoglu R,et al.Induction of tolerance to hind limb allografts in rats receiving cyclosporine A and antilymphocyte serum:effect of duration of the treatment[J].Transplantation,2003,75(1):31-36.
7 Ulusal BG,Ulusal AE,Ozmen S,et al.A new composite facial and scalp transplantation model in rats[J].Plast Reconstr Surg,2003,112(5):1302-1311.
8 潘華,郭樹忠,王璐,等.近交系大鼠腹部游離皮瓣移植模型的建立及意義[J].中國美容醫學,2007,16(12):1672-1675.
9 Saunders RN,Metcalfe MS,Nicholson ML.Rapamycin in transplantation:a review of the evidence[J].Kidney Int,2001,59(1):3-16.
10 Demir Y,Ozmen S,Klimczak A,et al.Tolerance induction in composite facial allograft transplantation in the rat model[J].Plast Reconstr Surg,2004,114(7):1790-1801.
11 Horner BM,Randolph MA,Huang CA,et al.Skin tolerance:in search of the Holy Grail[J].Transpl Int,2008,21(2):101-112.
12 Mathes DW,Randolph MA,Solaris MG,et al.Split tolerance to a composite tissue allograft in a swine model[J].Transplantation,2003,75(1):25-31.
13 Chen HD,Silvers WK.Influence of Langerhans cells on the survival of H-Y incompatible skin grafts in rats[J].J Invest Dermatol,1983,81(1):20-23.
14 Mathieson BJ,Flaherty L,Bennett D,et al.Differences in the rejec-tion of trunk skin and tail skin allografts involving weak histocompatibility loci[J].Transplantation,1975,19(6):525-527.
15 Sena J,Wachtel SS,Murphy G.A comparison of the survival of H-Y incompatible ear,tail,and body skin grafts[J].Transplantation,1976,21(5):412.
16 Bergstresser PR,Fletcher CR,Streilein JW.Surface densities of Langerhans cells in relation to rodent epidermal sites with special immunologic properties[J].J Invest Dermatol,1980,74(2):77-80.

