胰腎聯合移植圍手術期麻醉管理策略
劉寬智 黃文起
胰腎聯合移植(pancreas-kidney transplantation,PKT)是治療1型糖尿病合并終末期腎病最有效的方法[1]。自 1966年首例 PKT在美國明尼蘇達(Minnesota)大學成功實施以來,隨著新型免疫抑制劑的臨床應用、器官保存技術和手術方式的改進,PKT成功率顯著提高。據國際胰腺移植登記機構(International Pancreas Transplant Registry,IPTR)記錄,至2004年全球已實施23 043例胰腺移植,其中多數是 PKT[2]。
由于接受PKT的患者均合并有多器官終末期疾病,且麻醉手術時間較長(常需8~10 h),圍手術期麻醉管理面臨著極大的挑戰。因此,麻醉醫師需要充分了解PKT受者的病理生理變化,策略性地進行術前準備、術中管理以及術后并發癥的防治,對提高移植的成功率和患者的存活率起著極其重要的作用。
1 PKT適應證及術式選擇
1型糖尿病合并終末期腎病是PKT的標準適應證[3]。2001年2型糖尿病也被美國器官分配聯合網絡(United Network of Organ Sharing,UNOS)正式列為PKT的適應證之一。Sollinger等[4]提出如下PKT適應證:(1)腎功能衰竭(進展期糖尿病腎病或依賴透析治療,血肌酐>265 μmol/L);(2)血清C肽濃度下降;(3)較低的心血管疾病風險(沒有或輕微冠心病);(4)無糖尿病血管并發癥,如截肢等;(5)有良好的對PKT的心理順應性;(6)能很好理解PKT的復雜性,并能順從移植后的治療方案。
PKT主要包括一期胰腎聯合移植(simultaneous pancreas-kidney transplants,SPK)和腎移植后胰腺移植(pancreas after kidney transplantation,PAK),目前多數移植中心采用SPK方案。SPK后長期生存的受者都具有良好的生活質量。
中國糖尿病發病率約為5%,其中90%為2型糖尿病。因此,中國的PKT受者中,2型糖尿病所占比例較歐美國家大。與1型糖尿病受者比較,雖然2型糖尿病受者術后空腹血糖恢復正常的平均時間顯著延長,但并不影響遠期療效,受者空腹血糖和餐后2 h血糖均可維持在正常范圍。
2 術前評估和準備
2.1 心血管功能評價
糖尿病合并終末期腎病患者心血管疾病的發生率顯著增高,圍手術期應特別注意有無發生心肌缺血甚至心肌梗死的可能[5-6]。因此,術前應進行心臟彩色多普勒超聲、心肌核素掃描甚至冠狀動脈造影等檢查。有研究表明此類患者年齡大于45歲,既往即使無心絞痛發作病史,87%的患者冠狀動脈造影結果顯示存在冠狀動脈狹窄的情況[7]。對年齡小于45歲但糖尿病病程超過25年、心電圖有心肌缺血的表現或者吸煙患者,建議術前應行冠狀動脈造影,以了解冠狀動脈缺血的情況。
2.2 自主神經系統評價
自主神經病變是糖尿病的主要并發癥之一。糖尿病可引起腎功能衰竭和自主神經損害,而其他引起腎功能衰竭的疾病則較少有自主神經功能損害。自主神經功能損害可削弱心血管功能導致圍手術期血流動力學的不穩定[8]。所以術前確定自主神經功能十分重要。常用的檢查自主神經反射試驗為臥立位試驗。
2.3 電解質、酸堿平衡和血紅蛋白濃度控制
患者如在術前24 h內行血液透析,要關注血容量是否充足,可以通過透析前后體質量變化和胸片肺野是否清晰來初步判斷。此類患者在麻醉誘導時容易發生低血壓,需要特別注意。相反,術前24 h內未行血液透析者,往往出現高血容量、高血壓、高鉀血癥以及酸中毒等情況。此類患者對慢性血鉀升高是可以耐受的,術前血鉀一般不應超過5.5 mmol/L,但應避免一些導致圍手術期血鉀升高的處理,如注射琥珀膽堿、使用低流量通氣等。同樣這些患者對于酸中毒的耐受性亦較良好,但若pH值低于7.25,應予碳酸氫鈉糾正。糖尿病酮癥酸中毒的發生表明患者機體內環境的嚴重紊亂,術前應積極處理予以糾正。終末期腎病患者往往合并貧血,術前應通過輸注紅細胞使血紅蛋白濃度高于 80 g/L[9]。
2.4 血糖控制
圍手術期血糖控制是否良好是PKT能否成功的關鍵[10]。已有動物實驗證明高血糖可導致胰島細胞的功能不全甚至結構的破壞,影響移植胰腺胰島細胞的生長。外源性胰島素治療和糾正糖代謝紊亂可防止移植胰腺的胰島細胞發生功能衰竭,所以在圍手術期應根據血糖水平調整胰島素用量,維持血糖在5.6~11.1 mmol/L(100~200 mg/dL)范圍。此外,圍手術期糖代謝紊亂會導致受者感染和傷口愈合不良的發生率增加。
2.5 術前用藥
糖尿病患者胃輕癱是常被忽略的并發癥,患者麻醉誘導時易發生誤吸。術前使用質子泵抑制劑、H2受體阻滯劑和制酸藥可預防誤吸的發生。術前使用鎮靜藥應持謹慎態度,咪達唑侖、阿片類制劑在尿毒癥患者血漿中游離濃度增加,可能導致嚴重的中樞抑制,同時阿片類制劑可引起胃排空延遲,使誤吸的發生率增加。但阿托品或東莨菪堿宜常規應用,它可降低迷走神經張力,減少呼吸道分泌物,有利于保持氣道通暢。同時術前用藥應盡量由靜脈途徑給藥[11],而不使用肌肉注射,這是因為糖尿病終末期腎功能衰竭患者存在出凝血功能障礙,注射部位易發生血腫。
3 麻醉方式的選擇
PKT受者的原發病多為重癥糖尿病,病程長、合并癥多、手術時間長,因此選擇合適的麻醉方法對PKT手術成功和受者術后恢復非常重要。目前全身麻醉和連續硬膜外阻滯麻醉是PKT最常用的兩種麻醉方式[12]。
硬膜外阻滯麻醉能滿足手術所需要的麻醉平面,部分交感-腎上腺系統處于阻滯范圍內,可使腎上腺素分泌減少,對糖代謝影響較小,有利于控制高血糖。硬膜外阻滯麻醉術后受者肺部感染和肺不張的發生率要低于全身麻醉,并且術后還方便應用硬膜外患者自控鎮痛。對糖尿病并發肢體外周動脈粥樣硬化的患者,術后硬膜外鎮痛還可以減少下肢血管栓塞以及嚴重供血不足導致肢端壞疽的發生。由于此類患者常伴有凝血功能障礙,加之術中和術后施以抗凝治療,應警惕受者硬膜外血腫的發生,需嚴格掌握麻醉選擇指征。此外,PKT受者常合并有脫水和血管硬化,硬膜外阻滯麻醉時用藥量比常人要小,如藥量稍大,易致阻滯范圍過廣,引起血流動力學的波動。因此,如患者既往有心肌梗死、術前心功能較差以及冠狀動脈多支嚴重病變,建議選用全身麻醉。
全身麻醉可控性高,有利于充分供氧,術中患者比較舒適,可避免硬膜外阻滯因凝血功能障礙致椎管內出血。但全身麻醉對糖代謝影響較大,諸多麻醉藥會增加肝、腎分解代謝負荷,影響受者術后蘇醒。伴發肺部感染和肺功能障礙患者全身麻醉時氣管插管,術后拔管困難。因此,PKT選擇硬膜外阻滯或全身麻醉各有其優缺點,要根據患者具體情況權衡。
4 麻醉管理
4.1 術中監測
患者進入手術室后,經左側橈動脈穿刺置入套管針以備取血作血氣分析和持續橈動脈壓監測。麻醉過程持續監測動脈血壓、脈搏血氧飽和度、心電圖和尿量,間斷測定血糖及尿糖。行頸內靜脈或鎖骨下靜脈穿刺置管,連續監測中心靜脈壓,以便及時發現容量與心功能變化之間的關系。對于有心肺疾病史的患者還可置入漂浮導管(Swan-Ganz導管),監測肺動脈壓和肺毛細血管楔壓,反映左心前負荷和右心后負荷的情況,此外通過漂浮導管還能進行心排出量的監測,對于評價患者的心功能具有重要的意義[13]。
4.2 麻醉藥物選擇
在尿毒癥與非尿毒癥患者間靜脈麻醉藥如丙泊酚的消除半衰期無明顯差異,注射丙泊酚后收縮壓下降幅度也無明顯差異,因此丙泊酚用于尿毒癥患者是安全的。咪達唑侖在尿毒癥患者血漿游離分數增高,麻醉起效時間縮短,作用時間延長,故靜脈注射時速度要慢并減量。
阿片類藥物如嗎啡和哌替啶因其代謝產物仍有活性,且依賴腎臟排泄,故在尿毒癥患者體內容易蓄積,不建議使用。芬太尼類藥物的代謝物無活性,在尿毒癥患者中藥代動力學變化不大,而且使用時對血流動力學影響相對較小,較為適合。
體內無機氟可引起腎小管損害導致非少尿性腎功能衰竭。吸入安氟醚和異氟醚后,血漿無機氟濃度很少超過25 μmol/L,對腎功能影響較小;地氟醚體內幾乎不代謝,肝腎毒性小;七氟醚用于此類患者存在爭議,有研究顯示高濃度或長時間吸入七氟醚后,血漿無機氟濃度可能超過50 μmol/L,因此不建議其在PKT手術中使用。
主要經腎清除的肌肉松弛藥如泮庫溴銨在尿毒癥患者中作用時間延長,一般不推薦使用。維庫溴銨主要在肝代謝和排泄,15% ~25%經腎排泄。腎功能衰竭時可通過肝消除來代償,因此可應用于腎功能衰竭者,但其代謝產物可在腎功能衰竭患者中蓄積,引起肌松恢復延遲,作用時間延長。羅庫溴銨的消除主要依靠肝,其次是腎,腎功能衰竭患者雖然血漿清除減少但并不明顯影響其藥效及藥代動力學。阿曲庫銨在體內通過霍夫曼消除自行降解,不依賴肝腎功能,但其有組胺釋放作用,可引起低血壓和心動過速。順式阿曲庫銨藥代動力學與阿曲庫銨相似,但無組胺釋放作用,是相對理想的肌肉松弛藥。
4.3 術中循環管理
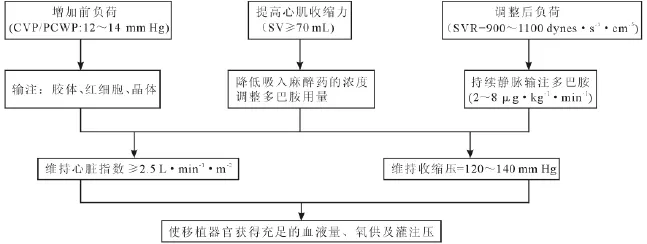
圖1 胰腎聯合移植中循環管理思路和對策
PKT術中循環管理的主要目標是盡量縮短開放后血壓下降的時間,維持移植器官的高血流量,提高移植器官的灌注壓(見圖1)。主要考慮以下方面:
(1)充足的循環血量。充足的循環血量可以減少移植腎早期無功能的發生率,進而降低移植腎功能衰竭的發生率。腎血管開放后,外周血管阻力可能會突然下降而導致低血壓發生,因此開放前應根據中心靜脈壓調整輸液的種類和速度,維持心臟指數≥2.5 L·min-1· m-2,使循環血量充盈。
(2)維持血壓平穩。PKT的手術時間較長,麻醉藥物的作用及麻醉深度均可使血壓下降,特別是當供胰腺動脈血管與受者右髂外動脈吻合及供腎動脈與受者左髂外動脈血管吻合后血管開放時血壓波動較為明顯。為防治血壓下降,手術開始后即應用2 ~8 μg·kg-1·min-1多巴胺持續輸注使血壓維持相對平穩。多巴胺是合成腎上腺素和去甲腎上腺素的內源性前體,不同劑量激動不同受體,從而選擇性產生血管舒縮和正性肌力作用。小劑量輸注(1~3 μg·kg-1·min-1)時,可激動多巴胺受體產生作用,擴張腎、腸系膜、冠狀動脈和腦內血管,有利于增加移植器官的灌注血流。
(3)提高心肌收縮力。通過降低吸入麻醉藥物的濃度,調整多巴胺的輸注速度,提高心肌收縮力,維持收縮壓在120~140 mm Hg(1 mm Hg=0.133 kPa,下同),使移植器官獲得較高的灌注壓。有研究顯示圍手術期維持有效的灌注壓能大大減少術后急性腎小管壞死和移植器官血栓形成的發生率。
(4)增加移植腎尿量。腎血管開放前給予甘露醇0.5 ~1 g/kg或呋塞米0.5 mg/kg,增加移植腎尿量可明顯減少移植腎早期無功能的發生。
(5)血糖控制。術中既要防止機體應激以及胰腺再灌注后由于保護液中和移植物中葡萄糖進入血液導致高血糖,也要警惕胰腺血管中的胰島素未經肝首過效應一次性大量釋放入體循環以及胰腺去神經后分泌調節嚴重削弱導致的低血糖。前者應及時行外源性胰島素予以糾正(見表1);后者可通過補充葡萄糖給予預防,建議持續靜脈輸注5%葡萄糖注射液40~70 mL/h。

表1 不同血糖水平相應的外源性胰島素用量
5 術后處理
(1)ICU監測。包括嚴格消毒隔離;吸氧48 h;觀察受者的精神狀態;持續胃引流減壓,注意引流量及出血情況,每6 h測定胃液pH,維持胃液pH>4;心電圖監測,警惕靜息狀態心肌缺血,維持心率在60~130次/min;呼吸監測;中心靜脈壓監測;血氧飽和度監測;尿量監測,若尿量<20 mL/h,應停用環孢素直至尿量達到20 mL/h;傷口引流管引流量應達100 mL/h以上;收縮壓>180 mm Hg或<100 mm Hg,均應積極處理;動脈血氣;血糖;胸片,每24 h 1次。
(2)預防并發癥。胰腺移植是成熟的手術技術,手術相關并發癥由最初的25% ~35%已降至7.6%。移植物血栓和腹腔感染是其中最主要的并發癥。移植物血栓與胰腺低血容量、水腫、微循環障礙、局部或全身高凝狀態有關,是導致移植物失功的主要原因之一,維持圍手術期移植物的有效灌注壓尤為重要。腹腔內感染可降低1年和3年人及移植物存活率,應予高度重視,重點要防治下尿路感染。
(3)鎮痛。術后給予硬膜外或靜脈內受者自控鎮痛。
6 小結
PKT受者病情復雜,合并癥多,麻醉管理困難,因此要完善術前檢查、準確評估病情、慎重選擇麻醉方式和麻醉藥物,更要有全面合理的術中管理思路和對策,維持移植器官的功能,方能使受者平穩度過圍麻醉期。
1 明長生,陳孝平.中國胰腎聯合移植現狀[J].肝膽胰外科雜志,2008,20(3):153-155.
2 Gruessner AC,Sutherland DER.Pancreas transplant outcomes for U-nited States(US)and non-US cases as reported to the United Network for Organ Sharing(UNOS)and the International Pancreas Transplant Registry(IPTR)as of May 2003[M]//Cecka JM,Terasaki PI.Clinical Transplants 2003.Los Angeles:UCLA Immunogenetics Center,2004:21-51.
3 劉永鋒.胰腎聯合移植進展[J].中華肝膽外科雜志,2007,13(3):152-154.
4 Sollinger HW,Odorico JS,Becker YT,et al.One thousand simultaneous pancreas-kidney transplants at a single center with 22-year follow-up[J].Ann Surg,2009,250(4):618-630.
5 Luan FL,Miles CD,Cibrik DM,et al.Impact of simultaneous pancreas and kidney transplantation on cardiovascular risk factors in patients with type 1 diabetes mellitus[J].Transplantation,2007,84(4):541-544.
6 Witczak BJ,Jenssen T,Endresen K,et al.Risk factors for mortality in diabetic nephropathy patients accepted for transplantation[J].Transplantation,2007,84(3):356-361.
7 Drognitz O,Benz S,Pfeffer F,et al.Long-term follow-up of 78 simultaneous pancreas-kidney transplants at a single center institution in Europe[J].Transplantation,2004,78(12):1802-1808.
8 Becker BN,Odorico JS,Becker YT,et al.Simultaneous pancreaskidney and pancreas transplantation[J].J Am Soc Nephrol,2001,12(11):2517-2527.
9 Koehntop DE,Beebe DS,Belani KG.Perioperative anesthetic management of the kidney-pancreas transplant recipient[J].Curr Opin Anaesthesiol,2000,13(3):341-347.
10 Beebe DS,Kendall DM,Gruessner RWG,et al.Pancreas transplantation[M]//Sharpe MD,Gelb AW.Anesthesia and transplantation.Boston:Butterworth-Heinemann,1999:217-240.
11 喻紅輝,羅愛林,田玉科.胰腎聯合移植的麻醉處理[J].國外醫學麻醉學與復蘇分冊,2003,24(5):313-315.
12 喻紅輝,羅愛林,明長生,等.胰腎聯合移植術麻醉方法的選擇[J].中華器官移植雜志,2006,27(12):737-739.
13 陳紹洋,熊利澤,楊麗芳,等.胰腎聯合移植術的麻醉及圍術期管理[J].第四軍醫大學學報,2005,26(6):541-543.
14 田玉科,王鵬.器官移植麻醉[M]//莊心良,曾因明,陳伯鑾.現代麻醉學.第3版.北京:人民衛生出版社,2003:1553-1568.

