植物中藥IHA-01抑制人肺癌GLC細胞增殖和誘導凋亡的實驗研究
王苗,董堅,李秋恬,呂加令,武治國,毛劍鋒
作者單位:650032 昆明醫學院第一附屬醫院生物治療中心
?
植物中藥IHA-01抑制人肺癌GLC細胞增殖和誘導凋亡的實驗研究
王苗,董堅,李秋恬,呂加令,武治國,毛劍鋒
650032 昆明醫學院第一附屬醫院生物治療中心
初步探討植物中藥 IHA-01 抑制人肺癌 GLC 細胞增殖及誘導其早期凋亡的作用。
人肺癌 GLC 細胞經不同濃度(0.01、0.1、1、10、100 μg/ml)IHA-01 作用24、48、72 h,以MTT 法進行 IHA-01 有效作用濃度篩選并確定IHA-01 工作濃度(1/2 IC50);透射電鏡觀察 IHA-01 細胞超微結構;流式細胞術進行 DNA 倍體分析和 TUNEL 分析,檢測 IHA-01 對肺癌 GLC 細胞周期及早期凋亡的影響。
IHA-01 工作濃度(1/2 IC50)為 0.7 μg/ml,且不同濃度 IHA-01 作用不同時間對 GLC 細胞增殖的抑制作用呈時效和量效依賴關系;透射電鏡發現 IHA-01 實驗組部分細胞出現細胞連接消失,微絨毛消失,胞質密度增加,可見細胞早期凋亡改變,具有誘導細胞分化和早期凋亡的作用;流式細胞術顯示肺癌 GLC 細胞出現明顯的凋亡峰,細胞周期阻滯在 G0/G1期,S 期細胞減少;流式細胞術 TUNEL 法檢測結果顯示,細胞凋亡和壞死同時存在。
IHA-01 具有抑制肺癌 GLC 細胞增殖,誘導凋亡的作用,具有深入研究的價值。
中草藥; 肺腫瘤; 細胞增殖; 細胞凋亡
許多抗癌藥物可以誘導癌細胞向終末階段分化、重新啟動細胞凋亡程序,從而抑制腫瘤細胞增殖,自主清除惡變的細胞,達到抑制腫瘤生長的目的[1]。天然植物新藥 IHA-01 是從云南一種天然植物提取物中精制出的抗腫瘤活性成分水朝陽內酯,具有活血祛瘀、消腫散結之功效。云南民間用其治療消化道癌、肺癌、乳腺癌等[2-3],但尚未見科學報道。在以抑制腫瘤細胞增殖活性為指標進行體外抗腫瘤譜篩選時,我們發現 IHA-01 對多種腫瘤細胞株具有較強的殺傷能力。在此基礎上,本研究以人肺癌 GLC 腫瘤細胞株為研究對象,初步探討 IHA-01 抑制人肺癌 GLC 細胞增殖和誘導凋亡的作用。
1 材料和方法
1.1 材料
1.1.1 試劑 RPMI1640 培養基購自美國 Gibco 公司;新生牛血清(NBCS)購自杭州四季青生物工程材料有限公司;依托泊苷(VP16)購自江蘇恒瑞醫藥股份有限公司;十二烷基硫酸鈉(SDS)、乙二胺四乙酸二鈉(EDTA)均為上海生工生物工程技術服務有限公司產品;流式 TUNNEL 試劑盒為美國 Backman Coulter 公司產品;IHA-01 由本課題組委托中科院昆明植物所提取。
1.1.2 細胞株 個舊肺腺癌細胞 GLC 由本研究室進行傳代培養。
1.1.3 主要儀器 Thermo3111 型二氧化碳培養箱購自美國 Themo 公司;BHC-1300IIA2 型生物安全柜購自中國蘇州蘇凈安泰空氣技術有限公司;YY3009000 型培養基過濾器購自美國 Millipore 公司;Epicsxl-4CIR 型流式細胞儀購自美國 Backman Coulter 公司;TMS-F 型倒置顯微鏡購自日本 Nikon 公司;Bio-Rad550 型酶標板自動讀數儀購自美國 Bio-Rad 公司。
1.2 方法
1.2.1 細胞培養 肺腺癌細胞 GLC 用含 10% 100 g/L 滅活新生牛血清(NBCS)、100 萬U/ml 青霉素、100 μg/ml 鏈霉素的 RPMI1640 培養液重懸后,置于 37 ℃、體積分數 5% CO2飽和濕度培養箱中培養,每 2 d 換液 1 次。
1.2.2 改良 MTT 法[4]研究 IHA-01 對 GLC 細胞增殖的抑制作用 取對數生長期的肺腺癌 GLC 細胞,胰酶消化,制成單細胞懸液,接種于 96 孔培養板,90 μl/孔。調整細胞終密度為 1 × 105/ml,每組設 5 個復孔,實驗重復 3 次。待細胞生長12 h 完全貼壁后再分別加入對照組和 IHA-01 實驗組,10 μl/孔。對照組:每孔加入 DMSO 液,終濃度為 0.01%;IHA-01 實驗組:分別加入終濃度為 0.01、0.1、1、10、100 μg/ml 的 IHA-01。置于培養箱分別培養 24、48、72 h 后,每孔加入 MTT 液 10 μl,4 h 后加入三聯液 90 μl/孔,再置于培養箱培養 24 h 后觀察不同濃度的 IHA-01 在不同作用時間對肺腺癌細胞 GLC 的增殖抑制作用。酶標儀于 570 nm 波長處測定各孔吸光度(570)。細胞抑制率公式如下:
細胞抑制率(%)=(對照組平均-實驗組平均)/對照組平均× 100%。
通過軟件求出 IHA-01 最佳作用時間的半數抑制濃度 IC50。后續實驗均采用 1/2 IC50作為 IHA-01 的工作濃度。
1.2.3 透射電鏡觀察超微結構 收集對照組和加入工作濃度的 IHA-01 實驗組的細胞懸液置于 4 ℃環境中,離心半徑 4 cm,500 r/min 離心 10 min,收集細胞 5 × 106/ml,用 PBS 沖洗 2 次,將細胞懸浮于 3.5% 的戊二醛中固定 1 h,PBS 洗 2 次,再在 1% 鋨酸中固定 1 h,用丙酮梯度脫水;將細胞置于丙酮-包埋劑(1:1)中置換 30 min,然后在包埋劑中浸泡 2 h,按常規包埋、切片。
1.2.4 流式細胞儀檢測細胞周期的改變 分別收集工作濃度的 IHA-01 及 10 μg/ml 的陽性對照藥 VP16 作用 48 h 的 GLC 細胞,70% 的冷乙醇固定過夜(4 ℃),37 ℃處理 1 h,用碘化丙啶(PI)對樣本 DNA 熒光染色,應用 Epicsxl-4CIR 流式細胞儀檢測:每個樣品收集 1 × 104個細胞,然后用 Coultwincycle 軟件做 DNA 分析。
1.2.5 流式細胞儀 TUNEL 法檢測早期細胞凋亡 分別收集工作濃度的 IHA-01 及 10 μg/ml 的 VP16 作用 48 h 的 GLC 細胞,調整細胞數為 1 × 106/ml,按照試劑盒說明書作標記后上機檢測,采集后用 Wincycle DNA 分析軟件分析 FL3單門中的周期,得出 G0/G1期、G2/M 期、S 期的細胞生長特點。
1.3 統計學分析
2 結果
2.1 不同濃度 IHA-01 作用不同時間對 GLC 細胞增殖的抑制作用
0.01、0.1、1、10、100 μg/ml IHA-01 作用 24、48、72 h 后,對 GLC 細胞增殖均有不同程度的抑制作用(< 0.05),并呈時效和量效依賴關系,見表 1 和圖 1。
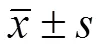
表 1 不同濃度 IHA-01 作用 GLC 細胞不同時間的生長抑制率(%,)
注:*與Δ比較,< 0.01;▲與24 h比較,< 0.05
Notes:*Compared withΔ,< 0.01;▲Compared with 24 h,< 0.05.

圖 1 不同濃度 IHA-01 作用不同時間對 GLC 細胞增殖抑制作用的量效曲線圖
Figure 1 Dose-effect curve of GLC cell proliferation effect in different time and concentration by IHA-01
2.2 IHA-01 作用 GLC 細胞 48 h 的半數抑制濃度 IC50
不同濃度 IHA-01 作用于 GLC 細胞 48 h 后,GLC 細胞生長抑制率在12.95% ~ 93.10%之間,用 IC50計算軟件得到 IHA-01 作用于 GLC 細胞 48 h 后半數抑制濃度 IC50為 1.33 μg/ml。以 IC50的 1/2,即 0.7 μg/ml 作為后續實驗中 IHA-01 的工作濃度。
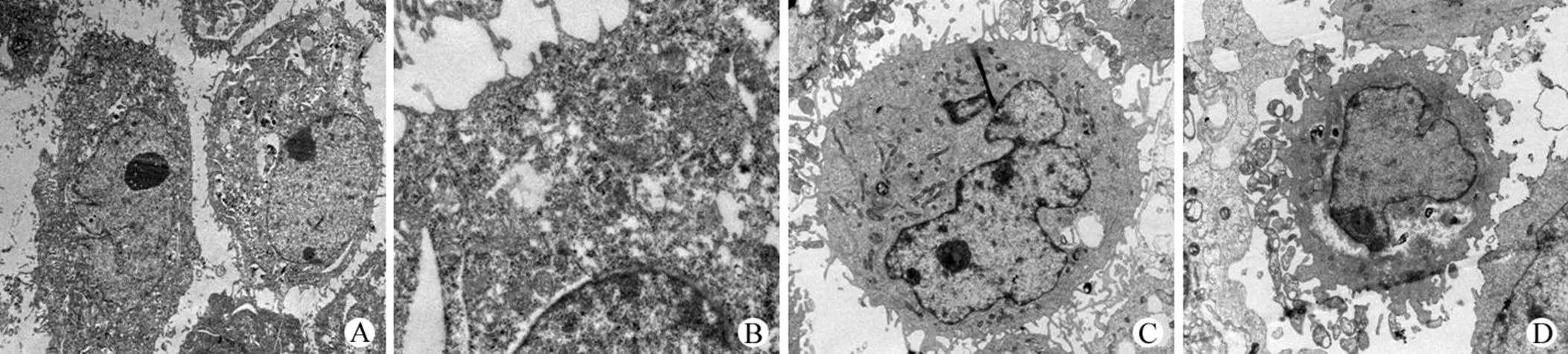
圖 2 肺癌 GLC 細胞培養 24 h 后的透射電子顯微鏡形態學觀察(A:對照組,× 5 000;B:對照組,× 25 000;C:0.7 μg/ml 實驗組,× 8 000;D:0.7 μg/ml 實驗組,× 10 000)
Figure 2 Morphology observation after lung neoplasms GLC cell culture 24 h transmission electron microscopes (A: control group, × 5 000; B: control group, × 25 000; C: experimental group 0.7 μg/ml, × 8 000; D: experimental group 0.7 μg/ml, × 10 000)
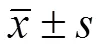
表 2 FCM 分析 IHA-01 對 GLC 細胞周期的影響(%,)
注:IHA-01 組與空白組相比,*/△< 0.05
Notes:IHA-01 groups compare with control groups,*/△< 0.05.
2.3 IHA-01 對 GLC 細胞作用的超微結構觀察
24 h,對照組 GLC 細胞生長良好,細胞表面微絨毛樣突起較多,細胞核大而不規則,核分裂像常見,細胞分化較低,細胞器少、幼稚,細胞核質比較大,為惡性腫瘤細胞的形態特征(圖 2A,2B)。IHA-01 作用 GLC 細胞 24 h 后:部分細胞出現細胞連接消失,微絨毛消失,胞質密度增加,細胞器增多,核染色質濃縮成 2 個或幾個大的團塊邊聚于核被膜下,可見藥物有誘導細胞分化和早期凋亡的作用(圖 2C,2D)。
2.4 FCM DNA 倍體分析 IHA-01 作用 GLC 細胞周期的影響
IHA-01 作用肺癌 GLC 細胞 48 h 后,FCM 檢測其細胞周期的改變,從表2 中可知,IHA-01 作用 GLC 細胞 48 h,G0/G1期細胞聚集,S 期的細胞數量減少,阻滯了 G2/M 期的轉換,顯示干擾了 GLC 細胞在細胞周期中的進程;與空白組相比< 0.05,有統計學差異。
2.5 FCM TUNEL 法檢測 IHA-01 作用 GLC 細胞 48 h 誘導早期凋亡
FCM TUNEL 法檢測 IHA-01 作用 GLC 細胞 48 h 后,出現細胞早期凋亡,IHA-01 組和 VP16 組其凋亡率和壞死率均比對照組高,有統計差異性(< 0.05);IHA-01 組和 VP16 組比較,凋亡率無顯著性差異(表 3)。
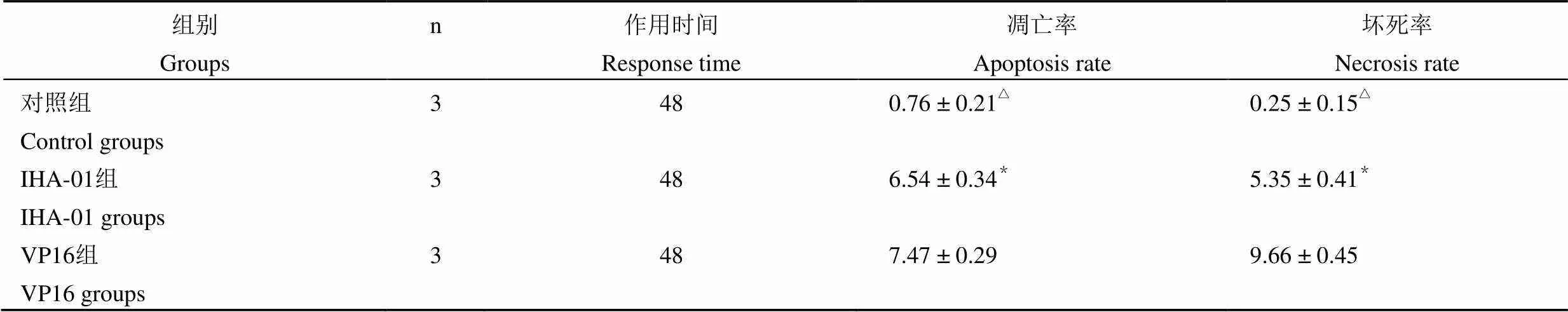
表 3 FCM TUNEL 法分析 IHA-01 作用 48 h對 GLC 細胞早期凋亡影響(%)
注:IHA-01與對照組比,*/△< 0.05
Notes:IHA-01 groups compare with control groups,*/△< 0.05.
3 討論
腫瘤目前仍是臨床難以治療的疾病之一,對人類的健康危害很大,現在臨床治療腫瘤的主要方法是手術、化療、放療,一方面給患者帶來生存的希望,同時也給患者帶來較大創傷。多年來眾多學者一直在尋找有效治療惡性腫瘤的藥物,尤其是篩選高效、低毒、低成本的天然植物藥物倍受生物學和醫學界的關注,其中從植物中提取并利用中藥誘導腫瘤細胞凋亡已成為一條很有希望治療腫瘤的新途徑[5]。
依托泊苷(VP16)是一種用于臨床一線的化療藥,它通過抑制細胞周期促使癌細胞凋亡而發揮抗癌作用[6],VP16 為拓撲異構酶II抑制劑,對癌細胞 S 期末期及 G2期細胞有較強殺傷作用,屬于周期特異性藥物[7]。用 VP16 作為陽性對照藥與 IHA-01 作比較的流式檢測結果表明:IHA-01 可以干擾 GLC 細胞在細胞周期中的進程,對癌細胞的 S 期細胞有明顯殺傷作用,可能與干擾了癌細胞的 DNA 合成有關;而 VP16 組 G2/M 期細胞減少,細胞聚集在 G0/G1期,因此,若 IHA-01 與特定殺滅該細胞周期的抗腫瘤藥物聯用,其抑制腫瘤細胞生長的作用可能會更加顯著。
目前采取藥物的聯合應用抑制癌細胞的增殖,誘導腫瘤細胞分化和凋亡是當前腫瘤治療的重要方向[8]。我們通過透射電鏡進行觀察,IHA-01 處理組可見部分細胞核分裂像以及細胞早期凋亡改變,可見凋亡細胞表面微絨毛消失,核染色質固縮、邊集,呈新月形,細胞器多,有誘導細胞分化和早期凋亡的作用。流式細胞儀的 TUNEL 檢測有利于發現早、中期的 DNA 斷裂,可以在凋亡的早期階段細胞還沒有出現形態學改變時檢測出細胞凋亡,具有靈敏度高的特點[9-10]。流式 TUNEL 檢測結果顯示:IHA-01 具有早期誘導 GLC 細胞凋亡的作用,IHA-01 作用 GLC 細胞 48 h 后,在細胞中同時存在凋亡和壞死,這與S?ti 等[11]認為的細胞壞死和凋亡同時存在相符。
實驗結果顯示,中藥 IHA-01 能有效抑制人肺癌 GLC 細胞的增殖、誘導腫瘤細胞凋亡以及特異性阻滯細胞周期的作用。我們推測 IHA-01 抑制 GLC 細胞增殖、誘導凋亡作用可能涉及一系列癌基因、抑癌基因轉錄及轉錄后水平的改變,其作用的分子機制尚需深入研究;由于通過誘導細胞凋亡,啟動凋亡程序從而抑制細胞增殖是一個由多階段、多系統參與的極其復雜的過程,在此僅初步討論了 IHA-01 在體外對人肺癌 GLC 細胞株增殖的影響,我們將進一步分離、鑒定 IHA-01 的活性成分,全面系統研究其在動物體內抗腫瘤的作用,為將其開發成為抗癌新藥奠定實驗基礎。
[1] Kerr JF, Wyllie AH, Currie AR, et al. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. BrJ Cancer, 1972, 26(4):239-257.
[2] Editorial Board of Local History in Yunnan Province. Yunnan Province, Chi volume 70, Medicine. Kunming: Yunnan People’s Publishing House, 1995:803. (in Chinese)
云南省地方志編纂委員會. 云南省志卷七十·醫藥志. 昆明: 云南人民出版社, 1995:803.
[3] Chen KC, Liang MD, Hu MY, et al. Lactone anti-cancer effect of water sunrise. Bull Chin Cancer, 1999, 8(2):74. (in Chinese)
陳昆昌, 梁明達, 胡美英, 等. 水朝陽內酯的抗癌作用. 中國腫瘤, 1999, 8(2):74.
[4] Zhou JJ, Le XF, Han JX, et al. Improved MTT assay for acofantitumor agents. Chin J Pharm, 1993, 24(10):455-457. (in Chinese)
周建軍, 樂秀方, 韓家嫻, 等. 評價抗癌物質活性的改良MTT方法. 中國醫藥工業雜志, 1993, 24(10):455-457.
[5] Zhu XZ, Jiang GL. Introduction to clinical oncology. Shanghai: Fudan University Press, 2005:1-207. ( in Chinese)
朱雄增, 蔣國梁. 臨床腫瘤學概論. 上海: 復旦大學出版杜, 2005: 1-207.
[6] Li ZD, Qi ZH, Liu W, et al. The role of survivin in the induction of apoptosis by VP16 HL-60 inleukemia cells. Jiangsu Med J, 2006, 32(4):351-354.( in Chinese)
李中東, 齊振華, 劉巍, 等. 生存素在VP16誘導HL-60白血病細胞凋亡中的作用. 江蘇醫藥, 2006, 32(4):351-354.
[7] Correale P, Fulfaro F, Marsili S, et al. Gemcitabine (GEM) plus oxaliplatin, folinic acid, and 5-fluorouracil (FOLFOX-4) in patients with advanced gastric cancer. Cancer Chemother Pharmacol, 2005, 56(6):563-568.
[8] Kanamori N, Fujii M, Kochi M, et al. Evaluation of combination chemotherapy with 5-FU, CDDP and CPT-11 for human gastric carcinoma transplanted into nude mice-comparative study of in vivo chemosensitivity test. Gan To Kagaku Ryoho, 2007, 34(6):881-884.
[9] Guo XH, Liu LX. Comparative study on Annexin V/PI and TUNEL in detecting hepatocyte apoptosis. J Shanxi Med Univ, 2008, 39(5):476- 479. (in Chinese)
郭曉紅, 劉立新. Annexin V/PI流式細胞分析法和TUNEL法檢測肝細胞凋亡的對比研究. 山西醫科大學學報, 2008, 39(5):476-479.
[10] Zhao J, Wang ML, Chen JX. The comparison of the three methods detecting apoptosis in cerebral cortex with HCMV congential infection in aged mouse. Acta Univ Med Anhui, 2007, 42(2):157-160. (in Chinese)
趙俊, 王明麗, 陳敬賢. 3 種方法檢測HCMV先天性感染對老年小鼠大腦皮質細胞凋亡的比較. 安徽醫科大學學報, 2007, 42(2):157- 160.
[11] S?ti C, Sreedhar AS, Csermely P. Apoptosis, necrosis and cellular senescence: chaperone occupancy as a potential switch. Aging Cell, 2003, 2(1):39-45.
An experimental study of plant traditional Chinese medicine IHA-01 suppressing lung neoplasms GLC cell multiplication and inducing its apoptosis
WANG Miao, DONG Jian, LI Qiu-tian, LV Jia-ling, WU Zhi-guo, MAO Jian-feng
Author Affiliation: Department of Biotherapy Center, the First Affiliated Hospital of Kunming Medical College, Kunming, 650032, China
To explore the proliferation-inhibiting and the early apoptosis- inducing activity of traditional Chinese medicine IHA-01 on human lung neoplasms cell line GLC.
After being treated with different concentrations of HIA-01 (0.01 μg/ml, 0.1 μg/ml, 1 μg/ml, 10 μg/ml and 100 μg/ml, respectively) for 24, 48 and 72 hours, the effective working concentration and its working concentration (1/2 IC50) were detected by MTT. Observed the cell ultrastructure in each group by TEM. Apply the FCM DNA assay and TUNEL assay to examines the influence of IHA-01 which induce the lung neoplasms GLC mitotic cycle and the early apoptosis process.
IHA-01 work concentration (1/2 IC50) was 0.7 μg/ml, the inhibition effect of IHA-01 on the GLC cell growth showed time-effect dependence and dose-effect dependence. The results of TEM found that some cells’ connection disappeared and microvilli disappeared, cytoplasm density increased, and the change of cell nuclear and early apoptosis was appeared in dealing with IHA-01. FCM assay indicated that most of the cells were arrested in G0/G1and the apoptotic peak appeared and the number of S phase cells decreased. The results of TUNEL indicated that there were apoptosis and necrosis simultaneous.
IHA-01 can inhibit lung neoplasms cell proliferation and induce apoptosis in vitro, and has the deep research value.
Drugs, Chinese herbal; Lung neoplasms; Cell proliferation; Apoptosis
10.3969/cmba.j.issn.1673-713X.2010.02.005
DONG Jian, Email: dongjian18@yahoo.com
云南省應用基礎研究計劃(2007C0008R)
董堅,Email:dongjian18@yahoo.com
2009-12-22

