肌注不同劑量環孢霉素A抑制大鼠角膜移植的免疫排斥反應
焦春娜,張曉敏,趙少貞
(天津醫科大學眼科中心,天津 300070)
在所有器官移植手術中,角膜移植的成功率最高。然而移植后的免疫排斥反應仍是導致角膜移植失敗的主要原因[1-2]。環孢霉素A(CsA)是真菌的一種代謝物,是目前常用的免疫抑制劑。國內外很多學者已充分論證了CsA在角膜移植術后降低排斥反應的作用,并且已廣泛運用于臨床。但在角膜移植動物模型中,CsA肌注劑量有所不同[3-5],本實驗建立大鼠穿透性角膜移植動物模型,分析肌肉注射不同劑量環孢霉素A對大鼠角膜移植排斥反應的防治作用,以期為下一步動物實驗中該藥的使用劑量提供理論依據。
1 材料與方法
1.1 實驗動物和藥品 選成年雌性清潔級Wistar大鼠 (體重200~220 g)作為供體,Lewis大鼠作為受體。大鼠由北京維通利華實驗動物技術有限公司提供。CsA購自中國醫學科學院血液病研究所。Brdu試劑盒購自羅氏公司。
1.2 實驗分組和手術 將33只Lewis大鼠隨機分3組,每組l1只。每只動物僅右眼手術。進行Wistar-Lewis鼠間同種異體角膜移植,術前用10%水合氯醛(3ml/kg)腹腔注射麻醉,散瞳,于受體右眼進行穿透性角膜移植手術,植片直徑3.5mm,植床3.0mm,l0.0尼龍線(美國Alcon)間斷縫合8~12針,術畢注入空氣形成前房。剔除伴有手術并發癥(包括白內障、嚴重前房積膿或術后第2天前房仍不能形成)的大鼠,因這些手術并發癥會影響移植結果,且容易導致移植排斥的錯誤診斷。自手術當天開始,每天肌肉注射給藥3次,A組給予CsA[1mg/(kg·d)],B組給予CsA[10mg/(kg·d)],C組給予等量不含藥物的PBS,連續用藥 10 d。
1.3 臨床觀察排斥反應及判斷標準 每組隨機選定6只大鼠用于臨床排斥評價,其余動物用于T細胞增殖實驗。術后第4天至第21天每天在裂隙燈顯微鏡下觀察術眼角膜,以后每周觀察兩次,直到100 d。參照Larkin等[6]的評分標準,植片混濁0~4級:0級為完全透明;1級為輕度混濁,虹膜紋理清晰可見;2級為中度混濁,部分虹膜紋理可見;3級為虹膜紋理不可見,但可見瞳孔;4級為完全混濁,瞳孔輪廓不清。植片水腫0~2級:0級為無水腫;1級為中度水腫;2級為伴有植片增厚的顯著水腫。植片新生血管0~4級:0級為無新生血管;1級為新生血管在任何象限伸入達到植片半徑的25%;2級為新生血管達到植片半徑的50%;3級為新生血管達到植片半徑的75%;4級為新生血管達到植片半徑的中央。移植排斥定義為術后曾經透明的移植片出現中等或嚴重混濁、水腫以及血管化,其中混濁程度≥3,并且總評分≥5。在100 d后移植片仍能保持透明被視為長期存活。
1.4 角膜組織學檢查 各組于術后第10天隨機取4只大鼠,過量麻醉后取右眼角膜,進行角膜組織切片的HE染色。
1.5 T細胞增殖實驗 每組其余大鼠用于取材,術后10 d處死,收集脾臟,分離單個核細胞,以5×105細胞/孔接種于96孔板,在加有10μg/mlConA的RPMI-1640培養液中,37℃、5%CO2條件下孵育 66 h,然后每孔加入終濃度為10μmol的BrdU培養18 h。培養板離心后干燥細胞,FixDenat溶液孵育30min,抗BrdU-POD孵育90min,顯色,酶標儀測定。
1.6 統計學方法 實驗數據應用SPSS 11.5統計軟件進行分析處理,應用Kaplan-Meier檢驗比較3組植片平均存活時間,應用單因素方差分析比較3組新生血管和T細胞增殖情況的差異。以P<0.05為有統計學意義。
2 結果
2.1 實驗動物數量分析 納入33只大鼠,其中1只發生前房積膿,2只出現白內障,予以剔除。
2.2 各組受體大鼠角膜植片的存活情況 A、B組角膜植片的存活時間與C組比較均顯著延長(P<0.01),B組優于A組(P<0.01)。見表1。
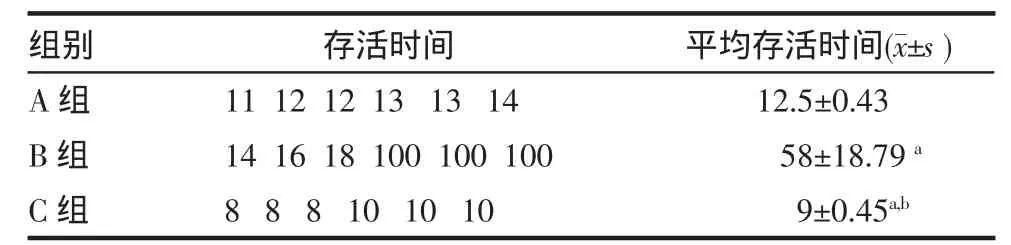
表1 各組受體大鼠角膜植片的存活時間(n=6,d)
2.3 各組角膜新生血管評分比較 對各時間點3組新生血管評分進行統計學分析,A、B組新生血管的評分均低于C組。第6天,C組與A、B組比較差異有統計學意義 (P=0.01),A組與B組無顯著性差異(P>0.05)。其余時間點,雖然A組的新生血管評分較C組值低,但差異無統計學意義,B組與A、C組比較差異有顯著性(P<0.05),見表2。
表2 3組術后各時間點角膜新生血管評分比較( )

表2 3組術后各時間點角膜新生血管評分比較( )
a P<0.05 vs A 組;b P<0.05 vsB 組
12 d 2.5±1.52 0.816±0.33a 3.17±0.98 b組別A組B組C組6 d 0.17±0.41 0.17±0.41 1.33±1.03 a,b 24 d 3.50±0.84 1.5±1.76 a 4.00±0.00b 18 d 3.33±1.21 1.00±1.26 a 3.83±0.41 b
2.4 各組角膜植片HE染色 見圖1。

2.5 各組受體大鼠脾臟T細胞增殖情況 對各組的T細胞增殖作統計學分析,A組(0.49±0.07)、B組(0.16±0.03)與 C 組(0.64±0.10)比較有顯著性差異(P<0.01),A組與B組比較差異有統計學意義(P<0.01)。
3 討論
角膜具有眾多特殊的免疫赦免機制,如缺乏血管、淋巴管以及抗原遞呈細胞,前房相關免疫偏離(ACAID)以及CD95L的表達等,相比其它器官移植手術,角膜移植排斥反應發生率較低。盡管如此,仍有大約30%的病例會發生排斥反應,最終導致5%~7%的病例移植失敗[7-8]。角膜移植排斥反應主要是以CD4+T細胞介導的細胞免疫應答,主要過程如下:抗原遞呈細胞(APCs)在促炎性因子、粘附分子以及趨化因子的作用下,由角膜緣以及角膜周邊移行到角膜中央,攝取和處理供體抗原,然后轉移至引流淋巴結,激活初始T細胞;T細胞增殖,進而分化為效應細胞,攻擊角膜內皮,基質以及上皮;角膜的免疫赦免機制被打破,植片基質和內皮受損,最終導致移植失敗[9-10]。在角膜移植排斥反應的治療方面,目前仍然是以糖皮質激素和環孢素A為主。但長時間應用糖皮質激素,可導致全身副作用及青光眼、白內障等局部并發癥的發生[11]。一般認為CsA選擇性抑制靜止期輔助性T淋巴細胞(Th)的分化增殖,抑制T細胞由G0期向G1期轉變,從而抑制Th細胞的抗原呈遞過程,并抑制白介素2(IL-2)和γ-干擾素的產生,減少角膜移植術后的排斥反應[4]。但CsA分子量大,且為疏水性,眼內通透性差,影響其局部用藥的療效。
在本研究中,體外實驗結果顯示10mg/(kg·d)CsA與1mg/(kg·d)CsA均能抑制T細胞增殖,但高劑量組效果更為明顯。體內實驗顯示高劑量組新生血管評分低于小劑量CsA治療組和空白對照組。雖然小劑量組的新生血管評分低于空白對照組,但除在第6天時兩者有顯著性差異外,其余時間點均無統計學意義。10mg/(kg·d)CsA較其它兩組顯著延長了角膜移植物的存活。
CsA是一種強效免疫抑制劑,是目前治療角膜移植術后免疫排斥反應的主要藥物。CsA全身用藥毒性嚴重,可能引起肝、腎毒性等副作用,限制了其在臨床的應用。臨床上主要使用局部滴眼劑的給藥方法,普通的滴眼液通透性差,近年被制成眼膏、眼劑、乳劑、膠原罩、脂質體、微粒體、納米等新型眼用制劑。在角膜移植及其它器官移植動物模型中,CsA全身應用比較多見,但其應用的劑量有所不同。本實驗旨在為我們下一步大鼠角膜移植動物模型中該藥的使用劑量提供理論依據。
[1]Bourges JL,Lalle PA,VanathiM,et al.Corneal graft rejection[J].SurvOphthalmol,2007,52(4):375
[2]余洪華,陸曉和.CD28/CTLA4-B7協同刺激分子與角膜移植免疫[J].眼科新進展,2005,25(5):476
[3]Dios E,Herreras JM,ScD AM,et al.Efficacy of systemic cyclosporine A and amnioticmembrane on rabbit conjunctival limbal allograft rejection[J].Cornea,2005,24(2):182
[4]Bourges JL,Lallemand F,Agla E,etal.Evaluation of a topical cyclosporine A prodrug on cornealgraft rejection in rats[J].Molecular Vision,2006,12(2):1461
[5]Vítová A,Filipec M,Zajícová A,et al.Prevention of corneal allograft rejection in amousemodelofhigh risk recipients[J].Br JOphthalmol,2004,88(10):1338
[6]Larkin DF,Calder VL,Lightman SL.Identification and characterization ofcells infiltrating thegraftand aqueoushumor in ratcorneal graft rejection[J].Clin Exp Immunol,1997,107(2):381
[7]謝立信,史偉云,王治宇,等.前房植入環孢素A緩釋系統抑制鼠高危角膜移植術后的免疫排斥反應 [J].中華眼科雜志,2002,38(7):422
[8]史偉云,謝立信.細胞毒T淋巴細胞相關抗原4免疫球蛋白抑制鼠高危角膜移植免疫排斥反應的實驗研究 [J].中華眼科雜志,2004,40(10):696
[9]Lam H,Dana MR.Corneal graft rejection[J].Int 0phthalmol Clin,2009,49(1):31
[10]Chong EM,DanaMR.Graft failure IV.Immunologicmechanismsof corneal transplant rejection[J].IntOphthalmol,2008,28(3):209
[11]Tabbara KF.Pharmacologic strategies in the prevention and treatment of corneal transplant rejection[J].IntOphthalmol,2008,28(3):223

