新知何脈脈 舊雨何悠悠
——簡析2010 年江蘇高考化學試卷中化學方程式的書寫
黃 波
(江蘇省泰州中學 江蘇 泰州 225300)
化學方程式作為一種重要的化學用語, 在高考中越來越體現它的活力和魅力。2010 年江蘇高考化學試卷中的“化學方程式書寫”不但考查了學生的基礎知識, 還考查了學生應用知識解決問題的能力以及發散思維的能力。 現簡要評析如下。
課本中的化學方程式往往出現在選擇題中
如試卷第3 題: 下列離子方程式表達正確的是( )
A. 用惰性電極電解熔融氯化鈉:2Cl-+2H2O
B. 用氫氧化鈉溶液除去鋁表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O
C.用稀氫氧化鈉吸收二氧化氮:2OH-+2NO2=NO3-+NO↑+H2O
D. 用 食 醋 除 去 水 瓶 中 的 水 垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
答案:B
評析:A 選項注意到題干中“熔融”即可,而題目中離子方程式表示的是電解氯化鈉溶液;B 選項正確;C 選項離子方程式元素、電荷、得失電子均不守恒;D 選項水垢主要成分CaCO3不拆。此題屬于容易題,有利于平穩考生考試心態。
在非選擇題部分, 陌生化學方程式的書寫逐漸體現出它的選拔功能,如試卷的15⑴①;16⑴;17⑴;18⑴②、⑵①。
15⑴①石灰乳參與反應的化學方程式為___________________________。
答案:Ca(OH)2+SO2=CaSO3+H2O
評析:15 題難度較大,體現在后面幾問,特別是最后一問。考生做完該題心中沒底。但是第一問還是起到送分、平穩考生心態的作用,畢竟只要有初中知識做基礎,考生都可以正確書寫出答案。
16⑴酸溶后溶液的pH=1,Ba(FeO2)2與HNO3的反應化學方程式為_____________________。
答案:Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O
評析: 因為此題涉及到考生比較陌生的物質Ba(FeO2)2,所以方程式的書寫就有難度了。 如果考生可以先標記鐵的化合價, 結合題目前后意思,完全可以把該物質類比為NaAlO2,這樣就不難推出其與足量硝酸反應時應轉化為Ba(NO3)2及Fe(NO3)3了。
17⑴采用方法Ⅰ脫硫, 并不需要先除去燃煤煙氣中大量的CO2,原因是_______________(用離子方程式表示)。
答案:HCO3-+SO2=HSO3-+CO2
評析:此題貌似簡單,甚至考生會覺得正確的答案不止一個。實際上,我們只要按照量的關系寫出先后的反應就會發現,正確的答案只有一個!開始時堿過量, 通入的CO2、SO2可以被完全吸收:
2NH3+SO2+H2O =(NH4)2SO3;2NH3+CO2+H2O =
(NH4)2CO3;隨著氣體的不斷通入,正鹽逐漸轉化為酸式鹽:(NH4)2SO3+SO2+H2O=2NH4HSO3;(NH4)2CO3+CO2+H2O=2NH4HCO3; 最終通入的燃煤煙氣中只有SO2可以和HCO3-反應最終生成HSO3-。
18⑴②共沉淀反應的化學方程式為______________________________。
答案:(NH4)2Fe(SO4)2+LiOH+H3PO4=LiFePO4↓+2NH4HSO4+H2O
評析:這又是一個涉及“酸式鹽”的化學方程式的書寫,當然也是考生最不熟悉,最怕書寫的一種。連續這樣考查涉及“酸式鹽”化學方程式的書寫,似有不妥之處,不知閱卷時,產物寫成(NH4)2SO4和H2SO4是否給分。 另外考生如果沒有“量”的觀點,且認為反應結束后溶液不應該呈酸性 (因為磷酸正鹽可在酸性條件下轉化為酸式鹽),還可能寫出其他產物如Li2SO4等。 個人認為這個題目有點“過”。
18⑵①在上述溶解過程中,S2O32-被氧化成SO42-,LiCoO2在溶解過程中反應的化學方程式為_________________________________。
答 案:8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O
評析:這是一個典型的氧化還原反應的配平,只要正確標出S、Co 在反應前后的化合價, 明確硫酸只起酸性介質的作用,再結合元素守恒,不難配平此反應。但是此刻考試已進入收官階段,由于時間的關系, 考生可能匆忙中寫出錯誤答案或者來不及寫出答案。
通過分析2010 年江蘇高考化學試卷中對化學方程式書寫的考題, 再次提醒我們高中教師在平時教學中, 要重視培養學生書寫化學方程式的基本功。當然精選的習題必不可少,下面一些題目可以給學生試一試!
練習
1.超細銅粉主要應用于導電材料、催化劑等領域中。 超細銅粉的某制備方法如下:
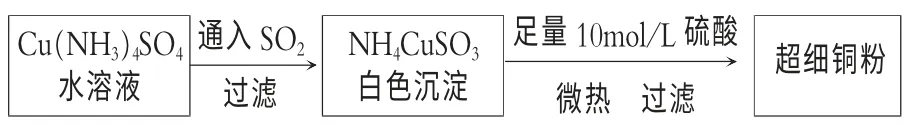
試回答下列問題:
NH4CuSO3與硫酸微熱反應的離子方程式為___________________________。
2.CuI 是難溶于水的白色固體。 已知:氧化性Cu2+>I2>Cu+, 還原性Cu>I->Cu+氧化還原反應進行的方向是: 較強氧化劑+較強還原劑→較弱還原產物+較弱氧化產物
⑴根據物質氧化性還原性的強弱推測, 在溶液中Cu2+和I-反應的產物是______、_____;
⑵久置于空氣中的HI 溶液呈黃色, 向其中加入一些銅粉,可使溶液黃色消失,反應的化學方程式為___________________________;
3. 發藍液是由NaNO3、NaNO2及NaOH 配成的,在加熱條件下,通過三步反應使鐵表面生成一層致密的Fe3O4:
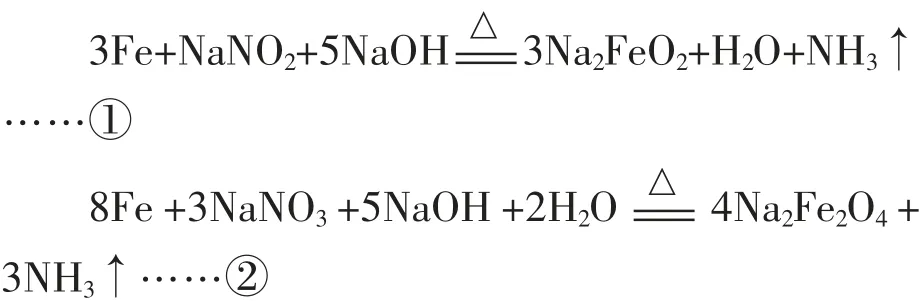
以及第三步生成四氧化三鐵, 請補充第三步反應的化學方程式并配平:______________________________。
4. 染料工業排放的廢水中含有大量有毒的NO2-,可以在堿性條件下加入鋁粉除去(加熱處理后的廢水會產生能使濕潤紅色石蕊試紙變藍的氣體)。 除去NO2-的離子方程式是:____________________________________。
答案及提示:
1.2NH4CuSO3+4H+=Cu+Cu2++2NH4++2SO2↑+2H2O
提示:雖然NH4CuSO3是銨鹽,但是題目告知其為白色沉淀,所以不能拆! 既然生成單質銅,根據化合價升降原則,必有元素化合價升高,所以推測是Cu+歧化,生成Cu2+! 反應物中的亞硫酸根在酸性條件下轉化為SO2氣體。
2.⑴CuI、I2⑵2Cu+I2=2CuI↓
提示: ⑴中Cu2+和I-反應的產物不應該寫Cu+, 題目已經提示CuI 是難溶于水的白色固體!⑵題目要求寫化學方程式,不應該寫離子方程式!(當然就是寫離子方程式CuI 也不能拆)
3.Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
提示: 不要被復雜的第一、 第二步反應所迷惑。遇到不熟悉的反應可以先標記化合價:①產物中鐵為+2 價, ②產物中鐵為+3 價, 再聯系Fe3O4中既有+2 價鐵又有+3 價鐵, 所以第三步反應必為Na2FeO2和Na2Fe2O4反應生成Fe3O4。
4.2Al+OH-+NO2-+2H2O=2AlO2-+NH3·H2O
提示:Al 轉化為Al3+、Al(OH)3、還是AlO2-? 應該是AlO2-, 因為堿性條件而且要遵守電荷守恒(OH-、NO2-都是帶負電)。 NO2-轉化為NH4+、NH3還是NH3·H2O?應該是NH3·H2O,因為加熱處理后的廢水會產生能使濕潤紅色石蕊試紙變藍的氣體,且AlO2-和NH4+不能大量共存(水解互促,進行到底)。

