你知道牛奶是怎么殺菌和提純的嗎?
——膠體知識的簡介
張寧梅
(南京市金陵中學 江蘇 南京 210005)
教學目的:
1.了解分散系的分類方法;
2.理解過濾、滲析的原理;
3.理解膠體的制備的基本思路和主要方法;
4.理解丁達爾現象的原理;
5.理解電泳的原理;
6.理解膠體的介穩性原理并應用該原理解釋膠體的聚沉。
教學重點:宏微觀概念的建立
引課:“一杯牛奶振興一個民族” 牛奶作為一種營養均衡、 豐富的食品倍受大家的喜愛,今年三鹿毒奶粉事件讓我們大家更加關注食品的安全和健康。牛奶是一種復雜的混合物,其中包含多種營養成分, 今年央視科普節目介紹了一種叫“極致奶”的優質奶與普通奶的區別:優質奶去除了牛奶中過多的脂肪, 并且分離出了一定量的細菌和巴氏消毒后殘留在奶中的細菌殘體。由此可見, 牛奶中過多的脂肪和細菌及細菌的殘體是影響牛奶質量和口味兩個重要方面。
設問:同學們,根據你的生活經驗和第一章化學實驗基本方法的內容, 你能不能推測一下, 懸浮于奶中的淡黃色的脂肪顆粒和一些雜質固體顆粒應該如何分離? 牛奶中大量的肉眼無法看見的細菌和細菌殘體又該用什么樣的過濾器才得以分離呢?
學生回答:略
總結: 茶水中的茶葉可用孔徑比茶葉小的金屬網濾去, 奶茶中的茶粉就必須用孔徑更小的紗布濾去, 這一生活事例告訴我們隨著需要分離的粒子越來越小,過濾器的孔徑也要越變越小,牛奶的分離凈化就利用了這樣的原理: 用顆粒過濾器除去其中過多的脂肪粒和固體顆粒, 用超濾膜去除其中的細菌和細菌殘體。
下面我們利用實驗室的儀器來模擬上述過程, 切身感受一下不同種類混合物的分離方法:有三個試劑瓶,它們分別盛放著:泥水、淀粉溶液和食鹽水。
設問:假如將這三種混合物相互混合在一起,我們可用怎樣的方法證明相應的各種物質的存在?
學生回答:泥水,用眼睛觀察。
淀粉溶液——加入碘水。
食鹽水——加入AgNO3/HNO3溶液。
設問:我們能否用什么方法將它們重新分離開?學生回答: 泥水與淀粉、 氯化鈉溶液通過濾紙過濾,溶液變澄清,設問:溶液澄清說明泥水的固體顆粒被濾紙分離出來, 那么淀粉和食鹽水都通過濾紙了嗎,如何證明?
演示實驗1:
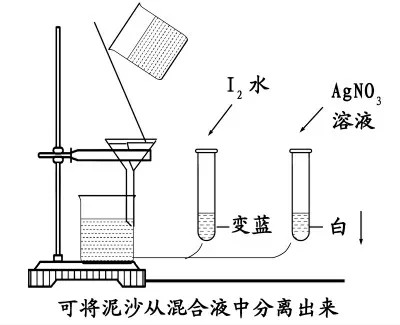
1.過濾一份樣品,并事先準備一份試樣,兩份試樣分別檢驗。
2.取少量的濾液

(由電荷守恒原理可知,濾液中同時含有Na+離子)
設問: 怎樣才能將淀粉大分子與溶液中的Na+離子和Cl-離子分離開來?
引導設問: 讓學生取出在家里做好的用醋酸浸泡的蛋殼觀察。 醋酸明明裝在雞蛋內部, 還隔著一層蛋膜,為什么外面的蛋殼變薄了、變得很容易剝離了? 這說明了什么?
學生回答:醋酸中的氫離子、水分子等微小粒子透過了蛋膜與蛋殼碳酸鈣接觸反應。
引導設問: 那么原雞蛋中的蛋白質大分子有沒有通過蛋膜? 這說明了什么? 因此蛋膜有什么用途?
學生回答:蛋膜可讓小分子、離子通過,而無法讓大分子通過; 可利用蛋膜分離濾液中的淀粉大分子和氯離子、鈉離子。
演示實驗2:
3.加入如圖懸掛在蒸餾水中的蛋膜中,浸泡后,從燒杯中取約5mL 試樣三份,第一份試樣放在試管架上備用,另兩份試樣分別做以下實驗:
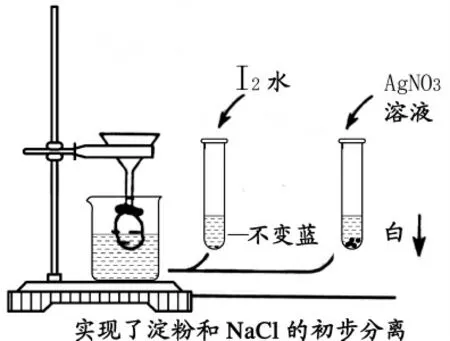
4.溶液

總結:(分散系的分類——實驗小結)
請大家根據上述實驗的結果分析:
設問:上述物質有哪些相同點?(從物質類別、組成的角度看)
學生回答: 物質類別都屬于以水為溶劑與其他物質所形成的混合物。
定義: 在此我們對原有的有關溶液概念加以延伸, 一種物質分散在另一種物質中所形成的混合物——分散系。
它們又有哪些不同點?(由實驗體會這三種不同混合物的分類依據)
學生回答:分散質的粒子大小不一。 (分散系的分類—微觀過程)
幻燈片演示: 一、分散系的分類及膠體的定義

設問: 這種分散質粒子大小介于濁液和溶液之間的分散系——膠體, 該如何由濁液或溶液制備呢?
學生回答:把濁液分散質粒子變小或把溶液分散質粒子變大。
介紹:和大家設想的一樣,我們把這種將懸濁液或乳濁液中的分散質分散成1~100nm 的膠體方法叫分散法。
幻燈片演示:二、膠體的制備
1.分散法
①研磨法,如:金溶膠:用納米微粒的膠體金可用于固定DNA 粒子、墨汁(磨墨)、碳素墨水。
②溶解法,如:淀粉溶液、蛋白質溶液、血液。
學生實驗1: 1.①1mol/L 鹽酸1/5 試管→加5~6 滴1mol/L 水玻璃→用力振蕩;
②1mol/L 鹽酸1/5 試管→加1mol/L 水玻璃1/5 試管→用力振蕩。
2.①1/4 試管蒸餾水→加5~6 滴飽和氯化鐵溶液→用力振蕩;
②1/4 試管蒸餾水→加熱煮沸→加5~6 滴飽和氯化鐵溶液→用力振蕩。
引導設問:實驗中你分別觀察到什么現象?
學生描述1:實驗1 步驟一沒有明顯現象,步驟二產生沉淀。
學生回答:實驗2 步驟一沒有明顯現象,步驟二溶液由黃色變為紅棕色。
引導學生: 試寫出兩個具有明顯實驗現象變化的化學方程式:
①FeCl3+3H2O=Fe(OH)3(膠體)+3HCl
②Na2SiO3(水玻璃)+2HCl=H2SiO3(膠體)+2NaCl
③Na2SiO3(水玻璃)+2HCl=H2SiO3↓+2NaCl
設問:實驗要想成功需要注意哪些操作?
學生回答:濃度不可過大,否則粒子過大不再是膠體變為濁液,并須不斷振蕩。
幻燈片演示:2. 化學結合法: 所有的化學反應, 只要能生成難溶物, 就可以通過控制反應條件,用來制備溶膠。
(1)水解反應;
(2)復分解反應。
設問:如何證明你制備的是膠體而不是溶液?
那么膠體到底有哪些有別于溶液和濁液的特殊性質呢?
展示圖片:潔凈的空氣可被歸類為氣態溶液,但含有灰塵和水蒸氣粒子的空氣屬于膠體,這樣的膠體中的粒子可以通過肉眼觀察到(這一生活現象大家應該很熟悉):當陽光照射上去可以看到明顯的光路。 按分散劑的種類我們可以把膠體分為:氣溶膠、溶膠、固溶膠,這三類膠體都有這個共同的性質, 那就是在光束的照射下它們都會形成光亮的“通路”。
演示實驗2: 用一束光分別通過盛放在試管中的泥水、 淀粉溶液和飽和食鹽水, 觀察實驗現象。
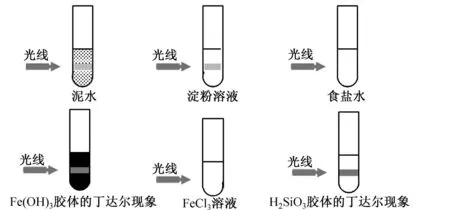
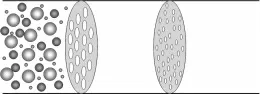
設問:為什么濁液不透光,溶液透光而只有膠體表現丁達爾現象?
學生回答:濁液分散質粒子太大、溶液分散質粒子太小。
介紹:①濁液粒子太大,大于入射光波長很多倍, 發生光的反射而無散射, 故光線不能完全通過。
②溶質粒子太小,小于入射光波長太多倍,入射光發生衍射,散射很微弱,表現為透光。
③膠體粒子直徑小于入射光波長, 發生光的散射,每一個微粒相當于一個發光體,無數發光體散射結果就形成了光的通路。
(展示幻燈片微觀原理圖)
幻燈片演示:三、膠體的性質
1.丁達爾現象——膠體的光學性質,用于區別溶液和膠體。
當一束光線透過膠體, 從入射光的垂直方向可以觀察到膠體里出現一條光亮的“通路”。
設問: 為什么氫氧化鐵膠體較長時間放置均勻穩定而氫氧化鐵懸濁液靜置沉淀? 用來制備氫氧化鐵膠體的原氯化鐵溶液和氫氧化鐵膠體誰更穩定呢? 為什么?
學生回答:懸濁液粒子太大,因重力沉降,膠體和溶液粒子較小因微粒永不停息的運動混合均勻相對穩定,其中溶液粒子更小更穩定。
那么是什么原因阻止膠體粒子相互聚集變大凝聚沉降?
2.膠體的穩定性——介穩性
穩定性:溶液>膠體>濁液
介紹: 膠體穩定的一個重要原因可以從電泳實驗中找到答案。
展示實驗圖:(引導學生做答) 陰極區顏色逐漸變深→陰極區膠粒濃度增大→Fe(OH)3膠粒向陰極移動→Fe(OH)3膠粒帶正電荷→Fe(OH)3膠粒吸附陽離子→膠粒吸附能力強,可吸附離子→膠粒直徑小, 表面積大 (類比碳塊、碳粉、活性炭)。
解釋:(1) 電泳——膠體的電學性質
①在外加電場的作用下,膠體的微粒在分散劑里向陰極(或陽極)作定向移動的現象,叫做電泳。
②電泳現象證明了膠體微粒帶有電荷, 利用電泳可以確定膠體微粒的帶電性質。
③各種膠體微粒的本質不同, 它們吸附的離子不同,所以帶有不同的電荷。

氫氧化鐵膠體的電泳
一般來講,金屬氫氧化物、金屬氧化物等膠體微粒吸附陽離子,帶正電荷;非金屬氧化物、非金屬硫化物等膠體微粒吸附陰離子,帶負電荷;有些膠粒如淀粉、蛋白質大分子一般不吸附各種離子不帶電, 因形成水膜而穩定存在。
學生總結:膠粒一般是帶電荷的、膠體都是呈電中性的、同種膠體的膠粒帶相同的電荷。
幻燈片演示:(2)膠體比較穩定的主要:同種膠體微粒帶同種電荷,互相排斥。
引導設問:根據膠體穩定存在的原因,你能推測出哪些手段可以破壞膠體的穩定性嗎?
學生實驗2:
①1mLFe(OH)3膠體→MgSO4(aq) →振蕩
②1mLFe(OH)3膠體→1mLH2SiO3膠體→振蕩
③1mLFe(OH)3膠體→加熱
④1mLH2SiO3膠體→加熱
總結:3.膠體的聚沉:在一定條件下膠體微粒聚集成沉淀而析出的過程。
(1) 膠體穩定存在的原因:布朗運動、膠粒帶電
(2)膠體的聚沉
①加入合適電解質:破壞膠粒的帶電結構
②與帶有相異電荷的膠體微粒的膠體混合
③靜電除塵
④長時間加熱:增加碰撞機會,并破壞雙電層結構
★日常生活:制豆腐原理(膠體的聚沉)和明礬凈水。
★自然地理:江河入海口處形成三角洲,其形成原理是海水中的電解質使江河泥沙所形成膠體發生聚沉。
趣味實驗思考: 氫氧化鐵膠體中逐滴滴加鹽酸會產生什么現象,為什么?
家庭小實驗: 哪些方式可以讓一杯牛奶中的膠體聚沉?
資料查找: 現代分離技術依次如何從牛奶里分離得到:脫脂乳、除菌乳、乳清蛋白、乳糖?

