直腸癌組織中腫瘤相關(guān)巨噬細(xì)胞、炎性因子的表達(dá)變化及意義
張銀旭,張俊華,劉 宇,左 騰
(遼寧醫(yī)學(xué)院附屬第一醫(yī)院,遼寧錦州 121001)
直腸癌是消化系統(tǒng)最常見(jiàn)的惡性腫瘤之一,癌細(xì)胞的侵襲轉(zhuǎn)移是其難以根治的重要原因。腫瘤生長(zhǎng)的微環(huán)境可能是促進(jìn)癌細(xì)胞侵襲轉(zhuǎn)移的重要因素。Albini等[1]認(rèn)為,腫瘤微環(huán)境可以作為化學(xué)防治癌癥的靶點(diǎn),通過(guò)對(duì)微環(huán)境中多種細(xì)胞及細(xì)胞因子的干預(yù)而影響腫瘤表型。慢性炎癥與癌癥之間存在著明顯相關(guān)性[2],晚期腫瘤的癌細(xì)胞侵襲前沿存在大量的炎性細(xì)胞,尤其是腫瘤相關(guān)巨噬細(xì)胞(TAM)[3]。本研究檢測(cè)了直腸癌及癌旁正常組織中的TAM及炎性因子,觀察其表達(dá)變化,并探討其臨床意義。
1 材料與方法
1.1 材料 選取 2010年 1月 ~2010年5月遼寧醫(yī)學(xué)院附屬第一醫(yī)院普外科手術(shù)切除的直腸癌標(biāo)本共40例份,每例留取直腸癌組織及距癌灶 5 cm的正常直腸組織。所有病例術(shù)前均無(wú)放化療及免疫治療史。
1.2 TAM及炎性因子檢測(cè)方法 標(biāo)本5μm厚切片,附于經(jīng)多聚賴氨酸附膜的載玻片,脫蠟,入水,抗原修復(fù),正常山羊血清封閉,加一抗,生物素化二抗,加辣根酶標(biāo)記鏈霉卵白素工作液,顯色,復(fù)染細(xì)胞核,透明,封片。顯微鏡觀察、照相。采集、分析并讀取數(shù)據(jù)。用已知陽(yáng)性切片作陽(yáng)性對(duì)照,PBS代替一抗作陰性對(duì)照。腫瘤組織中CD+68細(xì)胞為T(mén)AM,計(jì)數(shù)采用盲法,并參考Schoppmann等[4]的方法:低倍光鏡下找到 5個(gè)陽(yáng)性細(xì)胞最多的區(qū)域,在 400倍鏡下選取每個(gè)區(qū)域的5個(gè)視野,計(jì)數(shù)各視野內(nèi) TAM數(shù),并求均值作為該腫瘤組織TAM數(shù)。TGF-β、TNF-α、IL-6以細(xì)胞膜和(或)細(xì)胞質(zhì)內(nèi)出現(xiàn)棕黃色顆粒為陽(yáng)性表達(dá):著色細(xì)胞百分比 0~1%為 0分、~10%為 1分、~50%為 2分、~80%為 3分、~100%為 4分;細(xì)胞無(wú)著色為 0分、弱陽(yáng)性為 1分、強(qiáng)陽(yáng)性為 2分。上述兩分相乘,≤5為陰性、>5為陽(yáng)性。
1.3 統(tǒng)計(jì)學(xué)方法 采用SPSS10.0統(tǒng)計(jì)軟件。計(jì)量資料比較用 t′檢驗(yàn)或秩和檢驗(yàn),率的比較用 χ2檢驗(yàn),相關(guān)性分析用Spearman相關(guān)分析法。P≤0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 直腸癌及癌旁正常組織TAM、TGF-β、TNF-α、IL-6的表達(dá) 40例直腸癌組織TAM計(jì)數(shù)為(4.88 ±5.44)個(gè)/HP,TGF-β1的陽(yáng)性表達(dá)率為72.5% (29/40),TNF-α陽(yáng)性表達(dá)率為 57.5%(23/40), IL-6陽(yáng)性表達(dá)率為 70%(28/40);20例癌旁正常組織分別為(1.80±2.38)個(gè)/HP、35%(7/20)、15% (6/20)、40%(8/20);兩者相比,P均<0.01。
2.2 TAM、TGF-β、TNF-α、IL-6的表達(dá)與直腸癌臨床病理參數(shù)的關(guān)系 TAM計(jì)數(shù)與腫瘤浸深度、淋巴結(jié)轉(zhuǎn)移有關(guān)(P均<0.01);TGF-β、TNF-α、IL-6表達(dá)與腫瘤直徑、浸潤(rùn)深度及淋巴結(jié)轉(zhuǎn)移有關(guān)(P均<0.01)。詳見(jiàn)表1。
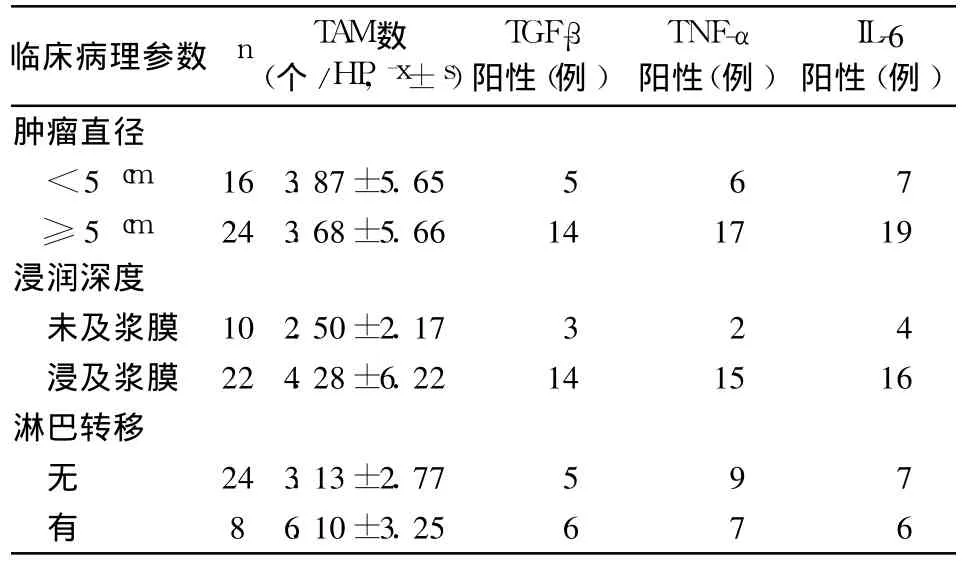
表1 TAM計(jì)數(shù)及TGF-β、TNF-α、IL-6的表達(dá)與直腸癌臨床病理參數(shù)的關(guān)系
2.3 直腸癌組織中TAM計(jì)數(shù)與TGF-β、TNF-α、IL-6表達(dá)的關(guān)系 直腸癌組織中TGF-β陽(yáng)性16例、陰性16例,其TAM計(jì)數(shù)分別為(8.687±3.665)、(3.875±1.655)個(gè)/HP;TNF-α陽(yáng)性22例、陰性10例,其TAM計(jì)數(shù)分別為(6.280±3.221)、(2.500 ±1.173)個(gè)/HP;IL-6陽(yáng)性8例、陰性24例,其TAM計(jì)數(shù)分別為(7.280±2.416)、(2.500±1.173)個(gè)/HP;上述各指標(biāo)陽(yáng)性病例的TAM計(jì)數(shù)明顯高于陰性病例 (P均<0.01)。直腸癌組織中TGF-β、TNF-α、IL-6表達(dá)與TAM計(jì)數(shù)呈正相關(guān)(r分別為0.892、0.971、0.962,P均<0.05)。
3 討論
腫瘤微環(huán)境是由一系列的居住細(xì)胞(如成纖維細(xì)胞)和遷移細(xì)胞(如造血細(xì)胞)組成。惡性腫瘤的生長(zhǎng)、擴(kuò)散不僅取決于腫瘤細(xì)胞本身的性質(zhì),腫瘤的間質(zhì)即腫瘤細(xì)胞賴以生存的微環(huán)境對(duì)腫瘤的發(fā)生、發(fā)展及預(yù)后也起著決定性的作用。外周血中的單核/巨噬細(xì)胞被腫瘤微環(huán)境中的趨化因子和細(xì)胞因子募集到腫瘤微環(huán)境后,誘導(dǎo)分化成替代激活表型(M 2型),稱(chēng)為T(mén)AM[5]。TAM的浸潤(rùn)密度與惡性腫瘤的預(yù)后密切相關(guān),在包括乳腺癌在內(nèi)的多種惡性腫瘤中高密度的TAM浸潤(rùn)是患者生存率降低的指標(biāo)之一[6]。
本研究結(jié)果顯示,直腸癌組織中TAM計(jì)數(shù)明顯高于癌旁正常組織,且腫瘤直徑≤5 cm和無(wú)區(qū)域淋巴結(jié)轉(zhuǎn)移者的TAM計(jì)數(shù)及炎性細(xì)胞因子表達(dá)均明顯低于癌細(xì)胞浸潤(rùn)至漿膜層、腫瘤直徑>5 cm和區(qū)域淋巴結(jié)轉(zhuǎn)移者。提示TAM計(jì)數(shù)可反映直腸癌的發(fā)生發(fā)展、轉(zhuǎn)移及預(yù)后。
TNF-α是重要的炎性細(xì)胞因子之一。首先, TNF-α的過(guò)表達(dá)使許多腫瘤細(xì)胞具有轉(zhuǎn)移及侵襲能力。其次,在伴有皮膚及肝臟轉(zhuǎn)移的結(jié)腸癌模型中, TNF-α及TNF-α受體1(TNFR1)敲除的小鼠對(duì)化學(xué)誘導(dǎo)的癌變耐受。再次,TNF-α可增強(qiáng)腫瘤細(xì)胞的運(yùn)動(dòng)、激活致癌通路并觸發(fā)上皮細(xì)胞間質(zhì)轉(zhuǎn)化(EMT)。TNF-α通過(guò)NF B介導(dǎo)的Snail穩(wěn)定而誘導(dǎo)EMT過(guò)程,從而可顯著促進(jìn)腫瘤細(xì)胞的遷移及侵襲。IL-6是聯(lián)系炎癥與癌癥的又一重要的炎性細(xì)胞因子。它可增強(qiáng)腫瘤啟動(dòng)的腸上皮細(xì)胞(IECs)的增殖。在乳腺癌細(xì)胞中,IL-6亦可作為EMT的誘導(dǎo)劑發(fā)揮作用,IL-6的異位表達(dá)呈現(xiàn)EMT表型。在本研究中,直腸癌組織中TGF-β、TNF-α、IL-6陽(yáng)性表達(dá)率顯著高于癌旁正常組織中的陽(yáng)性表達(dá)率,且有淋巴結(jié)轉(zhuǎn)移的直腸癌組織中TGF-β、TNF-α、IL-6陽(yáng)性表達(dá)率顯著高于無(wú)淋巴結(jié)轉(zhuǎn)移者。說(shuō)明在直腸癌發(fā)生、發(fā)展及轉(zhuǎn)移中上述炎性細(xì)胞因子可能發(fā)揮了一定的作用。
直腸癌微環(huán)境中的TAM通過(guò)分泌多種生長(zhǎng)因子和細(xì)胞因子來(lái)增強(qiáng)腫瘤細(xì)胞的浸潤(rùn)、轉(zhuǎn)移能力,促進(jìn)腫瘤血管生成,誘導(dǎo)微環(huán)境的免疫抑制狀態(tài)而有利于腫瘤的進(jìn)展。這些生長(zhǎng)因子和細(xì)胞因子包括IL-1β、TGF-β、TNF-α等。本研究發(fā)現(xiàn),直腸癌組織中TAM計(jì)數(shù)與TGF-β、TNF-α、IL-6的表達(dá)呈正相關(guān)。提示TAM可能上調(diào)了TGF-β、TNF-α、IL-6等炎性細(xì)胞因子的表達(dá)而與直腸癌侵襲轉(zhuǎn)移密切相關(guān)。
綜上所述,直腸癌微環(huán)境中TAM及炎性因子與腫瘤惡性生物學(xué)行為密切相關(guān),可能成為直腸癌治療的新靶點(diǎn)。
[1]Albini A,Sporn MB.The tumour m icroenvironment as a target for chemoprevention[J].Nat Rev Cancer,2007,7(2):139-147.
[2]Mantovani A.Cancer:inlamingmetastasis[J].Nature,2009,457 (1):36-37.
[3]Condeelis J,Pollard JW.Macrophages:obligate partners for tumor cellmigration,invasion and metastasis[J].Cell,2006,124(2):263-266.
[4]Schoppmann SF,Birner P,St?ckl J,et al.Tumor-associatedmacrophagesexpress lymphatic endothelial growth factors and are related to peritumoral lymphangiogenesis[J].Am JPathol,2002,161(3):947-956.
[5]Sica A,Schioppa T,Mantovani A,et al.Tumour-associatedmacrophagesare a distinct M 2 polarised population promoting tumour progression:potential targets of anti-cancer therapy[J].Eur JCancer, 2006,42(6):717-727.
[6]Lewis CE,Pollard JW.Distinct role of macrophages in different tumorm icroenvironments[J].Cancer Res,2006,66(1):605-612.

