馬兜鈴酸對腎小管上皮細胞氧化應激效應的作用
季文萱,黃俊彥*,孟冬梅,劉鳳娟
(1青島市中心醫院,青島266042;2青島大學醫學院附屬醫院,山東省代謝性疾病重點實驗室,青島266003)
馬兜鈴酸(AA)是馬兜鈴科馬兜鈴屬植物所含的成分,含AA成分的中藥曾在國內外用于治療多種疾病,后因發現其有致突變、致腫瘤和腎毒性等而引起國內外學者廣泛關注[1]。服用含AA中草藥導致的腎損害[即馬兜鈴酸腎病(AAN)]是一種特殊的腎小管—間質損害,其主要表現為進行性腎間質纖維化;該病發展迅速,急性者數月或數年即可發展為終末期腎功能衰竭,國內發病率較高[2],但其發病機制尚不完全清楚。研究表明,細胞凋亡與AAN發病關系密切;氧化應激可使機體處于易損狀態,同時能增強致病因素的毒性作用,導致基因突變,它不僅與多種疾病的發生、發展有關,也與細胞凋亡有密切關系[3]。目前,對AAN發病機制中氧化應激作用的研究少見報道。2010~2011年,我們觀察了AA對人腎小管上皮細胞(HK-2)氧化應激的效應。現報告如下。
1 材料與方法
1.1 主要藥品及試劑 AA(美國Sigma公司),噻唑藍試劑盒(Amresco公司),Annexin-V試劑盒(Invitrogen公司),丙二醛(MDA)、谷胱甘肽過氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)試劑盒均購自南京建成生物研究所。HK-2細胞株購自中國典型培養物保藏中心。
1.2 檢測方法
1.2.1 細胞培養及分組 將HK-2細胞培養于含10%胎牛血清及1%青霉素+鏈霉素的DMEM,在HamsF-12培養基中傳代培養,培養條件為5%CO2、37℃、濕度100%,實驗前24 h更換無血清培養液。實驗分兩組,對照組不加任何藥物;AA組在培養液中加入AA終濃度20 μg/ml。兩組血清濃度一致,培養48 h后終止實驗,每一實驗均重復3次。
1.2.2 細胞超微結構 留取各培養瓶中的培養液,用刮匙收集細胞后分別與原培養液混合,離心棄上清;細胞沉淀后加2.5%戊二醛4℃固定4 h;然后用PBS緩沖液沖洗3次,每次10 min;1%鋨酸4℃后固定2 h;PBS緩沖液沖洗3次,每次10 min;乙醇系列梯度脫水,30%、50%、70%、90%、100%的濃度每次10 min(其中100%2次)。再用Epon812環氧樹脂包埋,置37℃、45℃、65℃溫箱固化,每級溫度24 h。用UltracutE超薄切片機半薄切片,甲苯胺藍染色,半薄定位。UltracutE超薄切片機超薄切片,醋酸雙氧鈾硝酸鉛染色;最后用透射電鏡觀察HK-2細胞的超微結構,拍照讀片。在倒置顯微鏡下觀察細胞的生長狀況。
1.2.3 細胞活性 將細胞培養液置入96孔板,3×104細胞/200 μl,5%CO2、37 ℃孵育,至細胞 80%以上融合,更換無血清培養基繼續培養24 h。加入AA,每組設6個復孔,5%CO2,37 ℃孵育48 h,在倒置顯微鏡下觀察HK-2細胞活性。分別于實驗終止前4 h,在每孔加入 MTT液20 μl,繼續培養4 h。終止培養時,小心吸去孔內培養液,每孔加入二甲基亞砜150 μl,置搖床上低速振蕩10 min,使結晶物充分溶解。用酶聯免疫檢測儀在490 nm處測量各孔的OD值。
1.2.4 HK-2細胞凋亡情況 收集細胞1×106個/ml,1 000 r/min 離心 5 min,棄上清,用 PBS 重懸細胞。按照Annexin-V FITC細胞凋亡檢測試劑盒說明書操作,檢測各組HK-2細胞凋亡率。
1.2.5 細胞DNA含量測定 取對數生長期細胞,將細胞密度調至2×105個/ml的細胞懸液于25 ml培養瓶中培養24 h,分組處理HK-2細胞48 h;用含EDTA的胰酶消化并獲取各組1×106個/ml細胞,用PBS沖洗1次,棄上清,用70%乙醇固定,4℃保存14 h以上;離心去除固定液后,用PBS洗2次,加入2 g/L核糖核酸酶A,在37℃下溫育30 min;再加入50 μg/ml的非低滲碘化丙啶4℃孵育20 min,用流式細胞儀獲取1×104個細胞檢測DNA含量,分析G0/G1期峰前DNA含量占細胞總DNA含量的百分比,檢測細胞凋亡比例。
1.2.6 氧化應激反應指標 收集兩組細胞,用胰酶消化后,用PBS沖洗3遍,反復凍融,制成細胞裂解液,高速離心后取適量上清液;應用比色法檢測MDA、GSH-PX活力,黃嘌呤氧化酶法檢測SOD活力,分別按照試劑盒說明書檢測,蛋白質定量用考馬斯亮藍法。
1.3 統計學方法 采用SSPS17.0統計軟件,數據以±s表示,組間比較用t檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 細胞大體及超微結構 與對照組比較,AA組培養48 h后,其脫落細胞數量明顯增加,大量細胞懸浮于培養液中,貼壁細胞結構不完整;透射電鏡觀察顯示,AA組細胞出現體積變小、染色質凝集或邊集等改變,部分細胞出現崩解、壞死。
2.2 細胞活性及細胞凋亡比例 與對照組比較,AA組培養48 h后,HK-2細胞活性明顯受抑制,凋亡細胞比例明顯增加(見表1)。
2.3 細胞周期和細胞凋亡率 AA組細胞凋亡率為(29.39 ±0.83)%,對照組為(5.03 ±0.26)%,兩組比較有統計學差異(P<0.05)。AA組作用于HK-2細胞48 h后,G0/G1、G2/M、S期細胞比例發生變化,在G2/M期發生細胞阻滯。
2.4 兩組氧化應激指標比較 見表1。
表1 兩組細胞活性、細胞凋亡比例及氧化應激指標比較(±s)
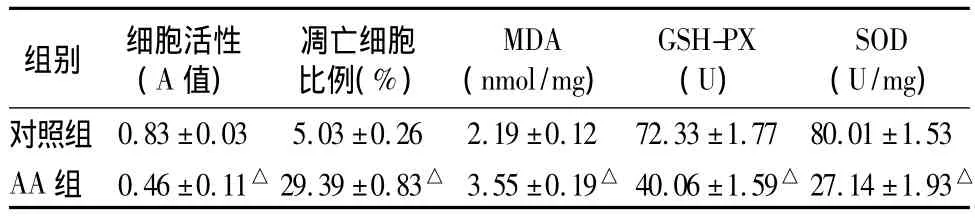
表1 兩組細胞活性、細胞凋亡比例及氧化應激指標比較(±s)
注:與對照組比較,△P <0.05
組別 細胞活性(A值)凋亡細胞比例(%)MDA(nmol/mg)GSH-PX(U)SOD(U/mg)對照組 0.83 ±0.03 5.03 ±0.26 2.19 ±0.12 72.33 ±1.77 80.01 ±1.53 AA 組 0.46±0.11△ 29.39 ±0.83△ 3.55 ±0.19△ 40.06±1.59△ 27.14±1.93△
3 討論
AAN的確切發病機制尚不明確,以往研究多集中在腎小管上皮細胞及腎間質成纖維細胞活化、腎小管上皮細胞轉分化、細胞凋亡及AA-DNA加合物等方面,對腎小管上皮細胞氧化應激效應的研究少見報道[4]。
氧化應激不僅與多種疾病的發生、發展有關,也與細胞凋亡有密切關系[5]。正常情況下,體內活性氧的產生和清除系統處于動態平衡狀態;當機體處于應激狀態時,體內氧化與抗氧化作用失去平衡可出現氧化應激反應。當機體處于氧化應激狀態時,體內組織的細胞活性氧升高超過其清除能力,可引起脂質過氧化水平升高,導致DNA氧化損傷、蛋白質表達異常、細胞凋亡及組織損傷,造成機體損害,甚至發生腫瘤。
MDA是脂質過氧化物,可通過多不飽和脂肪酸的過氧化反應引起細胞損傷。GSH-PX是體內廣泛存在的一種重要的催化過氧化氫分解酶,可特異地催化還原型谷胱甘肽對過氧化氫的還原反應,起到保護細胞膜結構和功能完整的作用。SOD對機體的氧化與抗氧化平衡起重要作用,能清除超氧陰離子自由基,保護細胞免受損傷[6]。本研究表明,不同劑量的AA可引起腎小管上皮細胞不同程度、不同類型的結構改變,使腎小管上皮細胞凋亡,導致腎小管上皮細胞大量缺失和腎小管萎縮。與對照組比較,AA組HK-2細胞MDA升高,GSH-PX、SOD活力明顯下降。表明AA可降低HK-2細胞的抗氧化酶活性,造成其抗氧化能力下降,氧自由基產生增多,自由基及其產物清除障礙,導致氧化應激明顯增強,造成多不飽和酸的脂質過氧化。AA誘導HK-2細胞凋亡的機制與其導致的氧化應激損傷有關,AA通過氧化應激途徑能誘導HK-2細胞凋亡,氧化應激可能參與AAN的發病過程。目前,對AA本身還是在其代謝過程中,抑或代謝終產物或綜合上述原因造成的氧化應激損傷尚不明了。防治氧化應激對腎臟的損傷可能是治療AAN的新手段,并有助于進一步研究AAN的發病機制。
[1]Jha V.Herbal medicines and chronic kidney disease[J].Nephrology(Carlton),2010,15(suppl 2):10-17.
[2]諶貽璞,陳文.馬兜鈴酸腎病的研究進展[J].腎臟病與透析腎移植雜志,2002,11(1):63-66.
[3]蘇震,徐少偉,鄭法雷,等.馬兜鈴酸對人腎小管上皮細胞轉分化和凋亡作用的體外實驗研究[J].中華預防醫學雜志,2002,36(5):301-304.
[4]季文萱.楊成對.劉密新.等.馬兜鈴酸—脫氧核糖核酸加合物的質譜分析[J].分析化學,2008,36(7):930-934.
[5]Xie J,Guo Q.Apoptosis antagonizing transcription factor protects renal tubule cells against oxidative damage and apoptosis induced by ischemia-reperfusion[J].J Am Soc Nephrol,2006,17(12):3336-3346.
[6]Stacchiotti A,Morandini F,Bettoni F,et al.Stress proteins and oxidative damage in a renal derived cell line exposed to inorganic mercury and lead[J].Toxicology,2009,264(3):215-224.

