大鼠腦出血灶周水腫變化與缺血改變的研究
胡 明,牛小媛
山西醫科大學第一附屬醫院神經內科,山西太原 030001
腦出血是神經科常見病,在常規治療后,大約有1/3的腦出血患者在發病后一段時間內仍出現進行性神經功能惡化,提示除血腫引起的急性神經組織損害外,還存在有血腫周邊的繼發性損害。這部分患者在影像學上表現為持續存在的環形低密度影,對于此區域的認識集中在水腫帶和缺血梗死帶兩方面。腦水腫主要與細胞內外異常液體積聚有關,主要分成血管源性腦水腫和細胞毒性腦水腫,由于病變的程度以及病情發展的不同,這兩類腦水腫常常同時存在[1-2];Forbes等[3]對出血灶區域的DWI及MRIT2加權像研究發現:血腫周圍除水腫外還是存在缺血帶。可見對于此區域水腫與缺血共存可以達到共識,但水腫、缺血隨時間的變化關系,至今還未有很明確的答案。本實驗通過比較不同時間點大鼠ICH模型血腫灶周的水腫與缺血的變化過程,探討大鼠腦出血水腫高峰期后灶周水腫及缺血的變化。
1 材料與方法
1.1 材料
1.1.1 實驗動物 SD雄性大鼠,體重200 g左右,由山西醫科大學動物實驗中心提供。
1.1.2 試劑 2%TTC溶液、TUNEL試劑盒均購于山西省太原市boster試劑公司。
1.1.3 儀器 立體定位儀、必要手術器械;方正V70+掃描儀、計算機設備及軟件。
1.2 動物模型制作
大鼠術前8 h禁食,不禁水。參照 Deinsberger[4]、周中和等[5]的報道方法,采用二次注血/退針法:緩慢注射自體血100μl至基底節區制成大鼠ICH模型;對照組相同部位打孔進針,不注血。實驗陽性大鼠選擇參照Bederson等[6]的方法:神經功能缺陷評分≥2分,及大鼠腦切片中有明顯的圓形、橢圓形或不規則的血腫存在為模型成功標準,血液針道反流、進入腦室或死亡者均剔除。
1.3 試驗分組
SD大鼠45只,30只造模。按起病后不同時間各分為3、5、7、14、21 d 5 個組,每組各 9 只(3 只對照+6 只模型)。
1.4 腦組織HE染色及TTC染色
各組大鼠于ICH損傷后在相應的時間點用過量的水合氯醛麻醉,直接斷頭取腦,完整取出腦組織,用濾紙吸干腦組織表面的液體和血跡,-20℃冰箱冷凍20~30 min,以進針點所在且垂直于大腦縱裂的冠狀面為中心(盡量通過血腫中心)切分腦組織為前后兩部分,向前向后取腦冠狀腦片各2片,在4片腦片中取包含血腫較小者固定,石蠟包埋,用于HE染色和TUNEL試驗;將剩余3片腦片置已預熱到37℃的2%TTC溶液中,37℃恒溫箱內避光染色20 min,再浸泡在4%多聚甲醛中固定8~12 h。掃描儀掃描標本切面(光學分辨率和色彩位數分別設置為600 dpi,24位真彩色)。觀察灶周染色情況;運行圖像處理軟件運用Visual Basic 6.0,打開掃描圖像,測量梗死帶內徑,單位為mm;測量血腫面積,單位為mm2。對照組同時同部位做相同處理。
1.5 水腫程度評估
取1.4中所述模型的剩余腦組織用電子天平先稱取濕重,電熱恒溫培養干燥兩用箱100℃烘烤48 h,再稱取干重。利用腦組織含水量=(鮮質量-干質量)/鮮質量×100%進行計算。
1.6 TUNEL法檢測凋亡細胞
①標本切片常規脫蠟(不過H2O2),用蒸餾水洗2次,PBS溶液洗2次,每次5 min。②配制新鮮的蛋白酶K(蛋白酶K 20μg溶于10 mM Tris/Hcl中),標本片加新鮮稀釋蛋白酶K后37℃烤箱中孵育20 min。③20 min后,取出標本,用PBS洗3次,每次5 min。④閉光環境下加TUNEL反應混合物,加完后在37℃烤箱中孵育1 h,1 h后PBS洗3次,每次5 min。⑤避光環境下加POD 37℃溫箱中孵育30 min,后PBS洗3次,每次5 min。⑥DAB顯色:取1 ml蒸餾水,依次加入顯色試劑盒中A、B、C試劑各一滴,混勻后加至標本片上,鏡下控制顯色時間3~10 min,水洗。⑦蘇木素復染、脫水、透明、封片。
1.7 統計學處理
數據以均數±標準差(x±s)表示。運用SPSS 17.0軟件對數據進行統計學分析,相同時間點手術組與對照組的比較采用兩樣本t檢驗;手術組不同時間點的組間比較采用單因素方差分析。P<0.05表示差異有統計學意義。
2 結果
2.1 HE染色
光鏡下可見出血灶與遠隔正常腦組織間有一過渡帶即血腫周圍區。3 d時,紅細胞溶解,出血灶周炎細胞增多以分葉核中性粒為主,水腫明顯,出現少量紅色的壞死神經元;5 d時出現少量紅細胞溶解后的棕黃色顆粒,炎癥細胞,細胞水腫程度與3 d時相似,能看見少量壞死神經元;7 d時依然可見水腫、炎細胞,且水腫細胞間夾雜有核固縮或碎裂的細胞,壞死神經元細胞增加;14 d時水腫細胞明顯減少,大量壞死細胞及細胞框架,炎細胞及神經元結構不好辨認;21 d時血腫吸收者留有中風囊,囊周細胞基本正常。血腫未吸收者周邊喪失細胞結構,色淡染,只見不全細胞結構和壞死后的輪廓。
2.2 TTC染色
正常腦片被均勻染成玫紅色,灶周區域色淡染,梗死組織呈基本規則的白色帶條狀,血腫呈灰黑色。梗死帶結果見表1,血腫大小變化結果見表2。
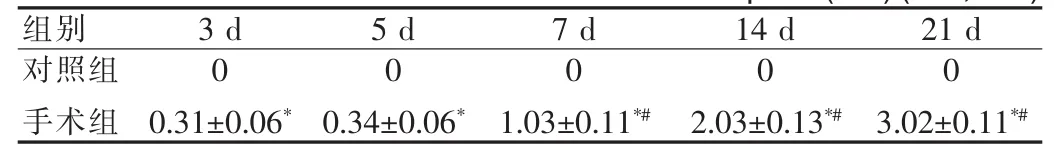
表1 血腫周圍梗死帶最小內徑(mm)(x±s,n=9)Tab.1 Minimum inside diameteraround infarctionspace(mm)(x±s,n=9)
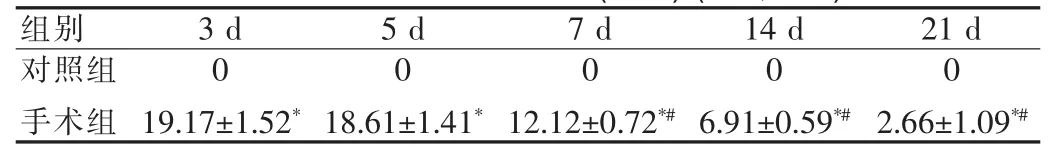
表 2 血腫面積(mm2)(x±s,n=9)Tab.2 Haematoma area(mm2)(x±s,n=9)
2.3 水腫程度評估
腦組織含水量=(鮮質量-干質量)/鮮質量×100%。見表3。
2.4 凋亡細胞檢測
陽性細胞為細胞核呈棕黃色,較小的棕黃色圓形小體為凋亡小體。在10×40倍光學顯微鏡下,圍繞梗死灶、出血灶中心取6個不重復高倍鏡視野,計數每個視野凋亡細胞陽性細胞數,取均值。見表4。
3 討論
近年來的臨床和動物實驗結果表明腦出血神經損傷機制除血腫引起的急性神經組織損害外,還存在血腫周邊的繼發性損害。有研究顯示,急性腦出血灶周存在血流量下降(CBF),且急性期血腫周邊灌注缺損量與血腫體積呈正相關,但腦出血后4~6 h血液開始凝固縮小,血腫的機械壓迫作用造成的CBF下降在程度和時間上能否達到引起腦缺血性損傷的水平目前仍有爭議[7-8]。目前文獻報道的相關試驗大多集中于腦出血急性期灶周改變,3 d后的血腫灶周改變報道較少。Daverat等[9]的一個前瞻性研究發現,年齡是人類腦出血后功能恢復的重要因素之一;另有研究發現年老的大鼠制作為腦出血模型后,可誘導出相對于年輕大鼠更高的神經膠質細胞活性[10],提示遲發型腦水腫的出現幾率可能與年齡成反比(年齡越大,出現幾率越小)。本實驗模型在成年大鼠(200 g左右)腦內注入自體血100μl,相當于年輕人基底節區腦出血80 ml左右,這一血量可使血腫在3周內不會完全被吸收,且把年齡影響因素降到最小。本試驗結果顯示:水腫在3~7 d一直處于水腫高峰,14 d才明顯下降,與之前的研究結果3~5 d水腫達高峰時間延長,可能因為出血量大,吸收減慢,延長了各種水腫因素的作用時間。同時還顯示,腦出血血腫與出血灶遠隔區域存在一個區域。隨著出血時間延長,此區域細胞形態改變、炎癥、組織水腫,組織缺血經歷了一個從輕到重的動態改變過程,任其發展,該區則發生不可逆損傷:出現與缺血梗死相似的病理變化。

表3 各時間點大鼠腦組織含水量的變化(%,n=9)Tab.3 The changing of rats brain water content in different time spot(%,n=9)

表4 各時間點凋亡細胞陽性表達(x±s,n=9)Tab.4 The counting of apoptosis in different time spot(x±s,n=9)
腦出血引起細胞凋亡的詳細機制還不明確。出血周圍繼發性缺血、凝血酶釋放、血紅蛋白分解、炎癥細胞浸潤、各種細胞因子的表達等因素可能都是誘導腦出血血腫灶周細胞凋亡的因素。有研究顯示腦出血導致血腫周圍及遠隔區域腦組織血流量下降,一般可降至正常的50%左右[11],相對溫和的缺血不足以引起腦梗死,但易導致凋亡性細胞死亡[12]。本實驗中各手術組間凋亡細胞數均有顯著差異,HE染色提示隨時間的延長出現不可逆的神經細胞壞死,可能是由于血流量進一步下降,加上凝血酶、血紅蛋白釋放及各種炎癥因子表達增加等因素,導致出血灶周凋亡細胞表達持續增加,最終發展為細胞壞死,血管閉塞,組織血液供應終止,缺血性損傷發生。通過該實驗我們認為腦出血后出血灶周為一水腫缺血混合區域,從出血開始到出血后2周以水腫為主,2周后水腫相對穩定,出現缺血改變,類梗死過程;細胞死亡形式開始以凋亡為主,后發展為細胞壞死,所以試驗中14 d后,相似位置觀察到的凋亡細胞明顯下降,出現大量壞死細胞結構。
本實驗對于腦出血水腫高峰期后的病程變化有一個較為直觀的闡述,為腦出血的治療,特別是在脫水治療時間方面提供新的思路。此外,通過試驗我們可以看到細胞凋亡在腦出血后是極為重要的一個環節。因此,加大細胞凋亡在出血性腦損傷中的作用及腦出血導致細胞凋亡的原理,利用各種方法阻止細胞凋亡的啟動和發展,有可能成為防治出血性卒中的新途徑。
[1]Heo JH,Han SW,Lee SK.Free radicals as triggers of brainedema formation after stroke[J].Free Radie Biol Med,2005,39(1):51-70.
[2]Kimelberg HK.Current eoncepts of brainedema:review of laboratory investigations[J].JNeurosurg,1995,83(6):1051-1059.
[3]Forbes KP,Pipe JG,Heiserman JE.Diffusion-weighted imaging provides support for secondary neuronal damage from intraparenchymal hematoma[J].Neuroradiology,2003,45:363-367.
[4]Deinsberger W,Vogel J,Kuschinsky W,et al.Experimental intracerebral hemorrhage:description of a double injection model in rats[J].Neurol Res,1996,18(5):475-4777.
[5]周中和,曲方.一種改良大鼠自體血腦出血模型:二次注血/退針法[J].中國臨床神經科學,2004,12(4):406-408.
[6]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-6.
[7]Xue M,Del-Bigio MR.Intracortical hemorrhage injury in rats:relationship between blood fractions and brain cell death[J].Stroke,2000,31(7):1721-1727.
[8]Peeling J,Yan HJ,Corbett D,et al.Effect of FK-506 on inflammation and behavioral outcome following intracerebral hemorrhage in rat[J].Exp Neurol,2001,167(2):341-347.
[9]Daverat P,Castel JP,Dartigues JF,et al.Death and functional outcome after spontaneous intracerebral hemorrhage:a prospective study of 166 cases using multivariate analysis[J].Stroke,1991,22(1):1-6.
[10]Gong Y,Hua Y,Keep RF,et al.hemorrhage:elects of agingon brain edema and neurological deficits[J].Stroke,2004,35(11):2571-2575.
[11]Yonezawa T,Hashimoto H,Sakaki T.Serial change of cerebral blood flow aftercollagenase induced intracerebral hemorrhage in rats[J].No Shinkei Geka,1999,27(5):419-425.
[12]Bennett SA,Tenniswood M,Chen JH,et al.Chronic cerebral hypoperfusion elicits neuronal apoptosisand behavioral imparement[J].Neuroreport,1998,9(1):161-166.

