骨髓間充質干細胞促進兔預構皮瓣成活的實驗研究
丁志 鄧辰亮 鄭江紅 萬偉東 茅廣宇 楊松林
隨著再生醫學的興起,細胞治療得到不斷發展,干細胞因具有多向分化潛能和自我復制能力而備受關注。其中,間充質干細胞因來源廣泛,分離培養容易,增殖和多向分化能力強,已成為干細胞治療領域的研究熱點,被廣泛報道應用于各種病損的組織器官。近年來的諸多研究發現,骨髓間充質干細胞(BMSC)除能分化為多種參與血管形成的細胞外,還能分泌 VEGF、IGF、EGF、KGF、TGF、SDF1 等多種促進血管生成的細胞因子[1-2],促進血管再生、改善局部血供,已用于治療心肌缺血、缺血皮瓣的成活等[3-5]。而預構皮瓣成功的關鍵也是血管再生,因此用間充質干細胞來促進預構皮瓣的成活應是可行的。因此,本研究在將兔股動靜脈血管束植入其腹部皮下的同時,向血管束周圍注射BMSC懸液,通過觀察其分化作用和旁分泌作用,以及對預構皮瓣成活的影響,探討BMSC促進預構皮瓣存活的可能性。
1 材料與方法
1.1 材料
DMEM-F12培養基、胎牛血清(Gibco公司,美國);兔抗人VEGF單克隆抗體、FITC標記的BrdU特異性單克隆抗體(Roche公司,瑞典);耐光性菁染料cyb3標記的vWF多克隆抗體 (Santa Cruz公司,加拿大);小鼠抗兔-CD45-FITC、小鼠抗兔-CD90-FITC(Caltage 公司,美國);小鼠抗兔-CD34-FITC、小鼠抗兔-CD45-FITC(Santa Cruz公司,加拿大);BrdU(溴脫氧尿嘧啶)、CFDA-SE(羧基熒光素二醋酸鹽琥珀酰亞胺酯)(友誼中聯生物科技公司,中國);山羊抗兔羅丹明 (武漢博士德公司,中國);PVDF膜 (Millipore公司,美國);ECL發光試劑盒(Thermo 公司,美國);流式細胞儀(Becton Dickinson公司,美國);電泳儀 EPS-300(天能,中國);16 只健康雄性新西蘭大白兔(上海生旺實驗養殖場,中國)。
1.2 方法
1.2.1 BMSC的分離培養
體質量約3 Kg的健康新西蘭大白兔,麻醉狀態下用骨髓穿刺針抽取左側髂骨骨髓,置入15 mL離心管中,1 000 r/min離心10 min,棄上清,用移液槍吸取含15%小牛血清的DMEM培養液至離心管,反復吹打使之充分混合,接種于25 mL細胞培養瓶,置入37℃、飽和濕度、5%CO2培養箱中培養。24 h后更換培養液,除去未貼壁的細胞,倒置相差顯微鏡觀察細胞生長情況。之后每3天更換培養液,待細胞達到90%融合后,0.25%胰蛋白酶37℃消化1 min,培養液中止胰酶消化,按1∶3傳代;同前法換液,至10~12 d細胞90%融合時,按1∶3的比例再次進行傳代接種培養;傳代培養過程中每3天換液一次,直至貼壁細胞彼此融合,鋪滿整個培養瓶的底面,重復以上操作。
1.2.2 BMSC的鑒定
取培養至第3代的貼壁細胞,0.25%的胰酶消化法收集細胞,分別取1×106個細胞與抗CD34、CD45、CD29、CD90 抗體(效價均為 1∶50)室溫孵育30~40 min,0.1 mol/L PBS洗滌 2次,滴加 FITC 標記的二抗,避光孵育30 min,0.1 mol/L PBS洗滌2次后懸浮,采用流式細胞儀分析。
1.2.3 BMSC的體外BrdU和CFDA-SE標記
取第3代BMSC,移植前48 h對細胞進行換液,用含1%FBS的DMEM完全培養基培養細胞24 h,培養瓶中加入5 μmol/L的BrdU,37℃孵育24 h,離心法收集細胞,PBS重懸細胞。加入等體積的10 μmol/L CFDA-SE,于37℃孵育10 min,用完全培養基離心洗滌細胞2次,放入培養箱中培養24 h,熒光顯微鏡下觀察標記情況。
1.2.4 預構皮瓣模型制備
16只健康雄性新西蘭大白兔共構建32個預構皮瓣,每只實驗兔的腹部兩側各構建一個股動靜脈血管束預構腹部皮瓣,分別為實驗組(n=16)和對照組(n=16)。3%戊巴比妥鈉自耳緣靜脈內注射麻醉,實驗兔腹部兩側各標記4 cm×2 cm矩形預構區,短邊平行于腹股溝韌帶,自尾側短邊中點向后縱向切開后肢皮膚,顯微鏡下剝離出長約4 cm的股動靜血管束,遠端結扎切斷。在兩側預構區域的中軸線上,于真皮與肉膜層間各制作一皮下隧道,向實驗組每個隧道壁分4個點經皮注射濃度為5×106cells/mL的BMSC懸液,每點注射0.05 mL,同法向對照組隧道壁注射等量的生理鹽水。將已剝離好的股血管束翻轉置入相應的皮下隧道。所有預構區域均在術后2周沿原標記線切開皮膚,于肉膜層下剝離形成由植入的股血管束為軸心血管的島狀皮瓣(圖1)。
1.2.5 BMSC移植后的追蹤觀察
構建預構皮瓣模型術后1周,從兩組中各隨機選取1個預構區域切下行冰凍切片,丙酮固定,熒光顯微鏡下觀察標記有CFDA-SE的BMSC,觀察綠色熒光的量,以反映BMSC的增殖和分布情況。
1.2.6 預構皮瓣VEGF的Western Blot半定量分析
從兩組中分別隨機選取3個預構島狀皮瓣,共6個皮瓣樣本置于干冰上,每樣本切取大約200 mg組織,加入1 mL 4℃預冷的T-PER(Tissue Protein Extraction Reagent)組織裂解液,使用電動勻漿器進行組織勻漿,4℃條件下10 000 g離心5 min,收集上清液,使用BCA蛋白定量試劑盒進行總蛋白濃度檢測。調整蛋白濃度至10 μg/μL,-20℃保存。制膠(12%分離膠),蛋白上樣,電泳,濕法轉膜(400 mA橫流1 h),PVDF膜用溶解有5%脫脂奶粉的TBST封閉(常溫封閉 2 h),加入 VEGF 一抗(TBST,1∶100稀釋),4 ℃過夜,TBST 洗膜,加入二抗(TBS,1∶100稀釋), 室溫反應1 h,TBST洗膜,ECL (Pierce ECL Western Blotting Substrate,32106)顯色 1 min,暗室曝光X線片,應用灰度分析軟件進行光密度分析。
1.2.7 預構皮瓣的免疫熒光化學染色
從兩組中各隨機選取4個預構島狀皮瓣,共8個皮瓣樣本,制作連續冰凍切片,順序加入vWF一抗(1∶200)和羅丹明標記的二抗(1∶100),以非特異血清代替一抗作為陰性對照,室溫下孵育2 h,PBS洗片;再順序加入針對 BrdU 的一抗(1∶100),二抗為FITC 標記(1∶100),室溫下孵育 2 h,PBS 洗片,熒光顯微鏡下觀察。
1.2.8 預構島狀皮瓣存活率大體觀察
兩組中余下的各8個島狀皮瓣均縫回原處,形成島狀皮瓣后的第七天,麻醉動物,觀察皮瓣顏色、皮溫、彈性質地和毛發生長情況,相同物距下用數碼相機(Canon 550D)進行皮瓣攝像,圖像輸入計算機,應用Image-Pro Plus.V5.0,經圖像增強、分割、待測面積的二值化處理,精確測量皮瓣存活部分及壞死部分面積,根據公式計算出各皮瓣存活率。

1.2.9 統計學方法
2 結果
2.1 BMSC的形態學觀察
原代細胞在接種24 h后,可見部分貼壁的圓形細胞;48~72 h 后,細胞呈紡錘形、梭形、多角形,48 h后這些細胞形成明顯的細胞集落,大小不一,每個集落約由十幾到幾十個細胞組成,細胞集落逐漸增多、增大,集落之間相互靠進;12~15 d可達到90%融合,融合后呈旋渦狀。以1∶3傳代的細胞24 h內完全貼壁,4~6 d內達到90%融合。原代培養發現局部區域有少許小而圓的細胞,傳代后消失。第2代以后,細胞形態貼壁細胞形態呈梭形﹑三角形﹑扇形和圓形,平鋪生長,不再形成明顯的集落(圖2)。
2.2 BMSC的鑒定
流式細胞儀分析顯示,第3代細胞均一性較好,達99%以上,BMSC具有獨特的免疫學表型,造血譜和內皮細胞標記CD34和CD45呈陰性表達,間充質干細胞表面標記CD29、CD90呈陽性表達,說明傳代貼壁生長的梭形細胞為BMSC。
2.3 BMSC懸液注射后1周的觀察
BMSC懸液注射入預構區隧道壁后1周,熒光顯微鏡下觀察冰凍切片,發現實驗組皮下組織內均勻分布綠色的BMSC,并參與到小血管壁中;對照組內未發現綠色熒光標記的細胞(圖3)。
2.4 島狀皮瓣存活率的大體觀察
形成島狀皮瓣時,未發現股血管栓塞現象,島狀預構皮瓣形成后7 d,實驗組皮瓣大部分成活良好,顏色粉紅,皮溫正常,有毛發生長,彈性及質地與周圍正常皮膚組織相似,僅邊緣部分少許區域顏色暗紅;對照組皮瓣近一半區域皮膚顏色變黑、組織回縮、彈性差、質地變硬、切割組織不出血。經圖像分析,實驗組和對照組皮瓣存活率分別為(93.1±2.6)%和(51.5±7.5)%,兩組間差異有統計學意義(P<0.05)。
2.5 Western Blot檢測結果
實驗組皮瓣組織內VEGF含量明顯高于對照組(圖 4),兩組間差異顯著(P<0.05)。
2.6 BrdU/vWF免疫熒光雙標記檢測
免疫熒光雙標檢測結果顯示,細胞懸液注射后第14天,實驗組免疫熒光組織切片可見大量BrdU染色陽性的細胞,胞核呈現綠色熒光,胞漿中有紅色熒光信號,含有雙色熒光的細胞密集地整合在血管壁中,對照組免疫熒光組織切片未發現綠色及紅色熒光信號表達的細胞(圖5)。
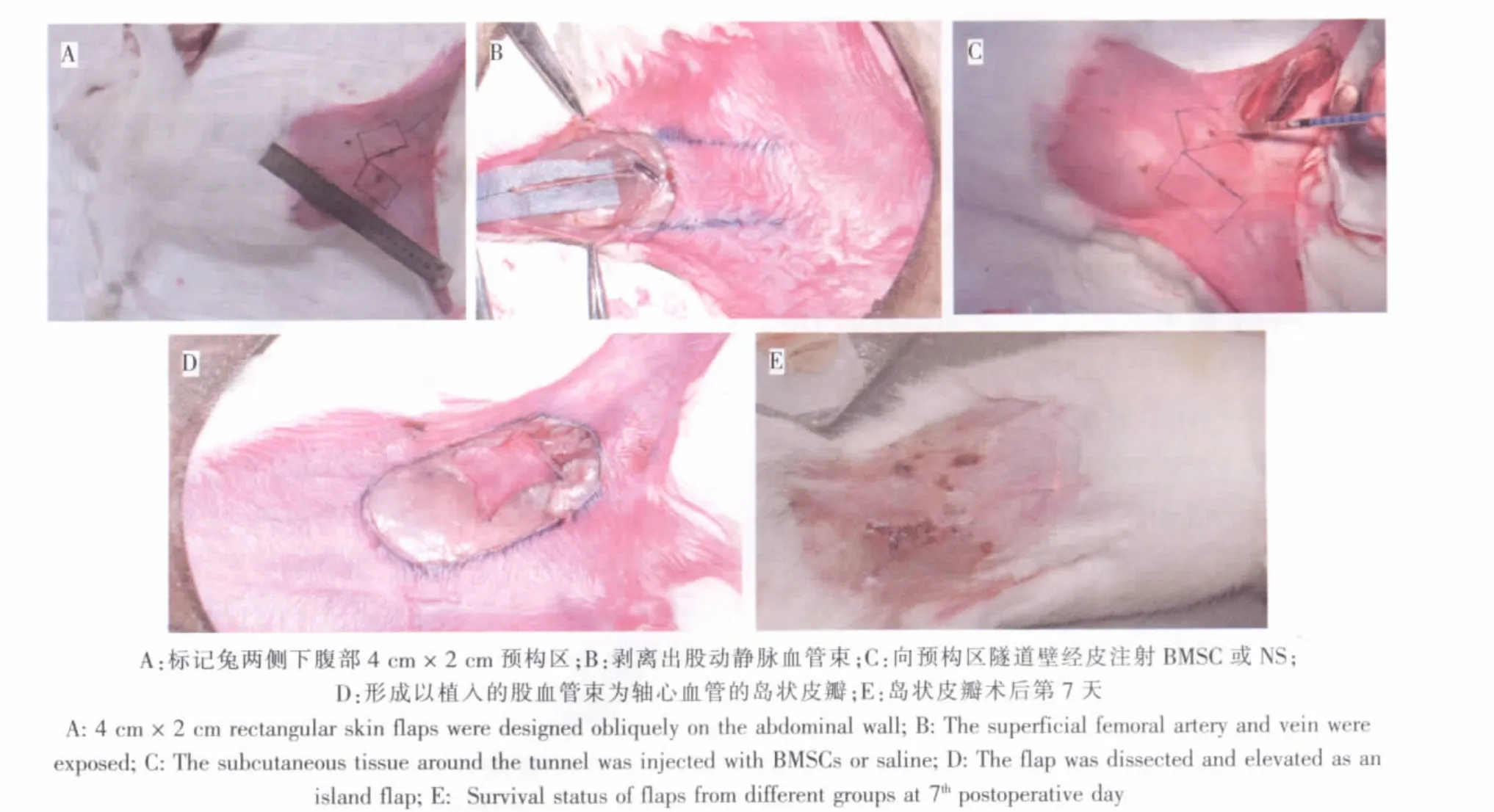
圖1 預構皮瓣模型制備Fig.1 The preparation of prefabricated flap model
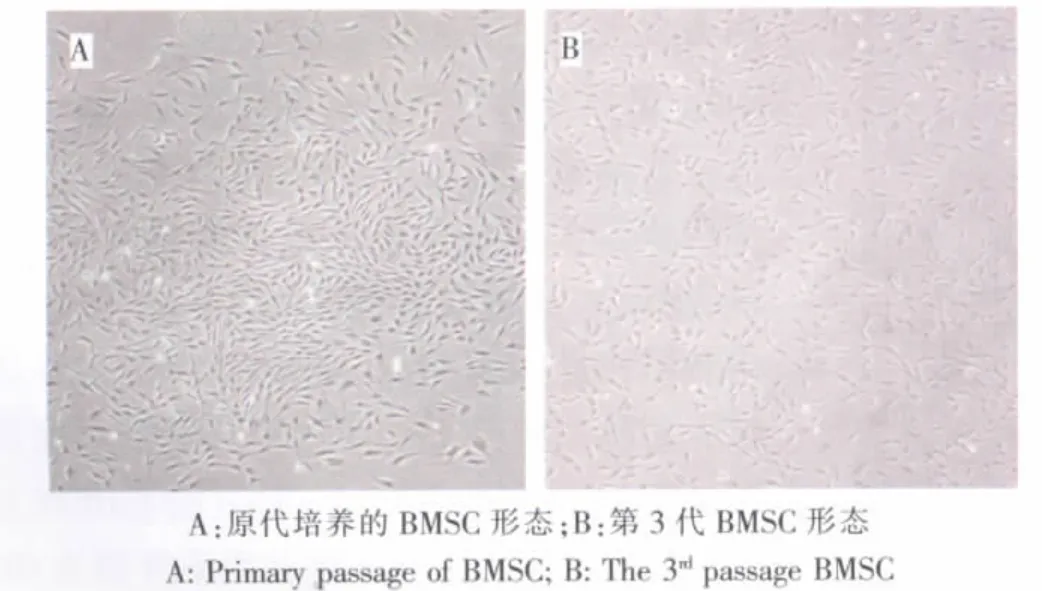
圖2 BMSC的形態學觀察(光鏡,200×)Fig.2 Morphology observationof BMSC (Light microscope,200×)
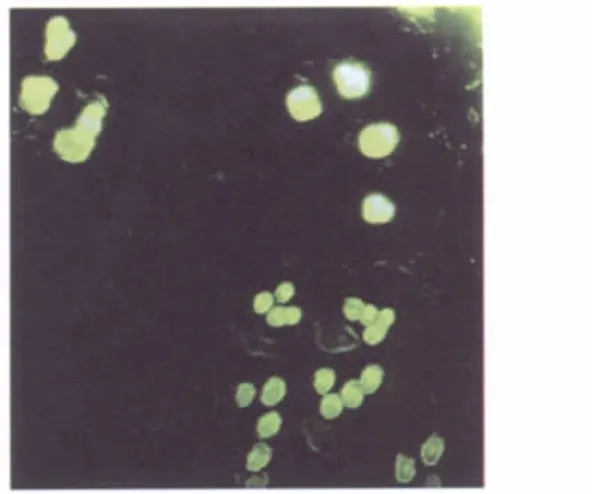
圖3 BMSC移植后第7天Fig.3 Morphology observation of BMSC on the 7thday after transplantation
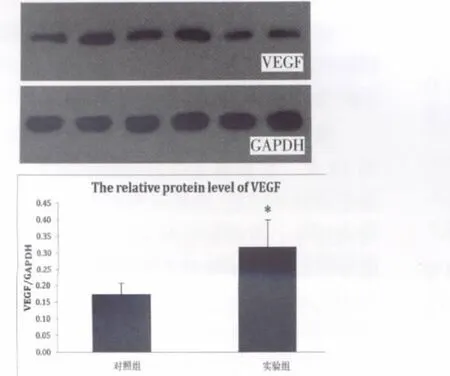
圖4 預構皮瓣內VEGF的Western Blot半定量測定(Line1、3、5 為對照組;Line2、4、6 為實驗組;*:P<0.05)Fig.4 Western Blot semi-quantitative analysis of VEGF protein levels from different groups.The mean VEGF level was higher in the flaps of BMSCs group when compared with control groups(P<0.05)
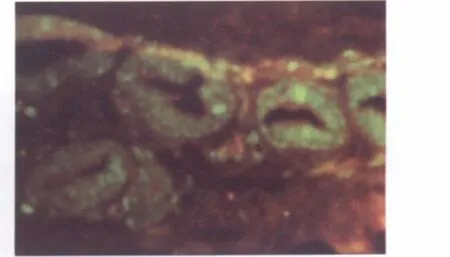
圖5 BrdU/VWF免疫雙標熒光染色(100×)Fig.5 The BrdU/vWF bone mesenchymal stem cells positive stain aggregate especially in flaps from experiment group at 14 days after transplantation
3 討論
預構皮瓣成功的關鍵是血管載體與預構區域之間建立起充分的血管連接,即血管再生。血管再生包括血管新生和血管生成兩個基本過程[6],前者是指內皮前體細胞分化為成內皮細胞,形成原始血管網的過程;后者是指從已存在的血管,以出芽方式長出新毛細血管的過程。過去曾認為血管新生只發生在胎兒期,近來發現成體內也有內皮前體細胞,即內皮祖細胞分化為血管內皮細胞的血管新生過程。因此,要促進預構皮瓣內的血管再生,就要增加局部內皮祖細胞的數量和促進已存在的血管出芽生長。許多研究表明,VEGF、bFGF、TGF-β等多肽類生長因子能明顯促進已存在的血管出芽生長,增加了預構皮瓣內的血管密度,從而提高了預構皮瓣的存活率[7-8]。但這些生長因子半衰期都很短,有潛在的副作用,療效有限[9-10]。近年來,干細胞的治療性血管再生作用引起了廣泛關注,其中BMSC因為因取材方便、可體外大量培養增殖、免疫原性低以及能分泌多種細胞因子等優點,而成為該領域的研究熱點。BMSC移植后不僅通過分化為相應的功能細胞發揮作用,而且還 可 以 分 泌 VEGF、IGF、EGF、KGF、TGF、Ang1、SDF1等多種細胞因子,共同促進血管生成,已有報道用BMSC來治療心肌缺血、外周缺血性疾病,以及促進缺血皮瓣的成活、創面愈合等,但用BMSC促進預構皮瓣的血管再生尚未見報道。因此,我們在本研究中探索了BMSC促進預構皮瓣成活的可行性。實驗顯示,實驗組島狀皮瓣的平均成活率明顯高于對照組,證實了BMSC同樣能促進預構皮瓣的成活。我們在形成島狀皮瓣時,肉眼觀察到實驗組股血管束周圍小血管明顯較對照組豐富,且所有皮瓣中均沒有發現植入的股血管束發生栓塞,所以對照組的島狀預構皮瓣較大范圍皮膚壞死只能是皮瓣中小血管再生不充分造成的。
本實驗中,通過對預構皮瓣中VEGF的Western Blot半定量分析發現,實驗組皮瓣組織內VEGF含量明顯高于對照組,說明BMSC懸液注射到預構皮瓣內,可增加皮瓣內VEGF的含量。我們也發現對照組皮瓣內有少量VEGF,可能是由于手術創傷引起皮瓣局部組織炎癥、缺氧而產生的少量內源性VEGF。
有報道發現,BMSC能在體內分化為血管內皮細胞[5,11]。我們通過免疫熒光雙標記檢測發現,實驗組皮瓣中的新生小血管管壁內密布胞核呈現綠色熒光,同時胞漿呈現紅色熒光的細胞,表明該細胞正是由BMSC分化而來的血管內皮細胞或血管內皮祖細胞。所以,BMSC不僅通過分泌促進血管出芽的VEGF等細胞因子發揮作用,同時還能通過分化為血管內皮系細胞,形成原始血管網的血管新生,共同促進預構皮瓣內的血管再生,促進預構皮瓣的成活。
本實驗移植的BMSC為同種異體,但術后第7天進行的冰凍切片追蹤觀察發現,移植到異體兔內的BMSC均勻分布于皮下,保持了良好的生物活性,體現了BMSC不被異體排斥的免疫特性,其機理被認為是BMSC表面只表達少量HLA2Ⅰ類抗原,不表達HLA2Ⅱ類抗原,以及通過旁分泌作用抑制B細胞和T細胞增殖,激活T細胞凋亡,從而形成免疫抑制。由于BMSC具有多種表面標記物,且尚未篩選到其獨有的標志分子,給鑒定帶來一定的困難,故我們選擇了 CD34、CD45、CD29、CD90 進行檢測[12]。
總之,本研究證明,BMSC異體移植能促進預構皮瓣的成活,但細胞懸液的最恰當濃度、用量、給藥途徑和給藥時點,以及促進血管再生的更深入機制等都還有待進一步研究。
[1]Hiasa K,Egashira K,Kitamoto S,et al.Bone marrow mononuclear cell therapy limits myocardial infarct size through vascular endothelial growth factor[J].Basic Res Cardiol,2004,99(3):165-172.
[2]Tse HF,Siu CW,Zhu SG,et al.Paracrine effects of direct intramyocardial implantation of bone marrow derived cells to enhance neovascularization in chronic ischaemic myocardium[J].Eur J Heart Fail,2007,9(8):747-753.
[3]Bonab MM,Alimoghaddam K,Talebian F,et al.Aging of mesenchymal stem cell in vitro[J].BMC Cell Biol,2006,7(1):14-21.
[4]Zheng Y,Yi C,Xia W,et al.Mesenchymal stem cells transduced by vascular endothelial growth factor gene for ischemic random skin flaps[J].Plast Reconstr Surg,2008,121(1):59-69.
[5]Fang LJ,Fu XB,Sun TZ,et al.An experimental study on the differentiation of bone marrow mesenchymal stem cells into vascular endothelial cells[J].Zhonghua Shao Shang Za Zhi,2003,19(1):22-24.
[6]Tepper OM,Galiano RD,Kalka C,et al.Endothelial progenitor cells:the promise of vascular stem cells for plastic surgery[J].Plast Reconstr Surg,2003,111(2):846-854.
[7]Zhang F,Fischer K,Komorowska-Timek E,et al.Improvement of skin paddle survival by application of vascular endothelial growth factor in a rat TRAM flap model[J].Ann Plast Surg,2001,46(3):314-319.
[8]Uhl E,Barker JH,Bondar I,et al.Improvement of skin flap perfusion by subdermal injection of recombinant human basic fibroblast growth factor[J].Ann Plast Surg,1994,32(4):361-365.
[9]Gurunluoglu R,Meirer R,Shafighi M,et al.Gene therapy with adenovirus-mediated VEGF enhances skin flap prefabrication[J].Microsurgery,2005,25(5):433-441.
[10]Haws MJ,Erdman D,Bayati S,et al.Basic fibroblast growth factor induced angiogenesis and prefabricated flap survival[J].J Reconstr Microsurg,2001,17(1):39-42.
[11]Planat-Benard V,Silvestre JS,Cousin B,et al.Plasticity of human adipose lineage cells toward endothelial cells:physiological and therapeutic perspectives[J].Circulation,2004,109(5):656-663.
[12]Dominici M,LeBlanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The international society for cellular therapy position statement[J].Cytotherapy,2006,8(4):315-317.

