PAMAM-D納米載體介導TFinAODN防治心肌缺血再灌注脂質過氧化損傷的實驗研究
李春海 宋 樹英 桑 翠玲 李 文慧 尹俊
心肌遭受缺血損傷后恢復血流灌注,反而加重心肌損傷,稱之為心肌缺血再灌注損傷。其表現為心肌水腫、氧利用能力下降、心肌收縮功能和細胞-容積調節作用減弱或喪失,心室順應性下降。常伴有水、鈉潴留,線粒體破碎,收縮帶壞死,細胞膜斷裂等。特別是細胞膜損傷后可致細胞內鈣超載,嚴重的線粒體肌漿網狀體內的鈣積聚,可導致細胞的最終死亡[1]。心肌缺血再灌注損傷的發生機制與局部的炎性反應和凝血系統的激活有密切關系。研究發現,組織因子(tissue factor,TF)在缺血再灌注損傷的發生過程中起關鍵作用[2]。因而減少TF的合成與釋放是防治缺血再灌注損傷的重要措施。本研究設計合成了針對大鼠TF的反義寡脫氧核苷酸(antisense oligodeoxynucleotide,AODN),利用聚酰胺-胺型樹枝狀高聚物 (polyamidoamine dendrimers,PAMAM-D)納米載體介導 AODN轉染至Lewis大鼠體內,觀察了AODN對大鼠心肌缺血再灌注過程中脂質過氧化損傷的作用。
1 材料與方法
1.1 大鼠TF寡脫氧核苷酸序列合成 參考 Nakamura等[3,4]的報道,設計大鼠TF寡脫氧核苷酸,由TaKaRa寶生物工程有限公司合成,序列如下:反義寡脫氧核苷酸(antisense oligodeoxynucleotide/TF,AS/TF):5’-CATGGGGATAGCCAT-3’(AODN);正義寡脫氧核苷酸(sense oligodeoxynucleotide/TF,S/TF):5’-ATGGCTATCCCCATG-3’(SODN對照);錯配寡脫氧核苷酸(scrambled oligodeoxynucleotide/TF,Sc/TF):5 ’-TGACGCAGAGAGTCGTA-3’(無關ODN對照)。將上述3種寡脫氧核苷酸按電荷比1∶10藕聯于G10代PAMAM-D納米載體[購自Aldrich Chemical公司(Tokyo,Japan)],構建 ODN-PAMAM-D 的聚合物。
1.2 動物分組 雄性 Lewis大鼠100只,體重230~280 g,隨機等分為5組:假手術組(n=20):每只動物經尾靜脈注入0.9%氯化鈉溶液1 ml。缺血再灌注組(n=20):每只動物經尾靜脈注入 PAMAM-D 12 mg/kg(溶于1ml 0.9%氯化鈉溶液)。AS/TF防治組(n=20):每只動物經尾靜脈注入AS/TFPAMAM-D 16 mg/kg(溶于1ml 0.9%氯化鈉溶液,相當于AS/TF 4 mg/kg)。S/TF對照組(n=20):每只動物經尾靜脈注入S/TF-PAMAM-D 16 mg/kg(溶于1 ml 0.9%氯化鈉溶液,相當于S/TF 4 mg/kg)。Sc/TF對照組(n=20):每只動物經尾靜脈注入Sc/TF-PAMAM-D 16 mg/kg(溶于1 ml 0.9%氯化鈉溶液,相當于Sc/TF 4 mg/kg)。
1.3 制備心肌缺血再灌注損傷的動物模型 5組大鼠完成上述注射后10 h腹腔注射20%烏拉坦溶液(1.0 g/kg)麻醉。開胸暴露心臟,除假手術組以外的其他4組大鼠于冠狀動脈左前降支中1/2處結扎造成心肌缺血,通過觀察肢體Ⅱ導聯心電圖確定心肌缺血是否復制成功。心肌缺血90 min后,解除結扎,再灌注3 h。假手術組的大鼠開胸暴露心臟后,于冠狀動脈左前降支中1/2處只穿線,不結扎,持續270 min。
1.4 標本取材及檢測 分別于缺血90 min和再灌注結束后取各組大鼠的腹主動脈血液,采用酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)檢測肌鈣蛋白T(troponin T,TnT),并檢測丙二醛(malonaldehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-PX)和乳酸脫氫酶(lactate dehydrogenase,LDH)的含量(檢測試劑盒均購自南京建成生物工程研究所,檢測方法按配套說明書進行)。將梗死區及邊緣區心肌組織剪下,一部分心肌組織用TRIzol提取RNA后,在1%瓊脂糖變性膠中進行RNA甲醛變性電泳后,將RNA轉移并固定于硝酸纖維素膜(nitrocellulose,NC膜)上,以標記有 α-32P dCTP的大鼠 TF cDNA作為探針進行Northern blot。經32P增感屏放射自顯影后,Molecular Imager FX system觀察結果,經Syngene圖像分析系統進行圖像掃描分析以確定各轉錄條帶的強弱。另一部分心肌組織提取蛋白質后,采用一凝血法檢測TF的促凝活性(tissue factor procoagulant activity,TF:C),采用 ELISA檢測 TF抗原(tissue factor antigen,TF:Ag)。心肌組織蛋白定量采用Lowry法。
1.5 統計學分析 應用SPSS 13.0統計軟件,進行完全隨機化設計資料的ANOVA方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 5組大鼠血液中TnT和LDH的檢測結果 心肌缺血90 min及再灌注3 h后,與假手術組相比各缺血再灌注組大鼠血液中的TnT和 LDH均顯著增多(P <0.05或 <0.01),而AS/TF防治組大鼠血液中的TnT和LDH則明顯低于其他3個缺血再灌注組(P <0.05)。見表1。
表1 5組大鼠血液中TnT和LDH比較 n=20,±s
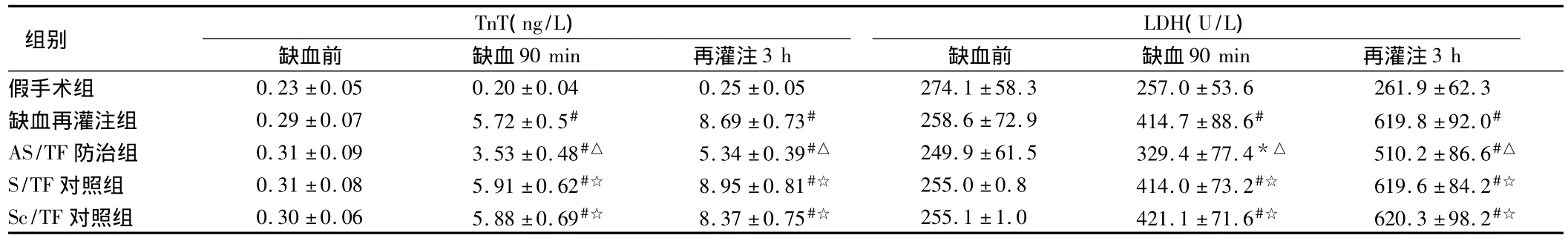
表1 5組大鼠血液中TnT和LDH比較 n=20,±s
2.2 5組大鼠血液中MDA的含量 心肌缺血90 min及再灌注3 h后,與假手術組相比5組大鼠血液中的MDA含量均明顯增加(P<0.05或 <0.01),而AS/TF防治組大鼠血液中的MDA含量則顯著低于其他3個缺血再灌注組(P<0.01)。見表2。
2.3 5組大鼠血液中SOD的含量 心肌缺血90 min及再灌注3 h后,與假手術組相比5組大鼠血液中的SOD含量均明顯減少(P <0.05或 <0.01),而 AS/TF防治組大鼠血液中的 SOD含量則顯著高于其他3個缺血再灌注組(P<0.05或 <0.01)。見表 3。
2.4 5組大鼠血液中GSH-PX的含量 心肌缺血90 min及再灌注3 h后,與假手術組相比5組大鼠血液中的GSH-PX含量均明顯減少(P <0.05或 <0.01),而AS/TF防治組大鼠血液中的GSHPX含量則顯著高于其他3個缺血再灌注組(P<0.05)。見表4。
表2 5組大鼠血液中MDA的含量n=20,nmol/ml,±s
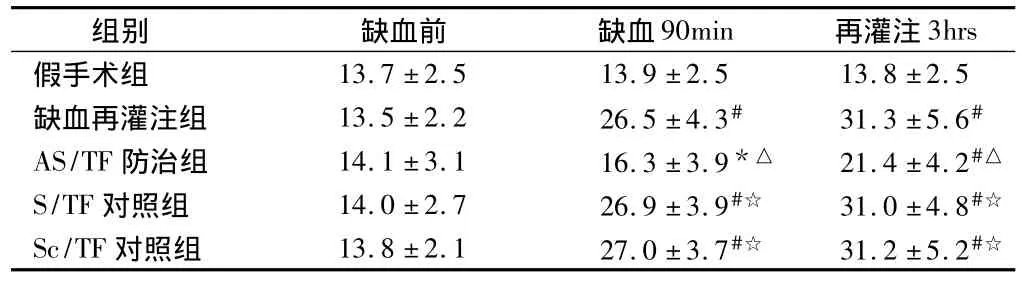
表2 5組大鼠血液中MDA的含量n=20,nmol/ml,±s
注:與假手術組比較,*P <0.05,#P <0.01;與缺血再灌注組比較,△P <0.01;與 AS/TF 防治組比較,☆P <0.01
組別 缺血前 缺血90min 再灌注3hrs假手術組13.7 ±2.5 13.9 ±2.5 13.8 ±2.5缺血再灌注組 13.5 ±2.2 26.5 ±4.3# 31.3 ±5.6#AS/TF 防治組 14.1±3.1 16.3±3.9*△ 21.4±4.2#△S/TF 對照組 14.0 ±2.7 26.9 ±3.9#☆ 31.0 ±4.8#☆Sc/TF 對照組 13.8±2.1 27.0±3.7#☆ 31.2±5.2#☆
表3 5組大鼠血液中SOD的含量n=20,U/ml,±s

表3 5組大鼠血液中SOD的含量n=20,U/ml,±s
表4 5組大鼠血液中GSH-PX的含量n=20,mol/ml,±s
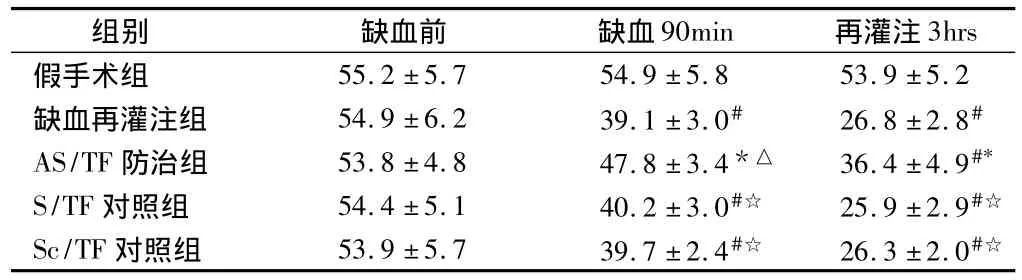
表4 5組大鼠血液中GSH-PX的含量n=20,mol/ml,±s
注:與假手術組比較,*P <0.05,#P <0.01;與缺血再灌注組比較,△P <0.05;與 AS/TF 防治組比較,☆P <0.05
組別 缺血前 缺血90min 再灌注3hrs假手術組55.2 ±5.7 54.9 ±5.8 53.9 ±5.2缺血再灌注組 54.9 ±6.2 39.1 ±3.0# 26.8 ±2.8#AS/TF 防治組 53.8±4.8 47.8±3.4*△ 36.4±4.9#*S/TF 對照組 54.4 ±5.1 40.2 ±3.0#☆ 25.9 ±2.9#☆Sc/TF 對照組 53.9±5.7 39.7±2.4#☆ 26.3±2.0#☆
2.5 5組TF基因的轉錄 Northern Blot檢測顯示,心肌缺血再灌注3 h后,缺血再灌注的4組大鼠梗死區及邊緣區心肌組織中的TF轉錄均強于假手術組,而AS/TF防治組大鼠梗死區及邊緣區心肌組織中的TF轉錄則較其他3個缺血再灌注組明顯減弱。見圖1。

圖1 5組TF基因的轉錄
2.6 5組大鼠心肌組織中TF的表達 缺血再灌注的各組大鼠梗死區及邊緣區心肌組織中的TF:C和TF:Ag水平均高于假手術組(P<0.01),而AS/TF防治組大鼠梗死區及邊緣區心肌組織中的TF:C和TF:Ag水平則明顯低于其他3個缺血再灌注組(P <0.01)。見表5。
表5 5組大鼠心肌組織中的TF:C(U/mg蛋白)和TF:Ag(ng/mg蛋白)n=20,±s

表5 5組大鼠心肌組織中的TF:C(U/mg蛋白)和TF:Ag(ng/mg蛋白)n=20,±s
注:與假手術組比較,*P <0.01;與缺血再灌注組比較,#P <0.01;與AS/TF防治組比較,△P <0.01
組別 TF:C(U/mg蛋白) TF:Ag(ng/mg蛋白)2.5 ±0.5 11.0 ±1.5缺血再灌注組 63.3 ±5.8* 95.4 ±5.6*AS/TF 防治組 33.2 ±3.1*# 46.7 ±3.2*#S/TF對照組 62.7±5.2*△ 93.3±5.2*△Sc/TF對照組 65.6±6.0*△ 96.3±6.0假手術組*△
3 討論
心肌缺血再灌注損傷是缺血性心臟病、冠狀動脈搭橋手術、心臟移植等諸多疾病或治療方法的重要病理生理過程,其發生機制與局部的凝血系統激活以及脂質過氧化損傷有著密切關系[5]。
心肌缺血后恢復血流灌注,缺血的組織重新供氧,可形成和激活一系列體液炎性介質,包括活性氧(超氧化物、氫氧自由基、過氧化氫等)、脂類介質[血小板活化因子(platelet active factor,PAF)、白三烯 B4(leukotriene B4,LTB4)]以及多肽類介質(補體C5A、細胞因子和黏附分子)等,從而引起炎性反應[6]。炎性反應可導致組織損傷,釋放TF[7]。TF又稱為凝血因子Ⅲ,主要存在于組織中的單核細胞和血管內皮細胞[8]。TF釋放是血栓形成的始動因素。炎性反應損傷組織后引起TF釋放,從而激活凝血系統,導致微循環內血栓形成,加重組織缺血缺氧[9]。
另一方面,心肌缺血再灌注過程中,血液流變學發生變化,使血液黏度增高和微循環內血流瘀滯,致使血管內皮細胞受損,也導致TF合成釋放增加,誘發微循環內血栓形成。由此可見,TF釋放在心肌缺血再灌注損傷的發生機制中起著關鍵作用。眾多的研究都表明,心肌缺血再灌注過程中,血漿和局部組織中的 TF 水平均顯著升高[10,11]。
鑒于TF在心肌缺血再灌注損傷過程中起著重要作用,那么將TF作為靶標,減少TF的合成與釋放是防治心肌缺血再灌注損傷的主要措施。近年來,隨著分子生物學技術的飛速發展,將AODN用于阻斷TF基因的轉錄及表達已有零星報道。AODN具有特異性強、安全性好、操作簡單、所需劑量小的優點[12]。Stephens等[13]在實驗中觀察到,TF 的 AODN 能夠顯著抑制人單核細胞TF基因的轉錄,并減輕由單核細胞釋放TF而引起的炎性反應。后來Nakamura等[3,4]都發現,大鼠TF的反義脫氧寡核苷酸能夠明顯減輕其肝、腎的缺血再灌注損傷,降低病死率。但是,Nakamura和Matsuyama都是將TF的反義脫氧寡核苷酸直接注射入大鼠體內,AODN的長度一般都在10~20個堿基,由于片段短,直接注射入體內很容易被補體系統及各種酶所降解,不能穩定地發揮作用,導致療效下降[14,15]。Lipofectamine能夠提高反義脫氧寡核苷酸的轉染效率,并延長其在體內的存在時間,但是它的毒性很大,因而限制了其在活體內的進一步應用[16]。
隨著生物技術以及物理、化學等學科的迅猛發展,將納米技術應用于醫藥學領域,開發納米級的分子作為基因轉移的載體用于攜帶AODN進行基因治療已經成為可能。PAMAM-D是一類新近開發出來的納米級基因轉移的載體。初步的研究結果表明,PAMAM-D能夠保護反義脫氧寡核苷酸不被血清或組織細胞中的補體及各種酶所破壞,而且效率明顯高于傳統的基因轉移載體 Lipofectamine[17]。PAMAM-D屬于非生物材料,沒有免疫原性,不會引起機體的免疫反應;并且沒有遺傳毒性與細胞毒性,不會導致宿主的細胞轉化和細胞死亡[18]。本實驗中我們應用針對TF的反義寡脫氧核苷酸藕聯于G10代PAMAM-D納米載體,再將這一藕聯物注射入大鼠體內,并結扎大鼠的冠狀動脈左前降支,復制心肌缺血再灌注損傷的模型后,發現針對TF的反義寡脫氧核苷酸不僅抑制了TF的轉錄和表達,而且減少了過氧化脂質產物MDA的產生,也因此降低了SOD和GSH-PX減少的幅度,減輕了過氧化損傷。TnT和LDH是標識心肌損傷的敏感指標,實驗中針對TF的AODN由于減輕了過氧化損傷,因而也改善了缺血再灌注損傷導致的TnT和LDH水平升高。因而PAMAM-D納米載體介導的TF反義寡脫氧核苷酸對大鼠心肌缺血再灌注損傷有明顯的防治作用。表明PAMAM-D納米載體介導的TF AODN通過拮抗TF,抑制心肌缺血再灌注損傷過程中的凝血系統激活,從而減輕大鼠心肌缺血再灌注過程中的脂質過氧化損傷,對心肌缺血再灌注損傷有明顯的保護作用。有關PAMAM-D納米載體介導的TF AODN防治心肌缺血再灌注過程中脂質過氧化損傷的信號轉導通路還有待于深入研究。
1 Borutaite V,Brown GC.Mitochondria in apoptosis of ischemic heart.FEBS Lett,2003,541:1-5.
2 Sevastos J,Kennedy SE,Davis DR,et al.Tissue factor deficiency and PAR-1 deficiency are protective against renal ischemia reperfusion injury.Blood,2007,109:577-583.
3 Nakamura K,Okamoto M,Akioka K,et al.Effect of antisense oligonucleotides for tissue factor on hepatic ischemia-reperfusion injury in the rat.Transplant Proc,2001,33:3707-3708.
4 Matsuyama M,Akioka K,Okamoto M,et al.The role of tissue factor in renal ischemic reperfusion injury by antisense oligodeoxynucleotide.Transplant Proc,2002,34:1475-1476.
5 Turer AT,Hill JA.Pathogenesis of myocardial ischemia-reperfusion injury and rationale for therapy.Am J Cardiol,2010,106:360-368.
6 Sun J,Li SH,Liu SM,et al.Improvement in cardiac function after bone marrow cell thearpy is associated with an increase in myocardial inflammation.Am J Physiol Heart Circ Physiol,2009,296:H43-50.
7 Carraway MS,Welty-Wolf KE,Miller DL,et al.Blockade of tissue factor:treatment for organ injury in established sepsis.Am J Respir Crit Care Med,2003,167:1200-1209.
8 Bryant AE,Hayes-Schroer SM,Stevens DL.M type 1 and 3 group A streptococci stimulate tissue factor-mediated procoagulant activity in human monocytes and endothelial cells.Infect Immun,2003,71:1903-1910.
9 Butenas S,Orfeo T,Mann KG.Tissue factor activity and function in blood coagulation.Thromb Res,2008,122:S42-46.
10 Chong AJ,Pohlman TH,Hampton CR,et al.Tissue factor and thrombin mediate myocardial ischemia-reperfusion injury.Ann Thorac Surg,2003,75:S649-655.
11 Murphy E,Steenbergen C.Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury.Physiol Rev,2008,88:581-609.
12 Phillips MI,Galli SM,Mehta JL.The potential role of antisense oligodeoxynucleotide therapy for cardiovascular disease.Drugs,2000,60:239-248.
13 Stephens AC,Ranlall NF,Rivers RP.Suppression of HUVEC tissue factor synthesis by antisense oligodeoxynucleotide.Thromb Res,2008,122:99-107.
14 Nakamura K,Kadotani Y,Ushigome H,et al.Antisense oligonucleotide for tissue factor inhibits hepatic ischemic reperfusion injury.Biochem Biophys Res Commun,2002,297:433-441.
15 Matsuyama M,Akioka K,Okamoto M,et al.Control of renal ischemic reperfusion injury by antisense oligodeoxynucleotide of tissue factor.Transplant Proc,2003,35:103-104.
16 Williams SA,Buzby JS.Cell-specific optimization of phosphorothioate antisense oligodeoxynucleotide delivery by cationic lipids.Methods Enzymol,2000,313:388-397.
17 Gebhart CL,Kabanov AV.Evaluation of polyplexes as gene transfer agents.J Control Release,2001,73:401-416.
18 Kihara F,Arima H,Tsutsumi T,et al.In Vitro and In Vivo Gene Transfer by an Optimized alpha-Cyclodextrin Conjugate with Polyamidoamine Dendrimer.Bioconjug Chem,2003,14:342-350.

