匹魯卡品癲癇模型慢性期大鼠海馬苔蘚纖維出芽的觀察
陳麗麗 黃 靚妹 詹 紅艷 曹亦賓
實驗動物模型是研究癲癇的重要手段。研究發現,腹腔注射匹魯卡品(pilocarpine,PILO)是誘導癲癇發作的一種簡單方便的動物模型[1,2]。PILO通過同時激動乙酰膽堿和谷氨酸受體導致大鼠癲癇發作。發作后可引起分為3個階段的行為和腦電圖變化:急性期:邊緣性癲癇持續狀態(status epilepsy,SE)可持續至24 h;靜止期:腦電圖(EEG)和行為基本正常,4~42 d;慢性自發性復發性發作(spontaneous recurrent seizures,SRS):類似于復雜部分性發作的患者,每只動物發作2~3次/周[3]。長期發作可引起類似人類顳葉癲癇的病理改變,如神經元缺失、膠質細胞增生、苔蘚纖維出芽等[4,5]。因此,該模型已作為理想的動物模型之一,用于癲癇的實驗研究。
1 材料與方法
1.1 實驗動物 健康雄性成年Wistra大鼠60只,體重200~250 g,由河北聯合大學動物實驗部提供。隨機分為2組,癲癇模型組(模型組)30只;0.9%氯化鈉溶液對照組(對照組)30只。均進行Nissl染色及Timm銀染。
1.2 藥品 PILO由美國SIGMA公司提供,硝酸銀由廣州市立新化工廠生產,戊巴比妥鈉由北京化工廠生產,焦油紫(Crestyl Violet)由美國SIGMA公司生產,氫醌由湖北大學化工廠生產。
1.3 動物模型制作 大鼠腹腔注射PILO 350 mg/kg,注入前30 min腹腔注入東莨宕堿1 mg/kg,以拮抗其外周膽堿能反應;注射后根據Racine[6]制定的標準判定是否有癲癇發作,并于實驗當天行EEG檢查。對照組大鼠腹腔注等量0.9%氯化鈉溶液,觀察有無癲癇發作,也于實驗當天行EEG檢查。Racine標準:0級無驚厥、Ⅰ級面部陣攣、Ⅱ級面部陣攣+節律點頭、Ⅲ級面部陣攣+節律點頭+前肢陣攣、Ⅳ級面部陣攣+節律點頭+前肢陣攣+后肢站立、Ⅴ級面部陣攣+節律點頭+前肢陣攣+后肢站立+跌倒。
1.4 灌注和取材 模型組及對照組用于Nissl染色的大鼠分別于給藥后3、7、10、30、60 d 灌注取材;用于 neo-Timm 染色的大鼠分別于 3、7、10、30、60 d 灌注取材。
1.5 Nissl染色 切片置于二甲苯中脫脂3 min后依次放入100%、95%、70%乙醇各3 min加水,蒸餾水漂洗3 min,0.1%Crestyl Violet染色10~20 s,鏡下觀察背景呈白色或無色;而后依次放入70%、95%、100%乙醇各1~2 min脫水,再移入二甲苯透明至少5~10 min后,中性樹膠封片;Olympus光學顯微鏡觀察,并拍照。半定量評估CA1、CA3、門區神經細胞丟失程度,評分標準[7]0:無損害;1:1% ~10%神經元缺失,伴輕度軸突變性;2:11% ~50%細胞缺失,伴相當多的纖維變性;3:超過50%的細胞缺失,伴密集延長的軸突變性。
1.6 Timm銀染 將50%阿拉伯膠60 ml檸檬酸緩沖液10 ml、5.6%氫醌 30 ml、17%硝酸銀 1.5 ml于暗室中混合均勻[8];暗室中將干燥切片浸入新鮮配制的孵育液后,置26℃水浴箱中孵育1 h以上后,傾去孵育液,流水沖洗15~20 min;切片干燥后,行Nissl復染(同前),中性樹膠封片;光鏡下行齒狀回顆粒上區Timm銀染苔蘚纖維出芽評分,評分標準[9]見表1。
1.7 統計學分析 應用SPSS 13.0統計軟件,每只大鼠的各項數據均采用盲法對每只動物的5張切片進行平均后產生,計量資料以±s表示,半定量評分比較采用秩和檢驗,P<0.05為差異有統計學意義。

表1 顆粒上區苔蘚纖維出芽Timm銀染顆粒評分標準
2 結果
2.1 動物行為學觀察及腦電圖 模型組:PILO給藥的30只大鼠中,1只死于癲癇持續狀態,其余大鼠均可觀察到邊緣性發作行為表現,即豎立、奔跑、濕狗樣抖動,繼發以面部自動癥如眨眼、咀嚼及點頭。按Racine標準,Ⅱ~Ⅲ級發作2只,Ⅳ~Ⅴ級發作26只,未發作1只,每次發作持續約40 s,連續5~24 h。給藥3 d后及60 d內行為表現呈慢性復發性癇性發作,Ⅱ~Ⅲ級,2~3次/周,表現為前腭陣攣、咀嚼,單肢陣攣等,每次持續約20~30 s。模型成功率為93%。Ⅳ級以上腦電圖均可見癲癇波(圖1)。對照組:腹腔注射0.9%氯化鈉溶液,30只大鼠未觀察到邊緣性發作行為表現及癲癇發作。
2.2 Nissl染色 正常大鼠CA3、CA1區有大量致密錐體細胞,齒狀回門區有中等量神經元。本研究對照組各區神經元未見丟失與變形,與正常大鼠無差別。PILO注射3 d后,CA3區錐體細胞大量缺失伴細胞變性,CA1區錐體細胞也開始缺失;7 d后,可以觀察到顆粒細胞發散并持續30 d,同時CA1區變性;30 d后,門區和CA1區可見大量膠質細胞增生;60 d時更明顯(圖2)。模型組各區神經元缺失情況。見表1。

表1 模型組海馬各區神經缺失程度評分比較 分(張)
2.3 Timm銀染 正常情況下,海馬苔蘚纖維(mossy-fibre,MF)終止于CA3區錐體層和門區神經元,并有大量Timm顆粒分布,齒狀回顆粒上區只有極少量Timm顆粒分布。本研究所有對照組大鼠切片顆粒上區均未見苔蘚纖維著色,也未見Zn2+標記的苔蘚纖維末梢增加(圖3)。模型組PILO注射10 d后,多數大鼠門區觀察到富含Zn2+的苔蘚纖維并伸向CA3區,并可見單獨的苔蘚纖維穿過顆粒細胞后進入內分子層,但與同期對照組染色無差別;30 d后幾乎所有大鼠內分子層均見富含Zn2+的苔蘚纖維末梢;60 d后,苔蘚纖維出芽非常明顯,內分子層可清楚地看到含Zn2+末梢并形成異常帶,分子層外2/3未見Timm顆粒帶形成(圖4)。模型組與對照組苔蘚纖維出芽Timm銀染顆粒評分比較,差異有統計學意義(u=-3.365,P<0.05)。見表2。
3 討論
3.1 神經元丟失 正常海馬結構中CA1和CA3區主神經元為錐體細胞,齒狀回主神經細胞為顆粒細胞,門區主神經元為中間神經元。從CA1經CA3至門區,神經元形態和電生理特點呈連續變化過程,細胞自發放電增加,抑制性中間神經元的作用逐漸減弱。而齒狀回顆粒細胞則不同,生理條件下齒狀回具有防止癲癇樣電活動在海馬網絡中的發生的作用。大量實驗證明成年動物癲癇持續狀態可引起海馬CA1、CA3區和齒狀回門區神經元的丟失,齒狀回顆粒上區和CA1區錐體下層顆粒細胞軸突(苔蘚纖維)外生(出芽)[10,11]。本研究觀察了大鼠腹腔注射PILO后海馬各區神經元的丟失情況。結果表明齒狀回門區神經元、CA3錐體細胞大量丟失伴膠體細胞增生,CA1區錐體細胞少量丟失伴輕度變性及顆粒細胞發散,該結果與Cllifford等[4]研究基本一致。研究認為,海馬CA1區和齒狀回富含膽堿受體,CA3區和門區富含谷氨酸能受體,而癲癇發作后神經元丟失最嚴重的卻是CA3區,其次是門區。神經元丟失可能是通過特異性遞質受體(谷氨酸受體)介導,因為谷氨酸可引起神經元樹突的腫脹,神經細胞體的水腫及變性。

表2 苔蘚纖維出芽Timm銀染顆粒評分 分(張)

圖1 癲癇模型組腦電圖
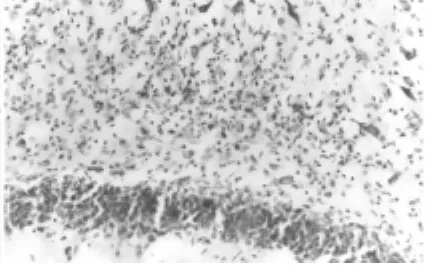
圖2 PILO注射60 d門區神經元缺失伴膠質細胞增生
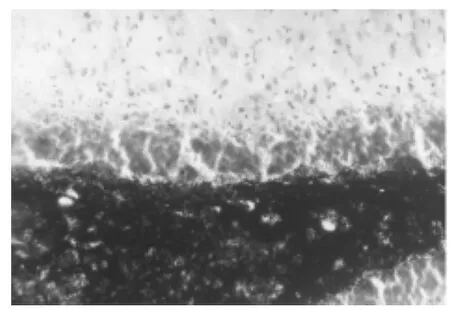
圖3 癲癇對照組顆粒上區Timm銀染
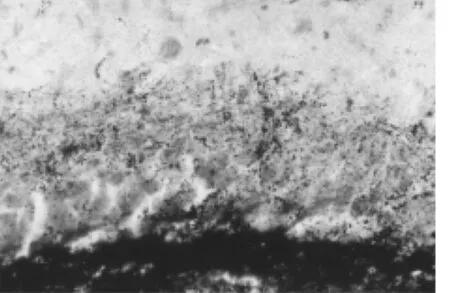
圖4 PILO注射60 d顆粒上區Timm銀染
3.2 苔蘚纖維出芽 正常齒狀回苔蘚纖維起自顆粒細胞層,進入門區,其分支形成密集的網絡。門區的軸突就近傳至CA3區,終止于腔隙層而形成纖維束,在Timm銀染時表現為Timm顆粒。光鏡下見到的Timm顆粒已由電鏡證實位于超微結構的突觸末端[8]。苔蘚纖維出芽是指在內分子層形成的神經可塑性改變,在切片上可見表現為Timm銀染著色區的改變。齒狀回內分子層苔蘚纖維出芽是顳葉癲癇患者和顳葉癲癇動物模型一種重要的神經可塑性變化[12]。本實驗中,PILO注射后10 d,可見單獨的苔蘚纖維穿過顆粒細胞層進入內分子層;30 d后,幾乎所有大鼠內分子層均見富含Zn2+的苔蘚纖維末梢;60 d后,在內1/3分子層形成異常帶。切片上表現為Timm銀染著色區域的變化,由苔蘚纖維出芽和突觸重建產生。Tang等[13]研究表明,齒狀回門區苔蘚細胞的丟失與苔蘚纖維出芽有關,齒狀回門區神經元是一組對興奮性毒性易損性神經元,由不同的神經元群組成,其中最主要的是苔蘚細胞,苔蘚細胞死亡,使得內分子層顆粒細胞樹突的突觸后位點空隙,刺激了苔蘚纖維并形成新的興奮突觸環路,該環路產生正反饋而引起自發性癲癇發作。進一步研究發現,在PILO模型中,神經元丟失、癲癇持續狀態、苔蘚纖維出芽的密度和自發性癲癇發作的頻率有明確的相關性[14]。更進一步研究結果表明,中度海馬苔蘚(MF)出芽可由未產生神經元損害的短期發作引起,而紅藻氨酸(KA)或點燃模型中見到的嚴重苔蘚纖維出芽可能是由長期的發作活動和神經元缺失共同產生。
綜上可見,腹腔注射匹魯卡品簡單復制了人類癲癇的基本病理特征,是研究癲癇的一種簡便方法。
1 Turski WA,Cavalheiro EA,Schwarzi M,et al.Limbic seizures produced by pilocarpine in rats:behavioral electroencephalographic and neuripathological study.Behav Brain Res,1983,9:315-335.
2 Blumcke L,Becker AJ,Klein C,et al.Temporal lobe epilepsy associated up-regulation of metabotropic glutamate receptors:correlated changes in mGluR1 mRNA and protein expression in experimental animals and human patienets.J Neuropathol Exp Neurol,2000,59:1-10.
3 Olney JW,de Gubareff T,Labruyere J,et al.Seizure-related brain damage induced by cholinergic agents.Nature,1983,301:520-522.
4 Clifford DB,Olney JW,Maniotis A,et al.The functional anatomy and pathology of lithium-pilocarpine and high-dose pilocarpine seizures.Neurosci,1987,23:953-968.
5 Badawy RA,Harvey AS,Macdonell RA.Cortical hyperexcitability and epileptogenesis:understanding the mechanisms of epilepsy-part 2.J Clin Neurosci,2009,16:485-500.
6 Racine RJ.Modification of seizure activity by electrical stimulation ⅡMotor Seizure.Electroencephaologr Clin Neurophysiol,1972,32:781-794.
7 Watson C,Cendes F,Fuerst D,et al.Specificify of volumetric magnetic resonance imaging in detecting hippocampal sclerosis.Arch Neurol,1997,54:67-73.
8 Danscher G.The autometallographic zinc-sulphide method.A new approach involving in vivo creation of nanometer-sized zinc sulphide crystal lattices in zinc-enriched synaptic and secretory vesicles.Histochem J,1996,28:361-373.
9 Vaidya VA,Siuciak JA,Du F,et al.Hippocampal mossy fiber sprouting induced by chronic electroconvulsive seizure.Neuroscience,1999,89:157-166.
10 Hanaya R,Sasa M,Sugata S,et al.Hippocampal cell loss and propagation of abnormal discharges accompanied with the expression of tonic convulsion in the spontaneously epileptic rat.Brain Res,2010,1328:171-180.
11 Shibley H,Smith BN.Pilocarpine-induced status epilepticus results in mossy fiber sprouting and spontaneous seizures in C57BL/6 and CD-1 mice.Epilepsy Res,2002,49:109-120.
12 Ribak CE,Tran PH,Spigelman L,et al.Status epilepticus-induced hilar basal dendrites on rodent granule cells contribute to recurrent excitatory circuitry.J Comp Neurol,2000,428:240-253.
13 Tang FR,Chia SC,Chen PM,et al.Matabotropic glutamate receptor 2/3 in the hippocampus of patients with mesiel temporal lobe epilepsy,and of rats and mice after pilocarpine-iduced status epilepticus.Epilepsy Res,2004,59:167-180.
14 Lemos T,Cavalheiro EA.Suppression of pilocapine-induced status epilepticus and the late development of epilepsy in rats.Exp Brain Res,1995,102:423-428.

