復方首烏藤合劑微生物限度檢查的驗證
張 婷,鄭紹忠,劉全芳
解放軍第一七五醫院(廈門大學附屬東南醫院)藥劑科,福建 漳州 363000
微生物限度檢查是藥品安全性檢查的重要項目,目前在國外也越來越受到重視,每版藥典收載的品種也越來越多。復方首烏藤合劑是我院自制的中成藥口服液,有滋陰清肝、清心安神作用,主要用于神經衰弱性失眠、眩暈及腦外傷性頭痛、頭昏等。《中國藥典》2010年版規定建立微生物限度檢查法時,應對該方法進行驗證,以確定該方法的可行性。筆者依據《中國藥典》2010年版二部附錄[1]對該品種進行了菌落計數和控制菌檢查方法的驗證[2]。
1 儀器與試藥
1.1 儀器
DG-2B多功能恒溫箱(上海醫療器械廠);HWS-400型恒溫恒濕箱(上海精宏實驗設備有限公司);LDZX-40SCI型立式自動電熱壓力蒸汽滅菌器(上海申安醫療器械廠);101-2A型數顯式電熱恒溫干燥箱(上海陽光實驗儀器有限公司)。
1.2 藥品
復方首烏藤合劑(解放軍第一七五醫院制劑室,40 ml/瓶,批號:100609、100623、100721)。
1.3 試驗用菌株
大腸埃希菌(escherichia coli)[CMCC(B)44102]、金黃色葡萄球菌(staphylococcus aureus)[CMCC(B)26003]、枯草芽孢桿菌(bacillus subtilis)[CMCC(B)63501]、黑曲霉(aspergillus niger)[CMCC(F)98003]和白色念珠菌(candida albicans)[CMCC(F)98001],以上菌種均購于廈門市藥品檢驗所,金黃色葡萄球菌為第三代,大腸埃希菌為第二代,其余菌均為第四代。
1.4 培養基
營養瓊脂培養基、玫瑰紅鈉瓊脂培養基、營養肉湯培養基、改良馬丁瓊脂培養基、膽鹽乳糖培養基、MUG培養基,以上培養基均購于廣東環凱微生物科技有限公司。
1.5 稀釋液
pH 7.0氯化鈉-蛋白胨緩沖液,購于廣東環凱微生物科技有限公司。
2 方法與結果
2.1 菌落計數方法的驗證[3]
2.1.1 供試液的制備
用pH 7.0的無菌氯化鈉-蛋白胨緩沖液將復方首烏藤合劑稀釋成為1∶10的供試液,充分混勻備用。
2.1.2 菌液制備
2.1.2.1 取大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌的新鮮培養物用接種棒接種至營養肉湯培養基中,于(35±1)℃培養 18~24 h。
2.1.2.2 取白色念珠菌的新鮮培養物用接種棒接種至改良馬丁瓊脂培養基中,于(25±1)℃培養 24~48 h;
上述培養物均用滅菌生理鹽水制成每毫升含菌數小于100 cfu的菌懸液,做活菌計數用。
2.1.2.3 取黑曲霉新鮮培養物接種至改良馬丁瓊脂斜面培養基中,于(25±1)℃培養 5~7 d,使黑色的霉菌孢子大部分覆蓋培養基斜面為宜,加入5 ml含0.05%(ml/ml)聚山梨酯-80的滅菌生理鹽水并輕輕振搖洗脫下霉菌孢子,過濾孢子懸液至無菌試管內,用含0.05%(ml/ml)聚山梨酯-80的滅菌生理鹽水制成每毫升含菌數小于100 cfu的菌懸液,做活菌計數用。
2.1.3 菌落計數方法的驗證操作
試驗組:分別吸取上述制備好的1∶10供試液1 ml注入平皿中,再分別加入上述制備好的的5種菌的菌懸液各1 ml,每種菌平行制備2份,立即傾注營養瓊脂培養基或玫瑰紅鈉瓊脂培養基。
供試品對照組:分別吸取上述制備好的1∶10供試液1 ml注入平皿中,立即傾注營養瓊脂培養基或玫瑰紅鈉瓊脂培養基,每種培養基平行制備2份,以測定供試品的本底菌數。
菌液組:取上述制備好的5種菌的菌懸液1 ml注入平皿內,每種菌平行制備2份,立即傾注營養瓊脂培養基或玫瑰紅鈉瓊脂培養基,測定所加的試驗菌數,并計算回收率。回收率公式為回收率(%)=(試驗組菌落計數-供試品對照組菌落計數)/菌液組菌落計數×100%。
以上營養瓊脂培養基置30~35℃培養48 h,玫瑰紅鈉瓊脂培養基置23~28℃培養72 h,結果見表1。
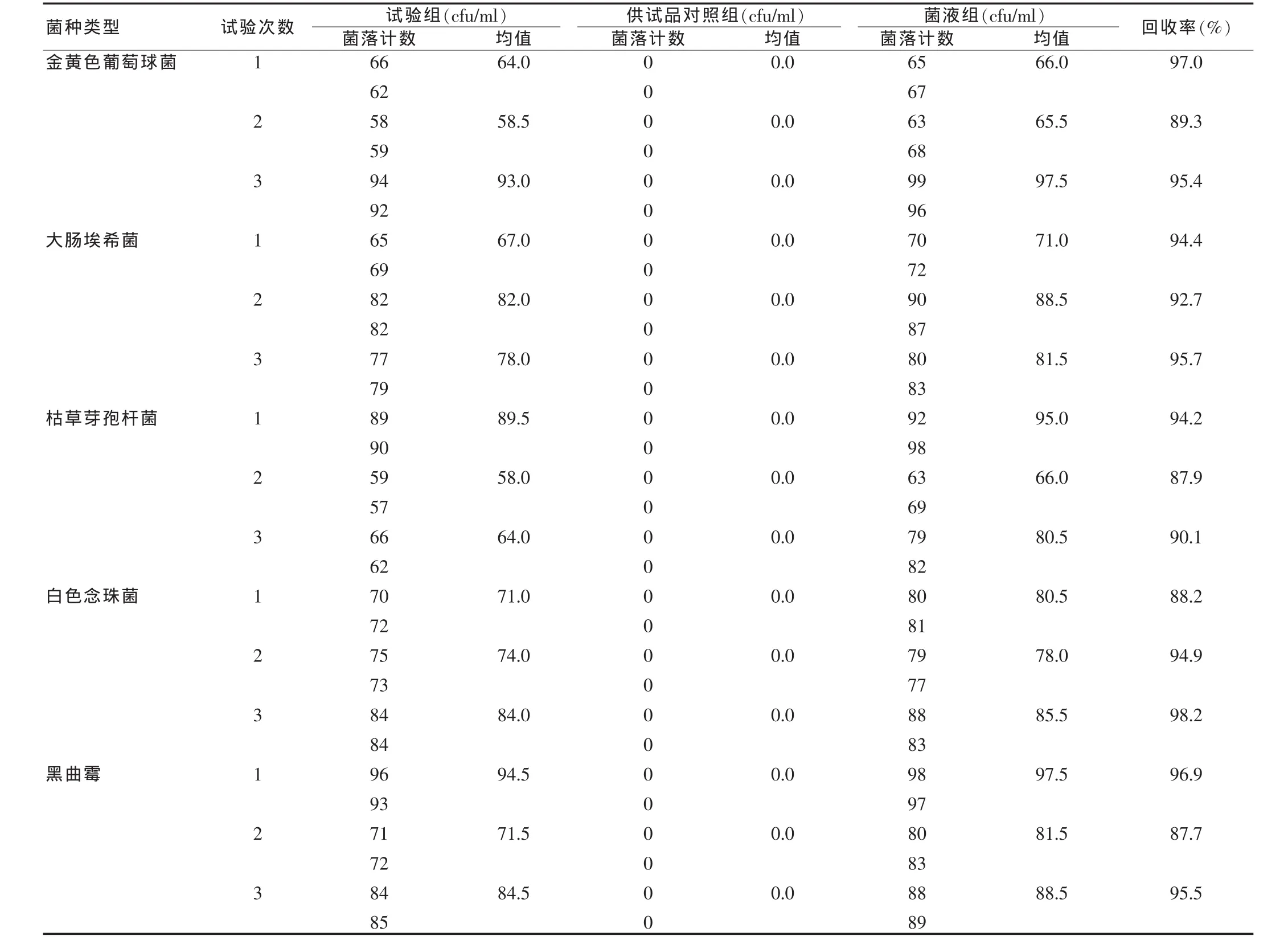
表1 各試驗菌株的回收率
由表1可見,筆者對復方首烏藤合劑采用平皿法,經過3次平行試驗,5種菌的回收率均大于70%。故本品的細菌、霉菌、酵母菌數的測定可依據《中國藥典》2010年版直接取樣采用常規法。
2.2 控制菌檢驗方法的驗證[4]
2.2.1 陽性試驗組
取上述1∶10供試液10 ml加至100 ml膽鹽乳糖培養基中,再加入10~100 cfu的大腸埃希菌,依相應控制菌檢查方法進行檢查。
2.2.2 陰性菌對照組
方法同試驗組,陰性對照菌采用金黃色葡萄球菌,依相應控制菌檢查方法進行檢查。見表2。

表2 控制菌的方法驗證結果
從表2可以看出,采用常規法檢驗復方首烏藤合劑的控制菌,陽性試驗組呈陽性反應,陰性菌對照組呈陰性反應,故可用該法進行復方首烏藤合劑控制菌的檢查。
3 討論
驗證試驗結果表明復方首烏藤合劑無抑菌作用,可依據《中國藥典》2010年版按常規方法進行微生物限度檢查。
筆者發現,復方首烏藤合劑靜置一段時間后會生成沉淀,在試驗時,應充分搖勻,使其分散均勻,且本品雖進行了10倍稀釋,但顏色依然較深,在光線較暗的環境下進行菌落計數時不容易分辨菌落,因此應在光源充足的環境下進行菌落計數,對疑似菌須進行菌落培養,確定其是否為菌,以免發生漏數、少數現象,造成試驗結果不準確。
菌落數的控制在小于100 cfu/ml是試驗過程的一大難點,是一項較耗時的操作過程,通常需要多次實踐才能夠得到符合要求的菌落數。菌落的生長繁殖能力極其旺盛,呈指數級別遞增,因此,在用接種棒接種至相應培養基進行增菌,并進行稀釋這個過程的重現性很差,很難在同一個稀釋級得到相同數目的菌落數,筆者通過多次試驗,并查閱相關資料,發現可將細菌稀釋至10-6(真菌稀釋至10-5),并在其附近選取稀釋至10-5~10-7(真菌選取10-4~10-6)的菌懸液,每個稀釋級取1.0 ml與0.5 ml同步試驗,可大大提高菌落數在100 cfu/ml的范圍,減少一些繁瑣且不必要的操作。
[1]國家藥典委員會.中國藥典[S].二部.北京:中國醫藥科技出版社,2010:附錄93.
[2]呂毅.麻杏止咳糖漿的微生物限度檢查[J].華西藥學雜志,2009,24(1):102-103.
[3]楊靜,陳偉,馬寧,等.抗腦衰膠囊微生物限度檢查方法學驗證[J].醫學理論與實踐,2009,22(1):116-117.
[4]李智勤,路東旭,李金龍.消痛貼膏微生物限度檢查方法的建立[J].時珍國醫國藥,2009,20(2):464-465.

