TIZ基因mRNA在卵巢癌細胞系中的表達及其RNA干擾載體構建
趙冰冰 張 瑋 李 力 陽志軍
2002年,Shin等[1]應用酵母雙雜交系統和谷胱甘肽轉移酶(glutathione transferase,GST)融合蛋白技術發現了一種C2H2型鋅指蛋白,該蛋白可以與腫瘤壞死因子相關因子-6(tumor necrosis factor receptor-associated factor-6,TRAF-6)結合并對TRAF-6起抑制作用,因此將此鋅指蛋白命名為TIZ(TRAF-6 inhibitory znic finger protein)。本課題組前期研究發現TIZ蛋白在卵巢癌血清中表達率較卵巢良性患者和正常卵巢患者高,有可能作為卵巢癌診斷的標志物[2],但對于TIZ基因與卵巢癌的關系知之甚少。因此,本實驗采用RT-PCR方法檢測不同卵巢癌細胞株TIZ基因mRNA的表達水平,設計并篩選干擾效率較高的siRNA干擾片段構建RNAi載體,為進一步研究TIZ基因對卵巢癌細胞生物學功能的影響打下了基礎。
1 材料和方法
1.1 材料
卵巢上皮癌鉑類敏感細胞系A2780、SKOV3和卵巢上皮癌鉑類耐藥細胞系A2780/DDP、A2780/CBP、SKOV3/DDP和 SKOV3/CBP(均為本試驗室保存)[2]。Taq 酶購自 TAKARA 公司,Syber Green I購自上海捷瑞公司,質粒提取試劑盒購自三博遠志公司。pTG19-T載體克隆載體購自上海捷瑞公司,pGPU6/GFP/Neo干擾載體購自吉瑪公司,LipofectamineTM2000購自 Invitrogen公司,Biospin Gel Extraction Kit膠回收試劑盒由Bioflux公司提供,DH-5α菌株為本試驗室保存。
1.2 實驗方法
1.2.1 不同卵巢癌細胞系中TIZ基因表達的測定采用RT-PCR方法。引物設計:根據人類TIZ基因的mRNA序列設計RT-PCR引物,TIZ基因引物序列如下:TIZ基因上游引物:5'-CTGCCACATTCTTTACATTTG-3,下游引物:5'-GTTGCACAAGGGAGGTTAT-3,引物擴增片段為213bp。內參基因β-actin上游引物:5'-GATGACCCAGATCATGTTTG-3,下游引物 antisense:5'-TGGAGTTGAAGGTAGTTTCG-3,引物擴增片段為491bp,引物均由上海生物公司合成。細胞RNA提取采用Trizol一步法提取卵巢組織RNA,cDNA的合成采用RT逆轉錄試劑盒(TOYOBO公司提供,MMLV逆轉錄酶由Promega公司提供),實驗操作按說明書進行。PCR反應條件:預變性94℃ 5min,變性94℃ 30s,復性57℃ 30s、延伸72℃ 30s,進行 32 個循環后進一步延伸72℃ 10min。取10μl PCR產物于1.5%的瓊脂糖凝膠電泳。
1.2.2 siRNA的設計與合成 根據Genebank上TIZ基因的mRNA序列設計5對siRNA并送上海吉瑪公司合成,其序列如下:

1.2.3 TIZ-siRNA干擾片段細胞內介導 采用脂質體方法。選擇對數生長期的細胞進行胰酶消化、吹打均勻和細胞計數,每個10cm2的培養瓶中種入約400 000個細胞,加入不含抗生素的1640培養液,于5%CO2、37℃培養箱培養24h;顯微鏡下觀察細胞鋪滿率達到80%~90%,即進行轉染;按每瓶 24μl(4.0μg)的DNA加入無抗生素、無血清1640培養基226μl,經混勻后室溫孵育5min;按每瓶10μl Lipofectin TM2000 1640培養基240μl經混勻后室溫孵育5min;將上述經過孵育的兩種不同混合液混合后室溫孵育20min,將混合液加到細胞中;培養6h后棄混合液,加入含雙倍血清的1640培養基,5%CO2、37℃培養箱培養24h;24h后更換正常的培養基,繼續培養24~48h進行后續實驗。
1.2.4 TIZ和β-actint mRNA表達標準品的制備 TIZ和 β-actint mRNA表達標準品制備采用pTG19-T重組質粒。TIZ和β-actint mRNA表達PCR反應體系和反應條件同前。PCR產物1.5%瓊脂糖凝膠電泳后凝膠成像分析系統觀察。PCR產物采用為Bioflux公司提供的Biospin Gel Extraction Kit膠回收試劑盒回收純化,并與pTG19-T質粒載體連接,16℃反應過夜后將連接產物轉化至大腸桿菌DH-5α制備的感受態,從37℃培養16~20h的DH-5α含氨芐抗性平皿中挑取陽性克隆,單克隆在LB培養液中37℃震蕩培養16~20h后進行質粒DNA的快速提取,PCR鑒定重組質粒送生音公司測序,并在NCBI進行BLAST結果序列對比分析,顯示與TIZ和β-actint基因的同源性達到100%。陽性標準品的制備,采用分光光度計進行重組基因質粒cDNA濃度測定并換算為拷貝濃度(copies/μl),制備拷貝數依次相差10倍的標準品,即 109、108、107、106、105、104、103個/μl等。
1.2.5 TIZ-siRNA干擾片段細胞內介導前后細胞系TIZ mRNA表達的測定 采用實時熒光定量PCR法(QRT-PCR)。將5種siRNA干擾片段轉染SKOV3細胞后48h提取細胞總mRNA、逆轉錄成cDNA,分別進行QRT-PCR擴增。采用8連管平行建立QRT-PCR反應體系,實驗設細胞樣品擴增目的基因TIZ和βactint各3管,同時標準品擴增目的基因TIZ和β-actint各2管和每空白對照(不含模板的反應體系)各1管,3組在熒光定量PCR儀上同時進行擴增。反應體系同前,反應條件:95℃預變性 2min,95℃ 30s,56℃30s,72℃ 40s,共 40 個循環,讀板 2sec,72℃ 10min,4℃保存。PCR擴增產物定量PCR儀自行數據分析,給出各個樣品的Ct值與SQ值(starting quantitiy)。結果判斷:以質粒標準品的拷貝數對數為橫坐標,以Ct值為縱坐標,建立標準曲線,根據樣品的Ct值,讀取標準曲線中對應的起始拷貝數,以此對每個樣品cDNA進行定量分析。定量結果以SQ值表示。為了消除每個樣品反應時cDNA量的不同,根據公式F:TIZ基因平均SQ值/β-actint基因平均SQ值來進行校正,并獲得到各細胞TIZ基因的相對表達量。根據公式:基因沉寞率=(1-實驗組/對照組)×100%,計算出各細胞TIZ基因沉寞率,以選擇干擾效率最高的siRNA片段構建shRNA載體。
1.2.6 TIZsiRNA重組表達載體的構建 采用pGPU6/GFP/Neo載體,將其酶切。并用1.0%低熔點瓊脂糖進行電泳。利用膠回收試劑盒回收酶切產物。采用T4 DNA連結酶將純化后載體與退火的TIZ-573 siRNA、陽性和陰性進行對照siRNA雙鏈插入片段進行連接。并將含有αsiRNA片段質粒的DNA轉化感受態大腸桿菌TOP10后,37℃恒溫箱中平皿倒置培養16~20h過夜。然后在平皿挑選氨芐抗性克隆,分別接種于3ml LB(含 Amp100μg/ml)液體培養基中,37℃振蕩培養過夜。采用Plasmid Mini Kit高純質粒提取試劑盒小量提取質粒。將重組質粒送上海生物公司測序。
1.2.7 數據處理 應用SPSS13.0統計學軟件進行數據分析。數據用表示,組間比較用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各卵巢癌細胞系中TIZ基因mRNA表達情況
RT-PCR檢測結果顯示,卵巢癌細胞HO8910細胞無TIZ基因mRNA表達,SKOV3、SKOV3順鉑耐藥、SKOV3卡鉑耐藥、A2780、A2780卡鉑耐藥細胞株等均有TIZ基因mRNA表達。結果見圖1。
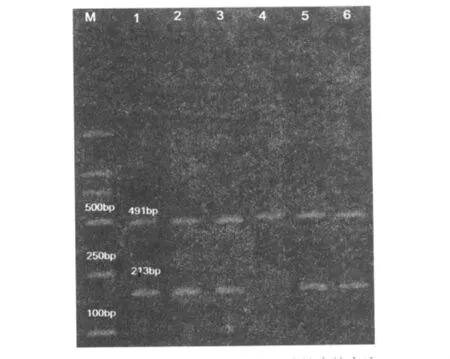
圖1 TIZ基因在不同卵巢癌細胞株中的表達
2.2 實時熒光定量PCR檢測TIZ和β-actin mRNA的標準曲線與融解曲線的建立
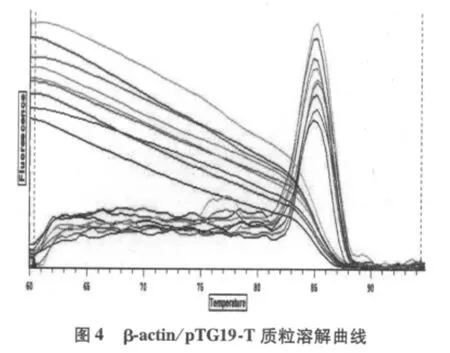
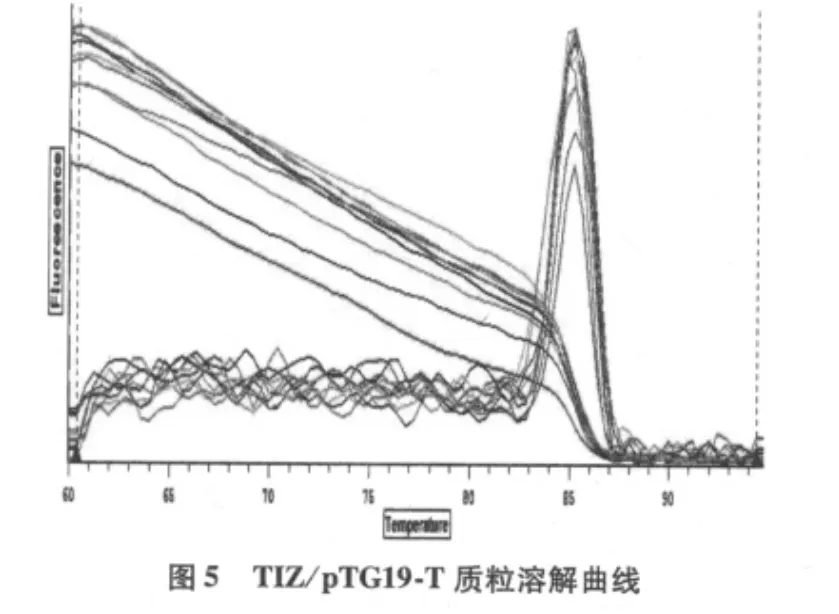
由圖2、圖3可見,TIZ和β-actin基因標準曲線相關系數分別為0.998和0.991,表明曲線線性關系良好,用于分析樣品表達量的結果可信。融解曲線圖顯示基因擴增成單峰,無雜峰,TIZ峰值位于84.5℃,βactin H峰值位于84.8℃(圖4、5)。
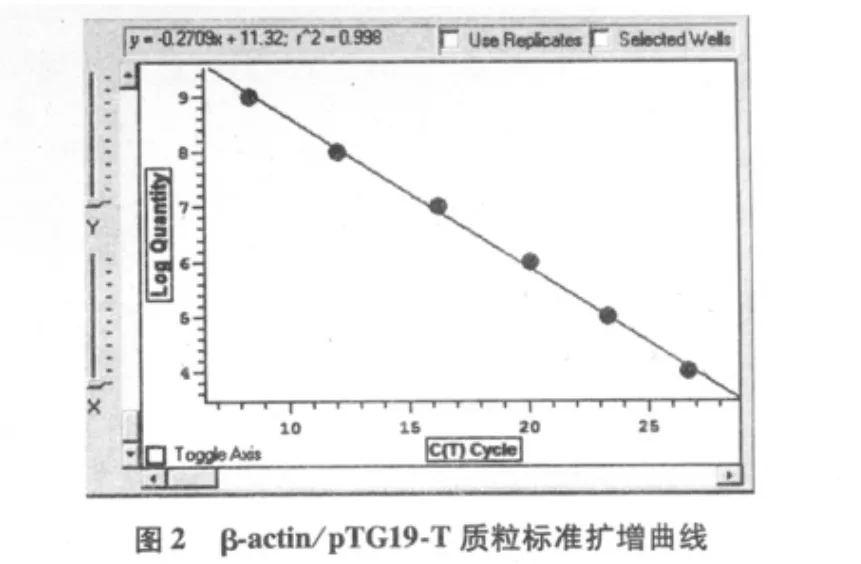
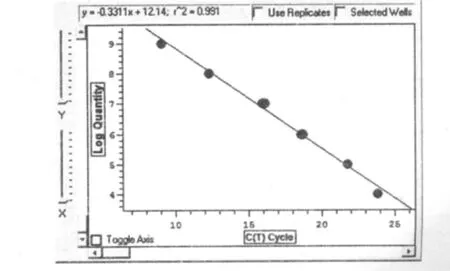
圖3 TIZ/pTG19-T質粒標準擴增曲線
2.3 TIZ-siRNA干擾片段細胞內介導前后細胞系TIZ mRNA表達的測定
由表1可見,TIZ-siRNA 554、652和573干擾片段細胞內介導后均可下調細胞TIZ mRNA表達,其中652和573干擾片段細胞內介導后下調細胞TIZ mRNA表達相對拷貝數,與陽性對照組和陰性對照組比較差異有統計學意義(P<0.01),其中又以TIZ-573下調TIZ擴增拷貝數最明顯。對TIZ-基因沉默率達60%。見圖8。
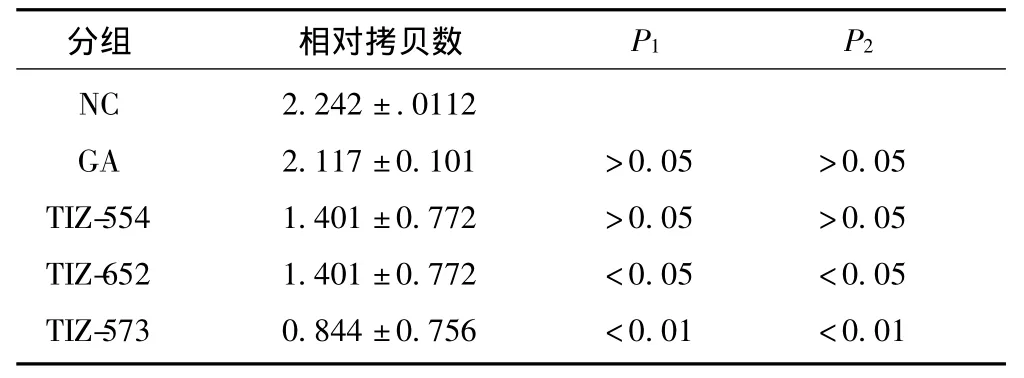
表1 轉染不同siRNA后QRT-PCR檢測TIZ基因拷貝數

圖6 不同siRNA對TIZ基因的抑制率
2.4 TIZsiRNA重組表達載體測序結果
將構建好的TIZ-573siRNA、陽性對照siRNA、陰性對照siRNA分別送北京諾賽生物公司測序,測序結果在NCBI上進行BLAST比對,將結果同源性達到97%以上送測序。TIZ基因干擾載體pGPU6/GFP/Neo-TIZ-573測序結果見圖7。
圖7 pGPU6/GFP/Neo-TIZ-573測序圖
3 討論
TIZ基因位于19q13上,C端有14個重復的鋅指蛋白結構域,因此也將此蛋白命名為鋅指蛋白675(ZNF675)。TIZN端(95aa~213aa)的鋅指結構與TRAF-6 N端的環指結構結合造成TRAF-6構型的改變,抑制了TRAF-6對下游信號分子的轉導作用[3]。已有研究證實TRAF-6參與了多種信號轉導因子如NF-κB、JNK、C-FOS 等的活化[4~8],進而激活了如細胞間黏附分子1(ICAM-1)、血管內皮生長因子(VEGF)、尿激酶型纖溶酶原激活劑(uPA)等,這些細胞信號轉導因子參與腫瘤的發生和發展過程[8,9]。
至于TIZ基因在卵巢惡性腫瘤中發揮何種作用,目前尚無文獻報道。本課題前期通過構建卵巢癌患者腹水腫瘤細胞cDNA文庫,采用改良的重組克隆表達抗原的血清學鑒定(SEREX)技術與抑制性消減雜交(SSH)方法相結合的策略,從文庫中篩選相關抗原基因 TIZ,采用重組腫瘤抗原的微量血清學檢測(SMARTA)法檢測TIZ抗原與卵巢癌患者和正常婦女的血清中相應自身抗體的陽性反應情況,結果示TIZ基因的重組抗原與卵巢癌患者血清中相應IgM型自身抗體反應的陽性率高于正常婦女血清反應的陽性率,差異均有統計學意義(P<0.05)[2]。因此,極有必要進一步探討TIZ基因在卵巢惡性腫瘤中的生物學作用。RNA干擾(RNA interference,RNAi)是指通過雙鏈RNA(double strand RNA,dsRNA)在特定酶參與下,特異性地抑制靶基因的轉錄后表達的現象。它通過人為地引入與內源靶基因具有同源序列的雙鏈RNA,誘導內源靶基因的mRNA降解,達到阻止基因表達的目的。是研究基因功能的重要技術方法[10]。siRNA介導細胞目前有瞬時轉染與穩定轉染二種方式。本研究采用構建穩定轉染重組表達載體方式,主要是基于TIZN端(95~213aa)的鋅指結構與TRAF-6 N端的環指結構結合造成TRAF-6構型的改變,從而發揮生物作用,TIZ可能是通過調節信號傳導通路而發揮作用而并非直接作用[3]。而穩定介導并沉黙TIZ基因后,有助于有充分的時間空間觀察TIZ基因敲除后對其所調節上下游基因的影響。
在siRNA實驗中有兩個關鍵點,一是靶細胞的選擇,它必須是被敲除目的基因的表達陽性者,本實驗采用RT-PCR方法檢測不同卵巢癌細胞株TIZ基因的表達情況,結果顯示卵巢癌細胞HO8910細胞無TIZ基因 mRNA表達,而 SKOV3、SKOV3順鉑耐藥、SKOV3卡鉑耐藥、A2780和A2780卡鉑耐藥細胞等均有TIZ基因mRNA表達。因此選擇SKOV3作為TIZ基因敲除的靶細胞對象。二是選擇有效的siRNA片段,由于siRNA片段設計從轉錄本(mRNA)的AUG起始密碼開始,尋找AA或者NA的二連序列,并記下其3’端的19個堿基序列,作為潛在的siRNA靶位點。同時于不同序列siRNA片段的結合復合物可能會影響siRNP核酸內切酶復合物結合mRNA,從而影響siRNA效果[11],因此選擇有效的siRNA片段非常關鍵。本實驗經瞬時轉染篩選,結果發現573號siRNA片段可以有效抑制TIZ基因mRNA的表達,573號干擾片段細胞內介導后下調細胞TIZ mRNA表達相對拷貝數最明顯,與陽性對照組和陰性對照組比較差異有統計學意義(P<0.01),對TIZ基因沉默率達60%,進而選擇573號siRNA構建了pGPU6/GFP/Neo-TIZ-573干擾載體,為進一步研究TIZ基因的功能及探討以TIZ基因為靶點的基因治療奠定了基礎。
[1] Shin JN,Kim I,Lee JS,et al.A novel zinc finger protein that inhibits osteoclastogenesis and the function of tumor necrosis factor receptor-associated factor 6[J].J Biol Chem,2002,277(10)∶8346-8353.
[2] 陽志軍,楊 光,蔣燕明,等.卵巢上皮性癌相關抗原的篩選和血清學檢測[J].中華婦產科雜志,2007,42(12)∶834-839.
[3] Kim N,Kadono Y,Takami M,et al.Osteoclast differentiation independent of the TRANCE-RANK-TRAF6 axis[J].J Exp Med,2005,202(5)∶589-595.
[4] Nu?ez C,Cansino JR,Bethencourt F,et al.TNF/IL-1/NIK/NF-kappa B transduction pathway:a comparative study in normal and pathological human prostate(benign hyperplasia and carcinoma)[J].Histopathology,2008,53(2)∶166-176.
[5] Bharti AC,Aggarwal BB.Ranking the role of RANK ligand in apoptosis[J].Apoptosis,2004,9(6)∶677-690.
[6] Frob?se H,R?nn SG,Heding PE,et al.Suppressor of cytokine signaling-3 inhibits interleukin-1 signaling by targeting the TRAF-6/TAK1 complex[J].Mol Endocrinol,2006,20(7)∶1587-1596.
[7] Kleinberg L,Dong HP,Holth A,et al.Cleaved caspase-3 and nuclear factor-kappaB p65 are prognostic factors in metastatic serous ovarian carcinoma[J].Hum Pathol,2009,40(6)∶795-806.
[8] Homsi J,Daud AI.Spectrum of activity and mechanism of action of VEGF/PDGF inhibitors[J].Cancer Control,2007,14(3)∶285-294.
[9] Hayes SH,Seigel GM.Immunoreactivity of icam-1 in human tumors,metastases and normal tissues[J].Int J Clin Exp Pathol,2009,2(6)∶553-560.
[10] Stewart SA,Dykxhoorn DM,Palliser D,et al.Lentivirus-delivered stable gene silencing by RNAi in primary cells[J].RNA,2003,9(4)∶493-501.
[11] Lois C,Refaeli Y,Qin XF,et al.Retroviruses as tools to study the immune system[J].Curr Opin Immunol,2001,13(4)∶496-504.

