轉移性肝癌的血供對肝動脈化療栓塞術療效評價
沈 飛 茅力平 孫雅君
肝臟血運豐富,有體循環和門靜脈雙重血供,進入體循環或門靜脈系統的癌細胞都有可能在肝內形成轉移病灶,因此轉移性肝癌的發病率較高[1]。如何提高治療轉移性肝癌的有效率是當前腫瘤研究中亟待解決的問題。本文回顧分析我科自2001年1月至2010年6月應用經肝動脈化療栓塞術(transcatheter arterial chemoembolization,TACE)治療34例轉移性肝癌的療效,探討轉移性肝癌的血供對TACE術療效的影響,現報道如下。
1 資料與方法
1.1 一般資料
2001年1月至2010年6月我院收治轉移性肝癌34例,男24例,女10例,年齡32~74歲,平均62.6歲。原發癌為胃癌13例,結、直腸癌13例,胰腺癌7例,乳腺癌1例。全部病例均經手術或病理活檢證實。轉移性肝癌均由B超、CT、MRI檢查中至少2種影像學檢查診斷。單發肝轉移灶3例,2個轉移灶7例,3個以上24例;TACE治療前原發病灶已得到控制,均為無手術指征或自愿放棄手術者,肝功能Child-Pugh均為A或B級,Karnofsky評分大于60分,血常規、肝腎功能、出凝血時間和心電圖等均正常,無介入治療禁忌證。富血供組12例,乏血供組22例。兩組轉移癌大小數目等均無差異(P>0.05)。
1.2 治療方法
TACE采用Seldinger法經皮右股動脈穿刺插管至腹腔動脈造影,了解肝動脈、胃十二指腸動脈及胃左動脈供血情況,再超選擇插管至肝固有動脈或腫瘤供血動脈造影,明確腫瘤性質、大小、位置、數目和染色程度等。然后超選擇腫瘤供血動脈緩慢灌注化療藥物和栓塞劑。化療藥物選擇靜脈化療有效的方案,常用化療藥物:氟脲嘧啶類(去氧氟脲苷、5-Fu)、鉑類(順鉑、奧沙利鉑)、阿霉素類(表阿霉素、吡柔比星、絲裂霉素等),通常選擇以5-Fu為基礎的二聯或三聯用藥,用藥劑量為全身化療的1/3~1/2,栓塞劑為超液態碘油與化療藥物注射劑混懸液,碘油5~20ml,平均9.2ml。根據患者身體狀況及療效以決定下次TACE,每患者最少1次,最多5次,全組共行105次TACE,平均3.1次。每隔4周行CT檢查,以便測量病灶和評價療效。
1.3 評價標準及隨訪
評價實體腫瘤療效參照WHO推薦的統一標準評價療效和毒副反應。療效評為完全緩解(CR),部分緩解(PR),穩定(NC)和進展(PD),有效率(RR)=CR+PR。轉移后生存期指發現肝轉移后治療開始至死亡的時間或隨訪截止時間,截止時間為2011年6月30日,通過門診或電話等進行隨訪。
1.4 統計學方法
計數資料采用χ2檢驗,兩組均數比較行t檢驗,Kaplan-Meier方法計算轉移后生存期。P<0.05為差異有統計學意義。
2 結果
2.1 轉移性肝癌的血供情況
肝轉移瘤的DSA表現主要分為富血供型和乏血供型[2]。富血供型:腫瘤血供比正常肝臟豐富,供血動脈增粗,腫瘤染色清晰且密度均勻,本組12例,占35.3%;乏血供型:腫瘤血供乏于肝臟,供血動脈纖細,可見受壓移位現象,不易顯示腫瘤血管及染色,實質期表現為單發或多發充盈缺損區,本組22例,占64.7%。兩組行χ2檢驗,差異有統計學意義(P<0.01),提示轉移性肝癌的血供以乏血供型為主。兩組轉移性肝癌的大小和數目比較差異無統計學意義(P>0.05)。見表1。

表1 兩組轉移性肝癌的大小和數目情況[n(%)]
2.2 近期臨床療效
34例轉移性肝癌中有效率為44.1%(15/34),其中富血供組有效率66.7%(8/12),乏血供組有效率31.8%(7/22),兩組臨床療效差異有統計學意義(P<0.05)。見表2。
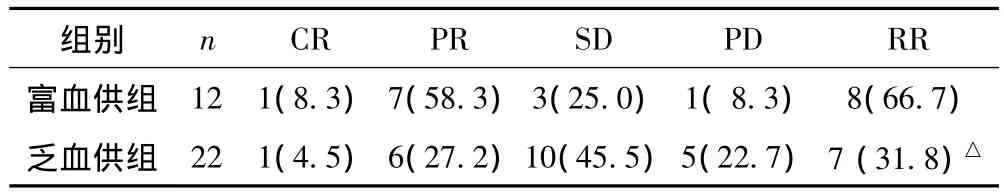
表2 轉移性肝癌TACE術后近期療效評價[n(%)]
2.3 轉移后生存分析
全部病例6、12月轉移后生存率分別為88.2%、50.0%,轉移后中位生存期15.6月,其中富血供組6、12月轉移后生存率分別為100%、75.0%,轉移后中位生存期21.6月;乏血供組6、12月轉移后生存率分別為81.8%、40.9%,轉移后中位生存期13.5月,兩組轉移后中位生存期差異有統計學意義(P<0.05)。見表3。兩組生存曲線見圖1。
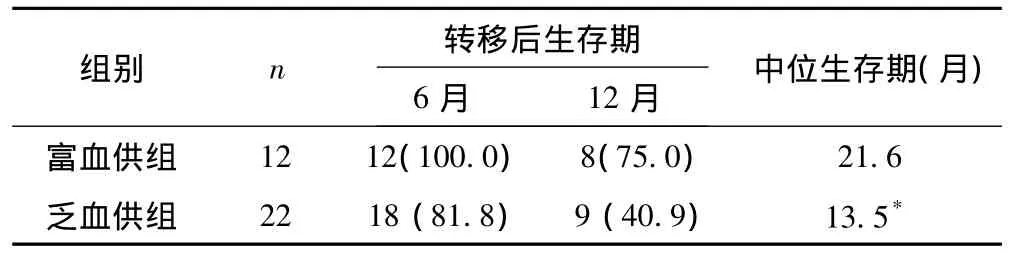
表3 兩組轉移性肝癌轉移后生存期情況[n(%)]
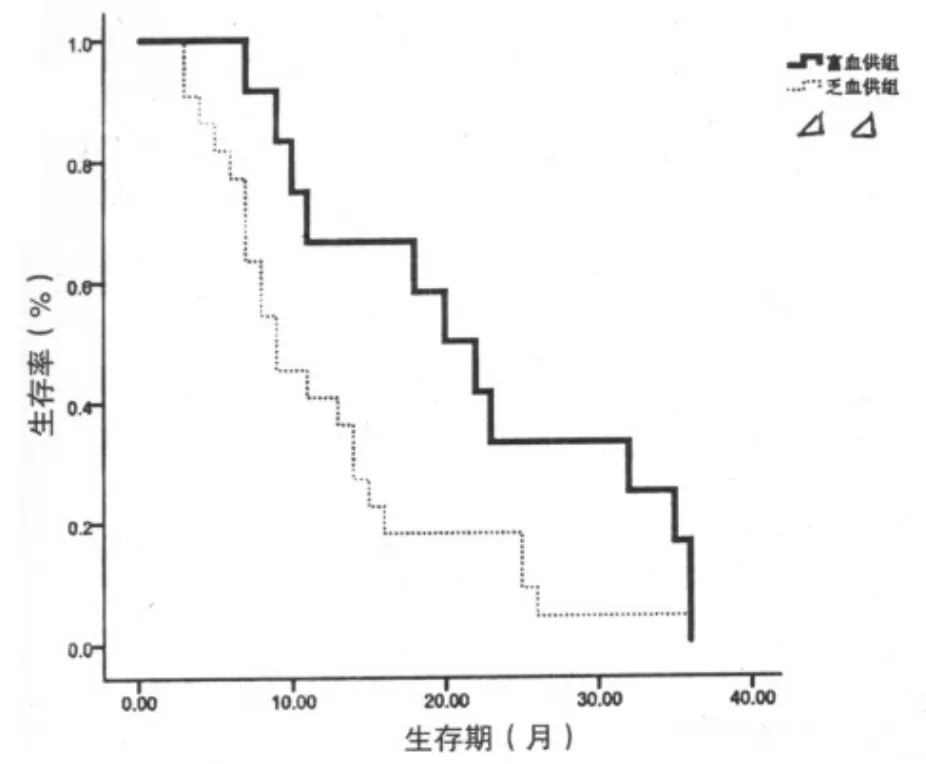
圖1 兩組生存曲線
2.4 毒副反應
治療后出現肝區輕微疼痛和惡心、嘔吐,部分患者出現術后短暫低熱等,但經對癥處理后一周均能緩解,未出現治療相關性死亡,亦未出現嚴重肝腎功能損害和骨髓抑制,兩組比較差異無統計學意義(P>0.05)。
3 討論
外科手術切除為根治性治療轉移性肝癌的首選療法,但由于肝臟轉移的部位、病灶數目的不同,臨床上能手術切除者并不多,僅20% ~25%的患者適合外科手術療法,而手術切除后仍有40%~70%的患者將有肝內腫瘤再次復發[3]。有報道轉移性肝癌患者不做治療的中位生存期為6個月,應用全身靜脈化療的中位生存期為9個月[4]。目前對轉移性肝癌的血供來源說法不一,但多數學者[5]傾向于以肝動脈供血為主,而病灶邊緣組織部分血供可能來自門靜脈。經肝動脈化療栓塞術(TACE)是重要的治療手段。通過動脈內插管到肝轉移灶,局部進行灌注或栓塞。經肝動脈灌注同位素標記的FUDR,在肝臟轉移灶的藥物濃度是門靜脈灌注的15倍,全身靜脈化療的400倍,某些化療藥物首次經過肝臟幾乎完全被攝取,保持腫瘤局部較高的藥物濃度和延長藥物與腫瘤的接觸時間,而外周血藥濃度并不明顯增加。栓塞阻斷轉移灶血供,導致了腫瘤凋亡;同時灌注藥物經過肺循環,可再次沖擊轉移灶,起到二次殺滅腫瘤的作用。灌注化療既重視局部病灶,又兼顧全身用藥,真正達到了高效、低毒的目的,這是經肝動脈進行介入治療的解剖基礎[6]。本組34例轉移性肝癌經TACE后的有效率為44.1%(15/34),患者治療后6、12月生存率分別為88.2%、50.0%,這和其他報道相仿[7]。同時全身毒副反應輕,患者均能耐受。
轉移性肝癌的血供是影響介入療效的最主要因素[8]。腫瘤血供越豐富,碘油沉積越好,阻斷腫瘤血管越完全、時間越長,導致腫瘤缺氧、凋亡、壞死越多,其療效越好,可提高生存率。本文中富血供和乏血供組轉移后中位生存期分別為21.6月和13.5月,其差異有統計學意義(P<0.05)。因此在仔細分析腫瘤的染色程度及其供血類型,對判斷患者預后有幫助[9]。
由此可見,TACE是治療轉移性肝癌的一種安全、有效治療方法,正確地運用介入治療技術,合理地使用化療藥物,可以有效地改善治療效果,提高生存率。
[1] Bilchik AJ.Arterial chemotherapy as adjuvant and palliative treatment of hepatic colorectal metastases:an update[J].Surgical Oncology Clinics of North A-merica,2003,12(1)∶193-210.
[2] 高中度,茅愛武,蔣霆輝.大腸癌肝轉移的介入治療[J].河北醫藥,2005,27(3)∶188-189.
[3] Kemeny N.Management of liver metastases from colorectal cancer[J].Oncology,2006,20(10)∶1161-1179.
[4] 湯釗猷.現代腫瘤學[M].上海:上海醫科大學出版社,2003∶548-550.
[5] 楊宏梅,鄭美珍.雙泵化療對大腸癌肝轉移灶切除后的療效[J].實用腫瘤學雜志,2005,19(6)∶449-450.
[6] 水會鋒,葛蓮英.肝動脈化療栓塞與靜脈化療治療結直腸癌肝轉移的療效[J].中國癌癥防治雜志,2010,2(1)∶18-21.
[7] 孫 毅,尚 革,包永星,等.77例直腸癌伴肝轉移患者的預后因素分析[J].中華腫瘤雜志,2010,32(8)∶662-665.
[8] 李國文,梁趙玉,于小平,等.肝轉移瘤血供對肝動脈化療栓塞的近期療效影響[J].介入放射學雜志,2010,19(6)∶493-496.
[9] 楊 光,于友濤,楊 奕,等.480例大腸癌肝轉移腫瘤不同血供介入治療的臨床研究[J].胃腸病學和肝病學雜志,2010,19(7)∶632-633.

