Lactuside B對缺血性腦損傷大鼠海馬和紋狀體NT-3 mRNA表達的影響
李平法, 李生瑩, 閆福林, 牛秉軒, 詹合琴
神經營養因子3(Neurotrophin-3,NT-3)是神經生長因子家族成員之一,其對感覺神經元、運動神經元和交感神經元的存活與功能有著十分重要的意義[1~3]。它能使受損的神經元長出側芽,促進神經損傷的修復,應用NT-3可使3/4的脊髓萎縮細胞發生逆轉,使細胞的存活數量明顯增加[4]。
近期,國內外學者研究發現NT-3與缺血性腦損傷關系密切,Zhang等將改良表達NT-3的神經干細胞移植到嚴重局部腦缺血的大鼠體內,結果顯示存活的移植干細胞分泌高水平的 NT-3[5],Benoit等人研究發現在腦缺血再灌注損傷期間,具有完整結構的補體C1q可以誘導神經元基因的表達,使NGF和NT-3表達增加,從而促進缺血后神經功能的恢復[6]。
本實驗小組前期研究發現高翅果菊提取物Lac-tuside B(LB)具有較好的抗腦缺血作用[7],但其作用機制不明。本研究擬從該單體化合物對大鼠缺血性腦損傷海馬和紋狀體NT-3表達的影響入手,擬闡明Lactuside B抗缺血性腦損傷的部分作用機制。
1 材料與方法
1.1 主要試劑、藥品及儀器 loading buffer和RT-PCR試劑盒(寶生物工程大連有限公司),DEPC液、溴化乙錠(美國Sigma公司),瓊脂糖(西班牙Biowest公司),50×TAE緩沖液(廣州威佳科技有限公司),D2000DNA分子量標記物(北京天根生化有限公司)和 Trizol(美國 Invertrogen公司),無水乙醇、異丙醇和氯仿(天津市德恩化學試劑有限公司);AG PCR擴增儀(德國Eppendorf公司),DYY-7C型水平電泳儀(北京市六一儀器廠),UV-2102PC紫外分光光度計(尤尼柯上海儀器有限公司),TGL-16G-A臺式高速低溫離心機(上海安亭科學儀器廠),MDF-U4086S超低溫冰箱(日本 SANYO公司),TOCAN240凝膠成像系統(上海領成生物科技有限公司);尼莫地平注射液(山東方明藥業股份有限公司),水合氯醛粉劑(天津市瑞金特化學品有限公司);LB(由新鄉醫學院藥學院藥化教研室閆福林教授提供,為白色粉末狀,純度>98%)。
1.2 實驗動物、分組與給藥 動物采用健康清潔Ⅱ級雄性SD大鼠,體重280~320g,購自河南省實驗動物中心,動物合格證號:SYXK(豫)2005-0012。動物隨機被分為:假手術組、模型組、陽性藥物對照組、LB低劑量組(12.5mg/kg)、中劑量組(25mg/kg)和高劑量組(50mg/kg),共6組,8只/組。所有動物于再灌后每天給藥1次,均按5ml/kg腹腔注射給藥。假手術組、模型組分別給予等體積的蒸餾水,陽性對照組給予尼莫地平(1mg/kg),LB低、中、高劑量組分別給予相應劑量的實驗藥物。各組動物于再灌注24h和72h后分別處死4只,進行RT-PCR實驗。實驗過程對動物的處理符合中華人民共和國科學技術部2006年頒布的《關于善待實驗動物的指導性意見》。
1.3 大鼠大腦中動脈阻塞線的制備 1.5號日本漁線(DaDong Yang制造),直徑 0.2mm,剪成5cm的數小段,將其末端靠近火焰燒圓,在長2.0cm處做標記,放入肝素鈉溶液中浸泡備用。
1.4 大鼠缺血性腦損傷模型的制備及模型成功判定指標 大鼠大腦中動脈缺血再灌注損傷模型的制備參照Longa[8]線栓法和本組實驗方法制備大鼠大腦中動脈缺血再灌注損傷模型(動物麻醉采用10%的水合氯醛),將預先制備好的阻塞線插入頸內動脈(intemal carotid artery,ICA),插入長度為2.0cm,假手術組阻塞線插入ICA長度為0.5cm,將動物傷口處縫合后回籠飼養。所有動物均阻塞2h后再把阻塞線球端拉回頸外動脈進行再灌注,動物在手術清醒后和處死前根據Zea-longa評分法[8]進行神經缺損癥狀評分。
1.5 RT-PCR方法檢測NT-3基因的轉錄水平取所需實驗大鼠斷頭取腦,快速分離出雙側海馬和紋狀體(取殼核和尾狀核的全部條紋狀組織)在液氮中磨碎,Trizol抽提總RNA,檢測其純度和濃度保證所提的RNA無降解和污染。用TaKaRa pime-Script TM RT-PCR試劑盒合成cDNA模板,以β-actin基因作為內參基因。PCR反應溶液為50μl,上下游引物(見表1)各0.5μl(100μmol/L)。PCR 反應條件為:95℃ 5min;95℃ 30s、50℃ 30s、72℃ 1min,30個循環;72℃ 10min。PCR產物在2%瓊脂糖凝膠進行電泳,凝膠成像分析儀拍照記錄后用Quantity One圖像分析軟件測定各條帶灰度,以擴增的特異性目的片段灰度值與同時擴增的內參β-actin片段灰度值的比值作為特異性擴增目的片段的半定量檢測值,每組每只實驗重復3次,求其平均值。
2 結果
2.1 大腦中動脈缺血再灌注模型成功的判定和LB對大鼠神經行為學評分的影響 手術動物麻醉清醒后,假手術組大鼠活動正常,無神經功能缺損癥狀。模型組大鼠則出現不同程度的神經缺損表現,如左側前肢屈曲內收、爬行時向左側劃圈、站立時向左側傾倒和意識喪失等,神經行為學評分在1~4分之間。LB各劑量組在缺血再灌注24h和72h后,均可降低大鼠的神經行為學評分,與模型組比較有顯著性差異(P<0.05或 P<0.01),其中劑量組作用較強,與陽性藥物對照組比較有顯著性差異(P<0.05或 P <0.01);用藥72h后 LB 低、中劑量組神經行為學評分低于用藥24h,中劑量組有顯著性差異(P <0.05或 P <0.01)(見表2)。
2.2 LB對大鼠缺血性腦損傷海馬組織各時段NT-3 mRNA的影響 實驗顯示:LB各劑量組均能增加海馬NT-3 mRNA的表達,與模型組比較有顯著性差異(P<0.05或 P<0.01),其低、中劑量組作用較好優于陽性對照藥(P<0.05或 P<0.01),用藥72h較用藥24h的作用更強,兩者相比有顯著性差異(見表3、圖1)。
2.3 LB對缺血性腦損傷大鼠紋狀體各時段NT3 mRNA的影響 結果顯示:LB各劑量組均能增加紋狀體NT-3 mRNA的表達,與模型組比較有顯著性差異(P<0.05或 P<0.01),其中、低劑量組優于陽性對照藥(P<0.05或 P<0.01),用藥72h較用藥24h的作用更強,兩者相比有顯著性差異(見表4、圖2)。
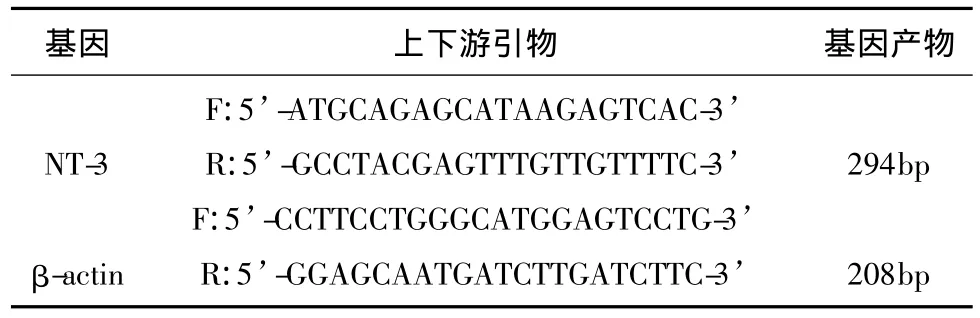
表1 NT-3和β-actin的上下游引物
表2 LB對缺血性腦損傷大鼠神經缺損癥狀評分的影響±s)
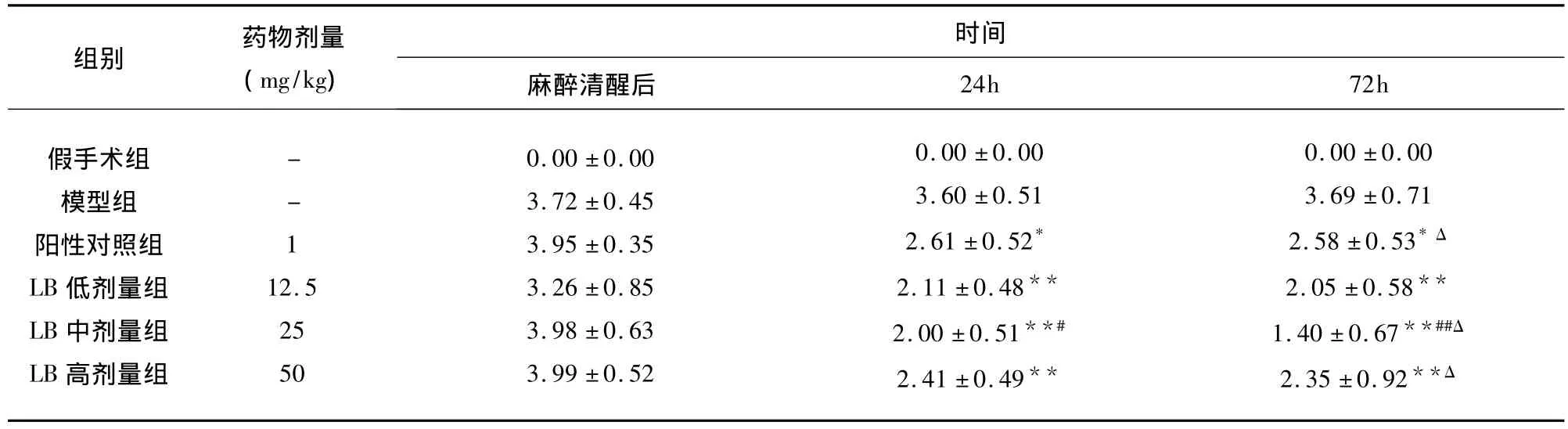
表2 LB對缺血性腦損傷大鼠神經缺損癥狀評分的影響±s)
與模型組比較*P <0.05,**P <0.01;與陽性藥物對照組比較#P <0.05,##P <0.01;與用藥24h比較 ΔP <0.05,ΔΔP <0.01
組別 藥物劑量(mg/kg)時間麻醉清醒后24h 72h假手術組模型組陽性對照組LB低劑量組LB中劑量組LB高劑量組--112.525500.00 ±0.003.72 ±0.453.95 ±0.353.26 ±0.853.98 ±0.633.99 ±0.520.00 ±0.003.60 ±0.512.61 ±0.52*2.11 ±0.48**2.00 ±0.51**#2.41 ±0.49**0.00 ±0.003.69 ±0.712.58 ±0.53*Δ 2.05 ±0.58**1.40 ±0.67**##Δ 2.35 ±0.92**Δ
表3 LB對缺血性腦損傷大鼠海馬NT-3 mRNA表達的影響±s)
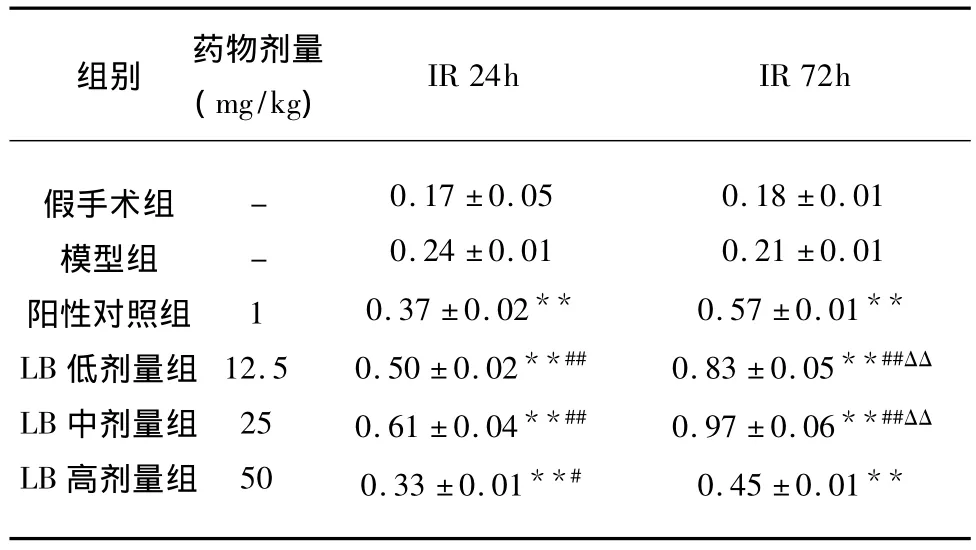
表3 LB對缺血性腦損傷大鼠海馬NT-3 mRNA表達的影響±s)
與模型組比較*P<0.05,**P<0.01;與陽性藥物對照組比較#P <0.05,##P <0.01;與用藥24h 比較 ΔP <0.05,ΔΔP <0.01
組別 藥物劑量(mg/kg)IR 24h IR 72h假手術組模型組陽性對照組LB低劑量組LB中劑量組LB高劑量組--112.525500.17 ±0.050.24 ±0.010.37 ±0.02**0.50 ±0.02**##0.61 ±0.04**##0.33 ±0.01**#0.18 ±0.010.21 ±0.010.57 ±0.01**0.83 ±0.05**##ΔΔ 0.97 ±0.06**##ΔΔ 0.45 ±0.01**
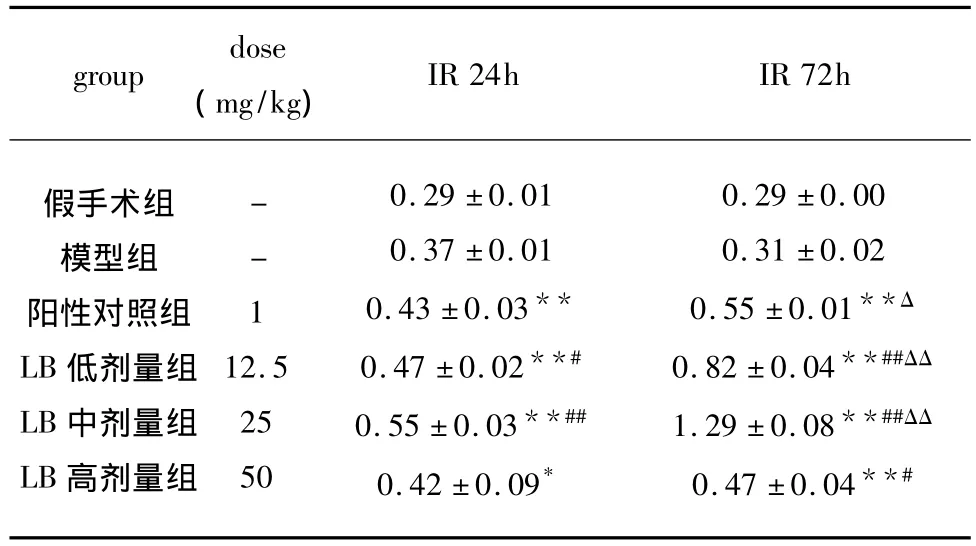
表4 LB對缺血性腦損傷大鼠紋狀體NT-3 mRNA表達的影響
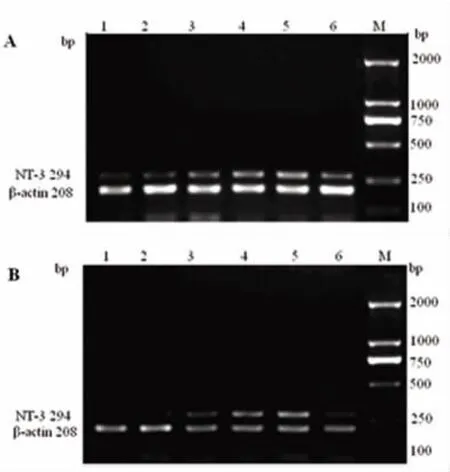
圖1 Lactuside B對缺血性腦損傷大鼠海馬NT-3 mRNA表達的影響(PCR電泳圖)
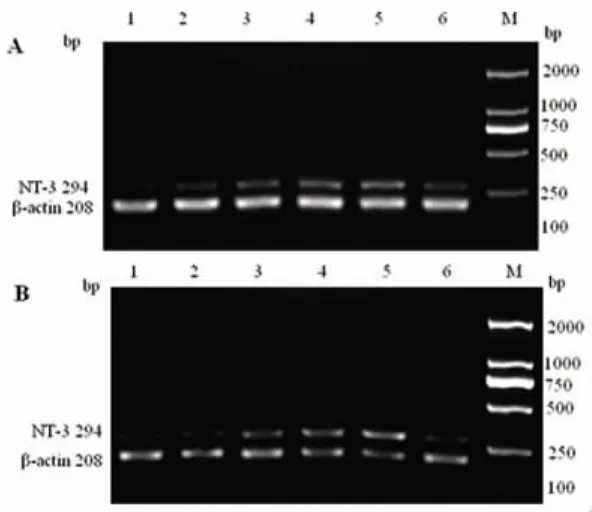
圖2 LB對缺血性腦損傷大鼠紋狀體NT-3 mRNA表達影響(PCR電泳圖)
3 討論
缺血性腦損傷是由于各種原因引起的腦部供血減少或中斷而導致的以神經感覺和運動障礙為主的一類腦血管性疾病,臨床上多見于腦血栓形成或腦栓塞,其它如藥物中毒、心臟驟停等原因也可導致不同程度的腦缺血性損傷。
缺血性腦損傷有著復雜的病理生理過程,由于腦血流的急性中斷和隨后的再灌注發生,可導致不同腦區的神經細胞廣泛損傷。腦缺血后神經損害主要發生在大腦皮質和紋狀體[9,10],海馬部位的神經元也易受累[11,12]。
有研究認為神經營養因子-3(NT-3)在保護神經細胞、避免其損傷死亡的過程中起著一個重要的作用,缺血性腦損傷的危險因素可下調其在腦部的表達[13]。也有研究發現,腦缺血后海馬 NT-3維持一定水平在某時間范圍內有利于腦缺血[14]。
雖然NT-3對于缺血性腦損傷的保護作用早已被人們所認知,但許多研究證實腦缺血后皮質、海馬部位的 NT-3表達減少[15,16],此可能是腦組織對缺血損害的一種防御性反應。本實驗研究發現,缺血性腦損傷24h和72h后模型組動物的NT-3 mRNA在海馬和紋狀體卻表達增多,主要原因可能為本實驗所采用的時間點與其它研究有較大的差別,以往NT-3在腦組織的基因或蛋白表達研究都是在腦缺血后十幾分鐘或幾小時之內取材,而本實驗依據給藥需要設置的時間點較長。Yang等研究報道,用核酶保護和原位雜交法檢測短暫性腦缺血大鼠海馬神經元時發現NT-3的表達趨勢是先下降后上升[17],故本實驗結果與其它研究結果并不背離。
本實驗研究還發現,在缺血性腦損傷大鼠的海馬和紋狀體組織,Lactuside B各劑量組均能增加其NT-3 mRNA的表達,且中、低劑量組優于陽性對照藥,用藥72h NT-3 mRNA表達更多。實驗結果提示:Lactuside B良好的抗腦缺血作用與其能夠上調、維持海馬和紋狀體NT-3 mRNA的表達有關,但兩部位NT-3 mRNA的表達與其蛋白的表達是否一致,尚需在以后的實驗中去研究證實。
目前,對于缺血性腦損傷的有效治療除了在治療窗內進行溶栓外,其它的藥物治療主要傾向于神經功能的保護,但能見諸于臨床并有確切作用的藥物很少。有關Lactuside B抗缺血性腦損傷的作用和作用機制的研究,將為其作為神經功能保護的潛在新藥提供一定的理論基礎和實驗依據。
[1] Friedman WJ,Ibanez CF,Hallbook F,et al.Differential actions of neurotrophins in the locus coeruleus and basal forebrain[J].Exp Neurol,1993,119(1):72 - 78.
[2] Hohn A,Leibrock J,Bailey K,et al.Identification and characterization of a novel member of the nerve growth factor/brain-derived neurotrophic factor family[J].Nature,1990,344(6264):339 - 341.
[3] Farinas I,Jones KR,Backus C,et al.Severe sensory and sympathetic deficits in mice lacking neurotrophin-3[J].Nature,1994,369(6482):658-661.
[4] Bradbury EJ,King VR,Simmons LJ,et al.NT-3,but not BDNF,prevents atrophy and death of axotomized spinal cord projection neurons[J].Eur JNeurosci,1998,10(10):3058 - 3068.
[5] Zhang ZH,Wang RZ,Wang RZ,et al.Transplantation of neural stem cells modified by human neurotrophin-3 promotes functional recovery after transient focal cerebral ischemia in rats[J].Neurosci Lett,2008,444(3):227 -230.
[6] Benoit ME,Tenner AJ.Complement protein C1q-mediated neuroprotection is correlated with regulation of neuronal gene and microRNA expression[J].JNeurosci,2011,31(9):3459 -3469.
[7] 詹合琴,郭蘭青,崔建敏,等.高翅果菊化學成分及lactuside B的抗腦缺血活性研究[J].中草藥,2010,41(5):692-696.
[8] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[9] Hou SW,Wang YQ,Xu M,et al.Functional integration of newly generated neurons into striatum after cerebral ischemia in the adult rat brain[J].Stroke,2008,39:2837 -2844.
[10] Tanaka K,Wada N,Ogawa N,et al.Chronic cerebral ischemia-repoperfusion induces transient reversible monoaminergic changes in the rat brain[J].Neurochem Res,2000,25(2):313 - 320.
[11] Sasaki T,Hamada J,Shibata M,et al.Inhibition of nitric oxide production during global ischemia ameliorates ischemic damage of pyramidal neurons in the hippocampus[J].Keio JMed,2001,50(3):82-87.
[12] Ray AM,Benham CD,Roberts JC,et al.Capsazepine protects against neuronal injury caused by Oxygen Glucose Deprivation by Inhibiting 1h[J].J Neurosci,2003,23(31):10146 -10153.
[13] Yang JT,Chang CN,Wu JH,et al.Cigarette smoking decreases neurotrophin-3 expression in rat hippocampus after transient forebrain ischemia[J].Neurosci Res,2008,60(4):431 -438.
[14] Yang JT,Chang CN,Lee TH,et al.Hyperbaric oxygen treatment decreases post-ischemic neurotrophin-3 mRNA down-regulation in the rat hippocampus[J].Neuroreport,2001,12(16):3589 -3592.
[15] Takeda A,Onodera H,Yamasaki Y,et al.Decreased expression of neurotrophin-3 mRNA in the rat hippocampus following transient forebrain ischemia[J].Brain Res,1992,569(1):177 -180.
[16] 李宗敏,李 莉,陳立君,等.局部亞低溫對大鼠局灶腦缺血再灌注后神經營養因子-3表達的影響[J].國際病理科學與臨床雜志,2009,29(1):6 -9.
[17] Yang JT,Chang CN,Lee TH,et al.Effect of dexamethasone on the expression of brain-derived neurotrophin factor and neurotropuin-3 messenger ribonucleic acid after forebrain ischemia in the rat[J].Crit Care Med,2002,30(4):913 -918.

