以甘油為原料合成2,3-環氧丙醇
呂學功,王赤炎,王麗紅
(1.唐山市燃氣集團有限公司,河北 唐山 063000;2.唐山師范學院 化學系,河北 唐山 063000)
近年來,在石化能源緊張情況下,生物柴油作為一種極有發展前景的生物能源得到了迅速發展[1-2]。在生物柴油的生產過程中會產生10%左右的副產甘油,因此生物柴油生產的大量增長,帶來了其副產甘油的過剩,甘油價格驟降,據估計,2009~2010年甘油產量將超過45.4萬t/ a,遠大于甘油的傳統市場規模[3]。由此,利用甘油生產高附加值化工產品,開發甘油新的利用途徑,成了近期化工行業的研究熱點之一。
粗甘油可以通過各種工藝路線轉化為1,3-丙二醇、環氧氯丙烷、乳酸、聚羥基脂肪酸酯、氫、二羥基丙酮和1,2-丙二醇等高附加值產品[4],但現在的研究主要集中在1,3-丙二醇和環氧氯丙烷上[5-7],其他方面的報道甚少,為進一步拓寬甘油的利用途徑,本文對以甘油為原料合成2,3-環氧丙醇的方法進行了探索。
2,3-環氧丙醇又名縮水甘油(以下簡稱環氧丙醇),主要用作環氧樹脂稀釋劑、塑料和纖維改性劑、鹵代烴類的穩定劑、食品保藏劑、殺菌劑、制冷系統干燥劑和芳烴萃取劑等,其衍生物是樹脂、塑料、醫藥、農藥和助劑等的工業原料。目前工業上是以烯丙醇為原料,在催化劑存在下用過氧化氫作環氧化劑制得,如采用甘油為原料,不僅可以降低成本,還可擺脫對石油資源的依賴。
本文以甘油為原料,兩步法合成了2,3-環氧丙醇,首先以甘油為原料制備了3-氯-1,2-丙二醇,然后3-氯-1,2-丙二醇在氫氧化鈉存在下環化為環氧丙醇,制備反應式如下:
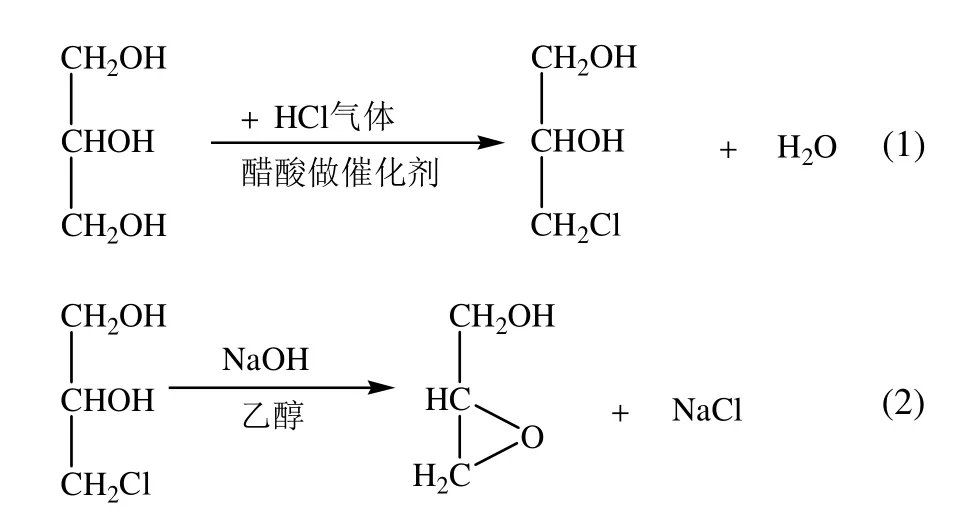
1 實驗部分
1.1 試劑與儀器
試劑:HCl氣體按照文獻[8]中的鹽酸滴入濃硫酸的方法制備,產氣速度通過鹽酸的滴加速度控制。甘油,冰醋酸,氫氧化鈉,無水乙醇,均為AR。3-氯-1,2-丙二醇,環氧丙醇的標樣均購自百靈威。
儀器:Agient6890N氣相色譜儀,SHZ-D(Ⅲ)循環水式真空泵,ZXZ-2型旋片式真空泵。
1.2 合成
1.2.1 3-氯-1,2-丙二醇的制備
在三口瓶內加入一定量的甘油和冰醋酸,加熱至 70℃保溫,通入氯化氫氣體,氯化氫氣體通過一個特制的玻璃氣體分布頭以鼓泡的方式與甘油接觸反應,未反應的尾氣用堿液吸收,產氣裝置中濃硫酸溫度控制在 60℃,鹽酸滴加速度控制在40滴/min。控制反應溫度100℃-105℃,當反應液的重量增加至初始液重量的150%,停止通氣,結束反應。
將反應裝置改為減壓蒸餾裝置,用循環水式真空泵對反應液進行減壓蒸餾(真空度0.1MPa),收集 40-65℃之間的餾出液,以除去其中的鹽酸、醋酸、以及生成的水;然后再用旋片式真空油泵對反應液進行減壓蒸餾(真空度在101Kpa),收集 80-85℃之間餾分,即為 3-氯-1,2-丙二醇。產品外觀為無色略粘稠的液體。
產品經氣相色譜分析質量分數大于 99.0%,測定條件為毛細管柱(30m×0.319mm×0.25μm),FID檢測器,載氣為N2;分流比為80:1;檢測器溫度250℃;進樣口溫度260℃;柱溫程序升溫,初始溫度為70℃,保持1min,15℃/ min升至110℃,保持1 min,25℃/ min升至200℃,保持1min;進樣量1μl。采用面積歸一法定量。
1.2.2 環氧丙醇的制備
0.5 mol的NaOH溶于200ml的無水乙醇中配成溶液,0.5mol的3-氯-1,2-丙二醇溶于100ml無水乙醇配成溶液,冰浴冷卻。冷卻后的NaOH乙醇溶液加入三口瓶中,冰浴,開動攪拌,滴加3-氯-1,2-丙二醇乙醇溶液,10min內滴完,再繼續反應20min。過濾反應液,除去固體,濾液用循環水式真空泵減壓蒸餾(真空度 0.1MPa),64-66℃之間餾分為環氧丙醇,64℃以前為乙醇和生成的水。產品外觀為無色液體,比重1.12。產品經氣相色譜分析質量分數大于99.0%,測定條件同1.2.1。
2 結果與討論
2.1 甘油氯化的催化劑
反應式(1)所示的甘油氯化制備 3-氯-1,2-丙二醇的反應常采用羧酸做催化劑,為比較不同種類羧酸的催化效果,分別以冰醋酸、正丁酸、乙二酸、丁二酸、己二酸做催化劑,測定了不同催化劑下反應液的增重速率,結果如表1所示。反應液的增重速率越快,反應速度越快,催化劑的催化效果越好,由表1可見,冰醋酸、丁二酸、己二酸的催化效果較好,正丁酸、乙二酸的催化效果較差。考慮到冰醋酸的沸點(118.1℃)遠低于丁二酸(235℃)和己二酸(337.5℃),在反應液的蒸餾過程中先于 3-氯-1,2-丙二醇和生成的水份一起蒸出,降低了3-氯-1,2-丙二醇的提純難度,所以冰醋酸為最優的催化劑。
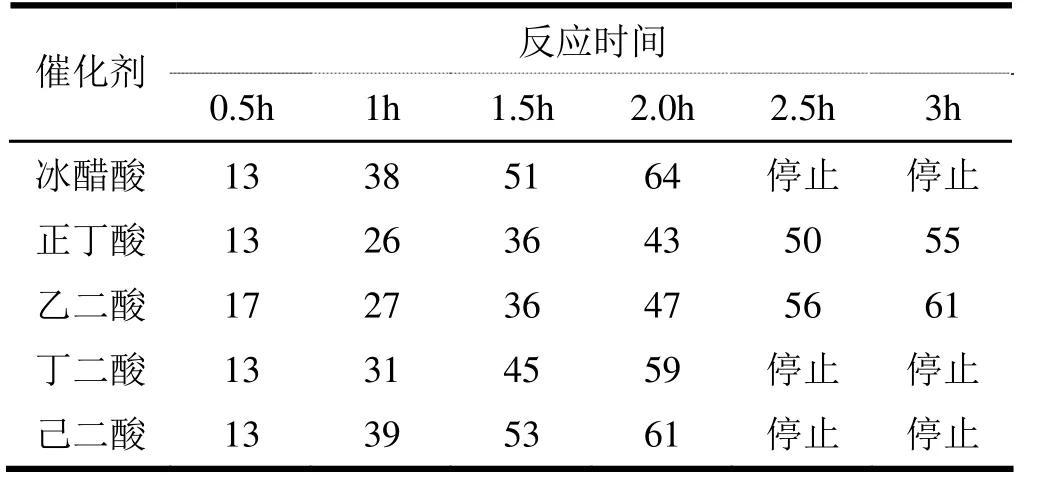
表1 不同催化劑催化時反應液增重速率
2.2 催化劑的用量
不同冰醋酸用量下反應達到終點時所需的時間見表2。當冰醋酸和甘油的摩爾比大于0.2:1時,反應時間明顯縮短,所以冰醋酸的最佳用量為甘油摩爾數的0.2倍。此反應中,反應終點的控制尤其重要,到達反應終點時應及時停止通氣,否則3-氯-1,2-丙二醇中的羥基將進一步被氯原子取代生成二氯丙醇。本實驗中用反應液的增重來控制反應終點,當反應液增重至初始液重量的150%時,恰好是甘油中的羥基被一個氯原子取代。

表2 冰醋酸用量的影響
2.3 3-氯-1,2-丙二醇的環化
反應式(2)所示的反應為3-氯-1,2-丙二醇在堿性條件下脫掉一分子的HCl生成環氧丙醇。實驗表明,3-氯-1,2-丙二醇在NaOH水溶液的堿性條件下并不能發生上述的環化反應,這可能是因為環化反應產物里有水生成,NaOH水溶液中大量水的存在抑制了環化反應向右進行,為使反應向生成環氧丙醇的方向進行,反應需在無水的環境下進行,因此選用NaOH的乙醇溶液作為3-氯-1,2-丙二醇環化的堿性條件。其次,通過熱力學計算得知環化反應為放熱反應,為及時移出反應熱,促進反應向右進行,環化反應過程中用冰浴冷卻。
實驗結果表明,在NaOH的乙醇溶液中環化反應速率很快,30min內反應進行已很徹底,不同 3-氯-1,2-丙二醇和NaOH配比下的反應結果如表3所示。由表3可見,環化反應中3-氯-1,2-丙二醇和NaOH最佳摩爾比為1: 1,最佳環化時間為30min。環化反應中NaOH不宜過量,NaOH過量會導致后續的蒸餾過程中隨著乙醇的蒸出,NaOH從蒸餾液中以固體形式析出,影響3-氯-1,2-丙二醇餾分的收集和蒸餾過程,增加了蒸餾操作的難度。

表3 NaOH用量的影響
3 結論
(1)以廉價的甘油為原料,采用兩步反應制備了環氧丙醇:第一步,甘油和氯化氫氣體在冰醋酸的催化下發生一氯取代反應,生成3-氯-1,2-丙二醇;第二步:3-氯-1,2-丙二醇在NaOH乙醇溶液中發生環化反應,生成環氧丙醇。
(2)甘油氯化為 3-氯-1,2-丙二醇的反應可以用羧酸類物質做為催化劑,最佳催化劑為冰醋酸,在蒸餾純化的過程中隨生成的水蒸出,降低了提純的難度。冰醋酸的最佳用量為甘油摩爾數的0.2倍。
(3)環化反應需在無水的堿性條件下進行,在NaOH的乙醇溶液中環化時,3-氯-1,2-丙二醇和 NaOH最佳摩爾比為1: 1,最佳環化時間為30min。環化反應中NaOH不宜過量。

